Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислотно-основное титрование
Содержание
- 1. Кислотно-основное титрование
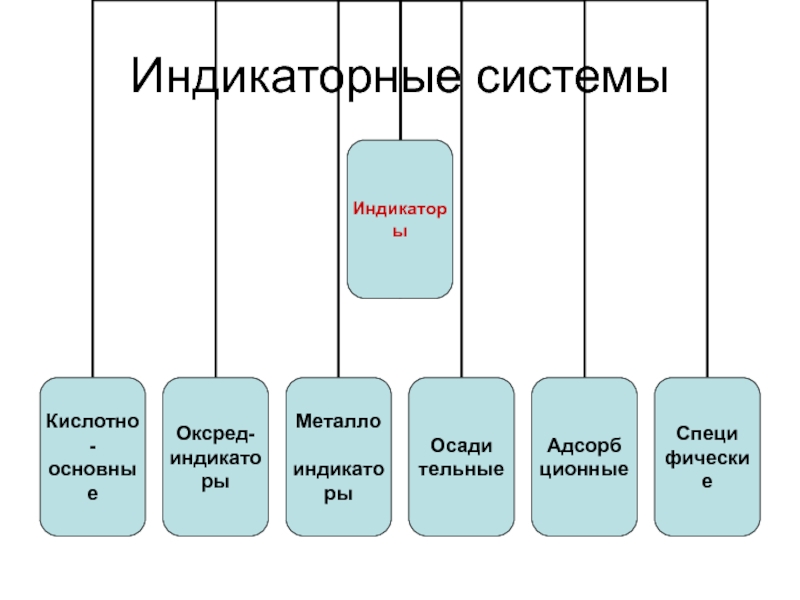
- 2. Индикаторные системы
- 3. Индикаторные системыПоказатель титрования рТ – значение рН,
- 4. Кислотно-основные индикаторыСлабые органические кислоты или основания, т.е.
- 5. Изменение окраски индикатора наступает при определенном значении
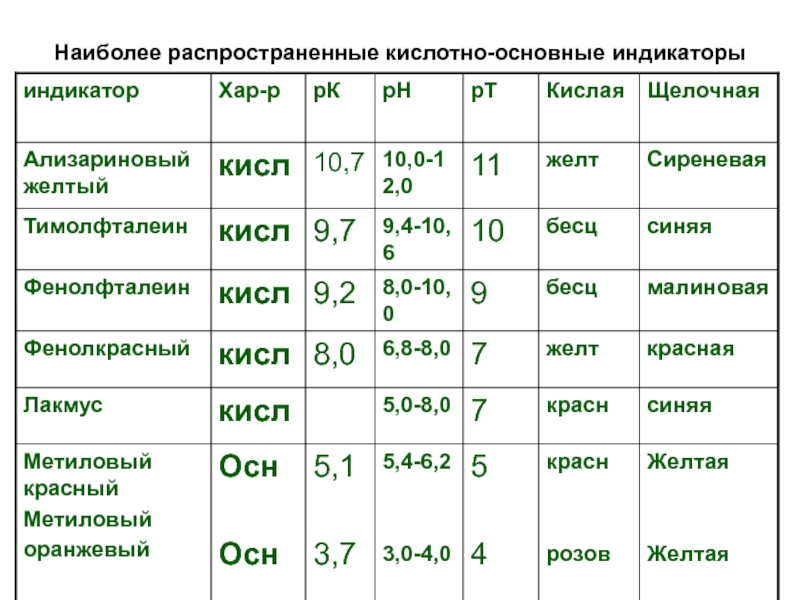
- 6. Наиболее распространенные кислотно-основные индикаторы
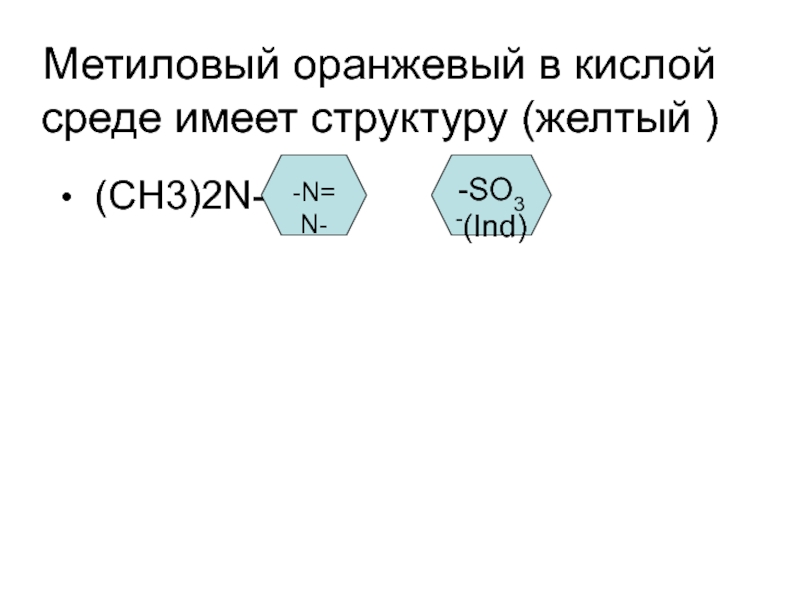
- 7. Метиловый оранжевый в кислой среде имеет структуру
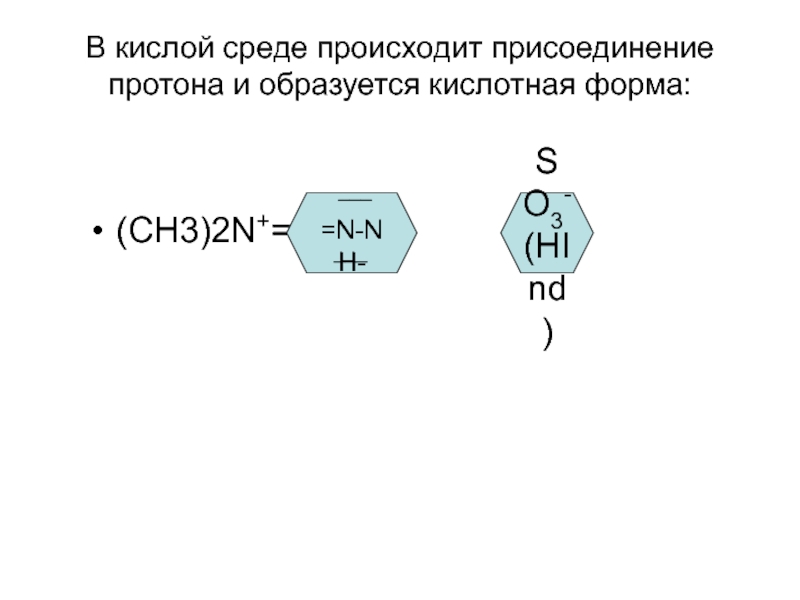
- 8. В кислой среде происходит присоединение протона и
- 9. Требования к кислотно-основным индикаторамБыть чувствительными, чтобы расход
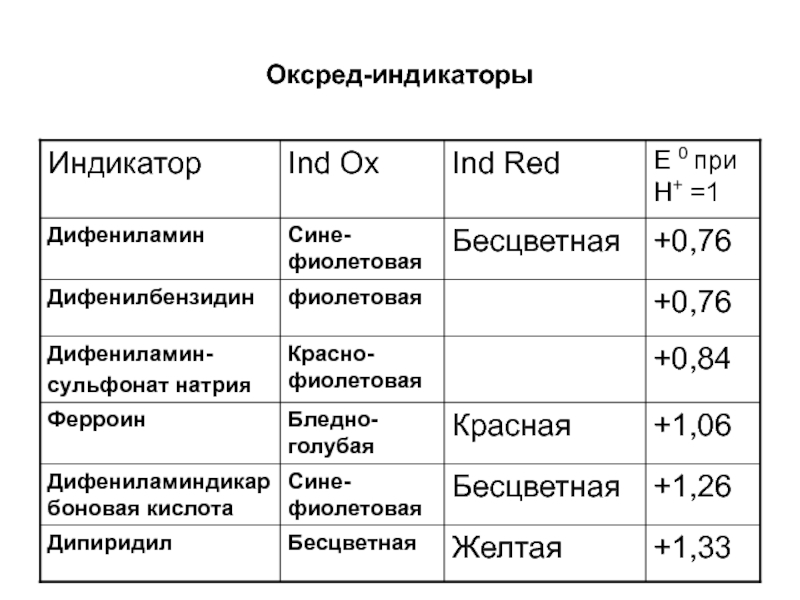
- 10. Окислительно-восстановительные (оксред-индикаторы)Органические соединения, изменение окраски которых связано с процессами окисления и восстановления:Ind ox+ne↔ IndRed
- 11. Оксред-индикаторы
- 12. Металлоиндикаторы (металлохромные индикаторы)Хромоген черныйH2Ind- +H+ pK=6,3 Ind2-+2H+
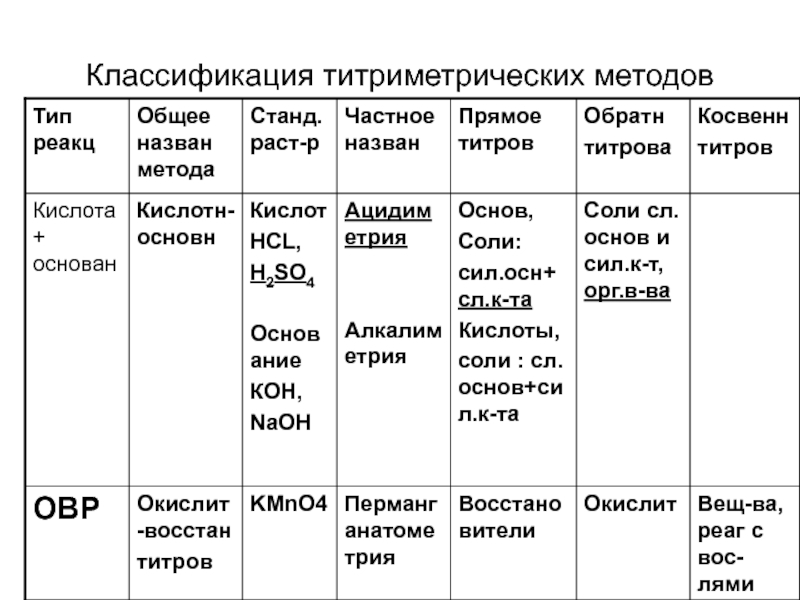
- 13. Классификация титриметрических методов
- 14. Кислотно-основное титрованиеЭто экспериментальная методика определения концентрации кислоты
- 15. Точка эквивалентностиДостигается в тот момент, когда к
- 16. Область переходаИнтервал значений рН, в пределах которого
- 17. Для каждого случая титрования пригодны только те
- 18. Методика кислотно-основного титрованияК анализируемому раствору из бюретки
- 19. Случаи титрования1 - сильную кислоту титруют сильным
- 20. Кривая титрованияВыделяют:А) область до начала титрованияБ) область
- 21. До начала титрования значение рН титруемого раствора
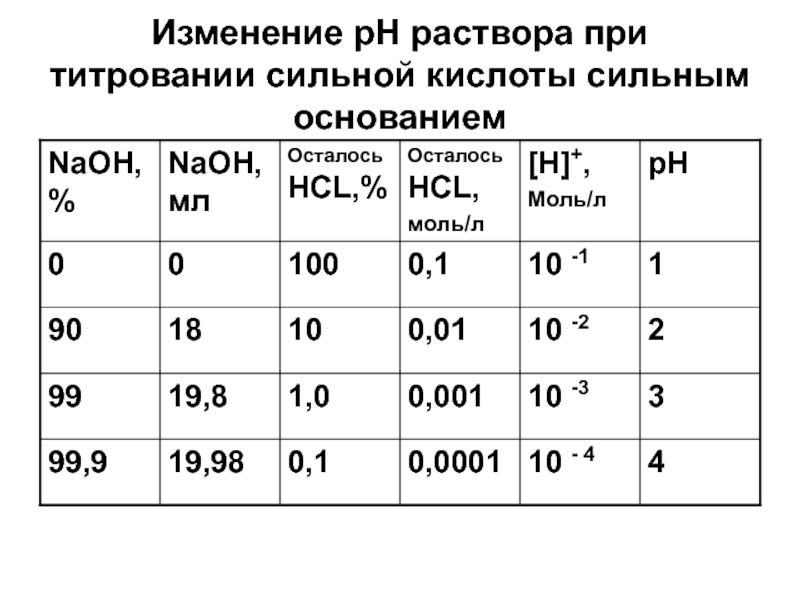
- 22. Изменение рН раствора при титровании сильной кислоты сильным основанием
- 23. Точка эквивалентности
- 24. Избыток NaOH
- 25. Кривая титрования 0,1 н хлороводородной кислоты 0,1
- 26. Выбор индикатораФенолфталеинМетиловый оранжевыйМетиловый красный
- 27. ВыводПри титровании сильной кислоты сильным основанием пригоден любой из четырех важнейших индикаторов метода нейтрализации
- 28. Скачать презентанцию
Индикаторные системы
Слайды и текст этой презентации
Слайд 3Индикаторные системы
Показатель титрования рТ – значение рН, при котором наблюдается
резкое изменение окраски индикатора.
с данным индикатором.Слайд 4Кислотно-основные индикаторы
Слабые органические кислоты или основания, т.е. Представляют собой сопряженную
пару, кислотная и основная форма которых различаются по цвету, более
слабые чем титруемые вещества.Слайд 5
Изменение окраски индикатора наступает при определенном значении рН раствора:
HInd↔ H+
+Ind –
Если рН(рКInd+1) –
щелочной формой.Переход окраски в определенном интервале рН.
Слайд 8В кислой среде происходит присоединение протона и образуется кислотная форма:
(СН3)2N+=
=N-NH-
SO3-(HInd)
___
___
Слайд 9Требования к кислотно-основным индикаторам
Быть чувствительными, чтобы расход индикатора был как
можно меньше
Равновесие между обеими формами должно устанавливаться быстро
Обе (или одна
у одноцветных) должны быть интенсивно окрашеныИнтервал перехода окраски индикатора должен быть небольшим
Слайд 10Окислительно-восстановительные (оксред-индикаторы)
Органические соединения, изменение окраски которых связано с процессами окисления
и восстановления:
Ind ox+ne↔ IndRed
Слайд 12Металлоиндикаторы
(металлохромные индикаторы)
Хромоген черный
H2Ind- +H+ pK=6,3 Ind2-+2H+ pK=11,6Ind3-+3H+
Красный
Синий желто-оранжевый
Слайд 14Кислотно-основное титрование
Это экспериментальная методика определения концентрации кислоты либо основания, используемая
преимущественно в количественном химическом анализе.
Кислоту с известной концентрацией постепенно добавляют
из бюретки в щелочной раствор неизвестной концентрации , находящийся в конической колбе.Слайд 15Точка эквивалентности
Достигается в тот момент, когда к основанию добавлено точное
стехиометрическое количество кислоты.
В этой точке вся щелочь нейтрализована, и в
растворе нет ни избытка кислоты, ни избытка основания. Раствор состоит только из соли и воды.Ее фиксируют визуально по заметному аналитическому эффекту, вызываемому каким-либо из исходных соединений, продуктов реакции или специально введенных в систему веществ - индикаторов
Слайд 16Область перехода
Интервал значений рН, в пределах которого индикатор изменяет свою
окраску.
Метиловый оранжевый: область перехода от рН 4,4 до 3,1. При
рН>4,4, он сохраняет желтую окраску, а при рН<3,1 - розовуюСлайд 17
Для каждого случая титрования пригодны только те индикаторы, показатели титрования
которых входят в пределы скачка рН на кривой.
Лакмус рТ=7 совпадает
с точкой эквивалентности и входит в пределы скачка титрования сильной кислоты сильным основанием.Слайд 18Методика кислотно-основного титрования
К анализируемому раствору из бюретки приливают стандартный раствор
( титрант) кислоты или основания до момента , когда вещества
полностью прореагируют, что устанавливается при помощи индикатора. Содержание анализируемого объекта определяют по объему титранта пошедшего на титрование.Слайд 19Случаи титрования
1 - сильную кислоту титруют сильным основанием
2 – слабую
кислоту титруют сильным основанием
3 – сильное основание титруют сильной кислотой
4
– слабое основание титруют сильной кислотойСлайд 20Кривая титрования
Выделяют:
А) область до начала титрования
Б) область до начала скачка
титрования
В) скачок титрования, включая точку эквивалентности
Г) область после скачка титрования
Слайд 21
До начала титрования значение рН титруемого раствора определяется концентрацией и
константой диссоциации анализируемой кислоты (или основания)
После точки эквивалентности – концентрацией
титранта.В промежуточных точках титрование факторы, определяющие рН, зависят от того какое вещество титруют.
Слайд 25Кривая титрования 0,1 н хлороводородной кислоты 0,1 н раствором гидроксида
натрия
На оси абцисс – избыток кислоты или щелочи в разные
моменты титрованияНа оси ординат – значения рН раствора
_______________________________Х
%, NaOH
Мл, NaOH