Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кислоты органические и неорганические
Содержание
- 1. Кислоты органические и неорганические
- 2. Слайд 2
- 3. Что объединяет данные вещества?Назовите кислоты, которые входят в состав данных веществ
- 4. Кислоты органические и неорганические
- 5. Цель урока: систематизировать и обобщить знания о
- 6. Определение кислотКислоты – это сложные вещества, которые
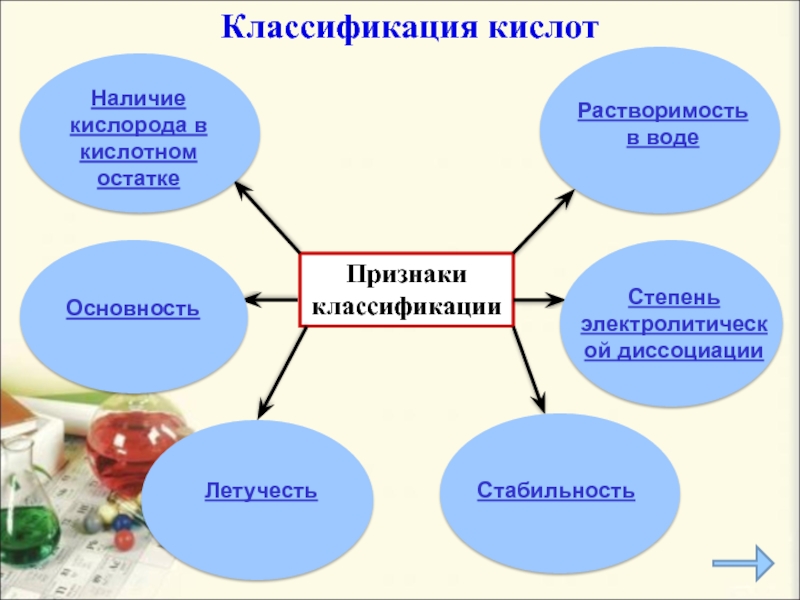
- 7. Признаки классификацииКлассификация кислотЛетучесть Степень электролитической диссоциации
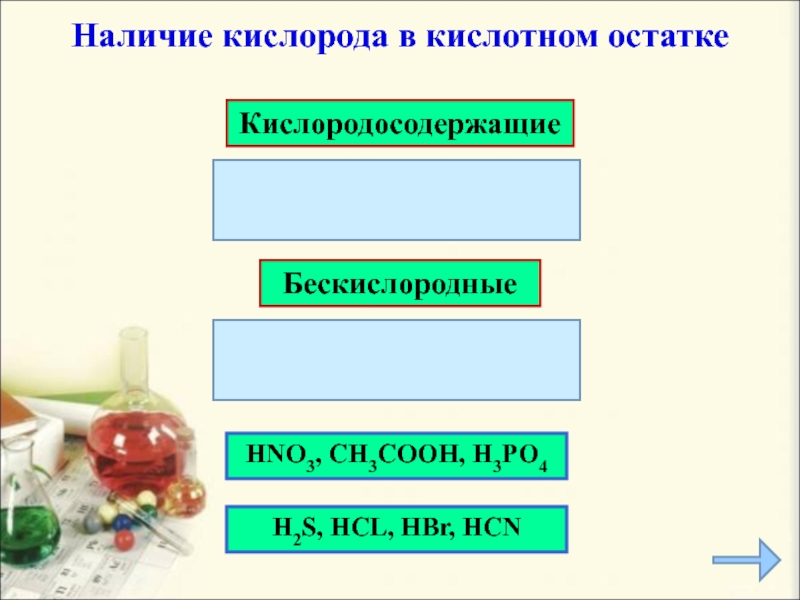
- 8. HNO3, CH3COOH, H3PO4Кислородосодержащие Бескислородные H2S, HCL, HBr, HCN Наличие кислорода в кислотном остатке
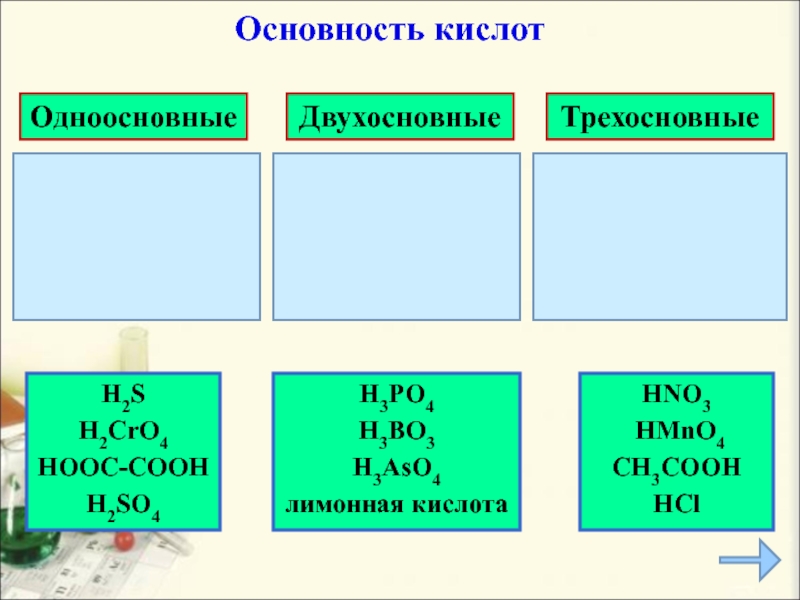
- 9. HNO3 HMnO4CH3COOHHCl Одноосновные Двухосновные Трехосновные H2SH2CrO4HOOC-COOH H2SO4 H3PO4 H3BO3 H3AsO4лимонная кислотаОсновность кислот
- 10. Растворимые Нерастворимые H2SiO3, C17H35COOH, H2MoO4 , C15H31COOHРастворимость в водеHCOOH, HNO3, CH3COOH, H2SO4
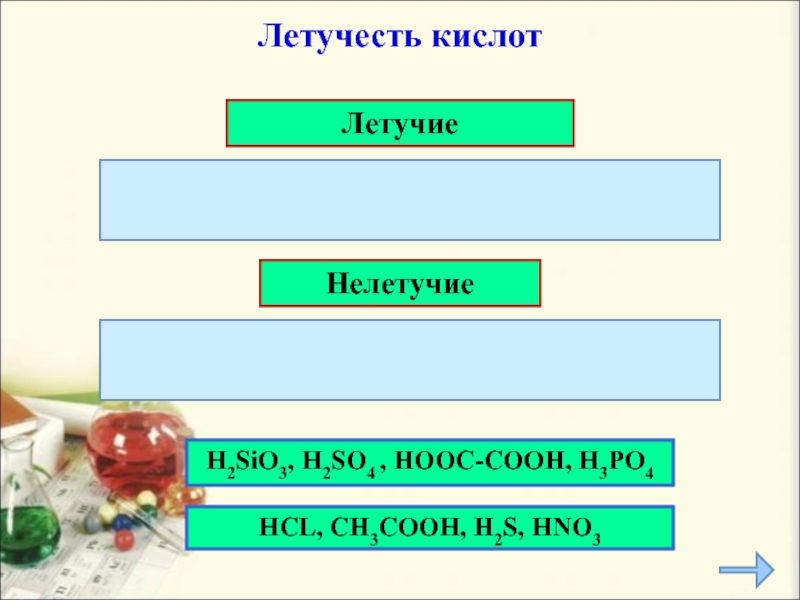
- 11. Летучие Нелетучие H2SiO3, H2SO4 , HOOC-COOH,
- 12. Сильные Слабые H2CO3, H2SO3 , CH3COOH, H2S
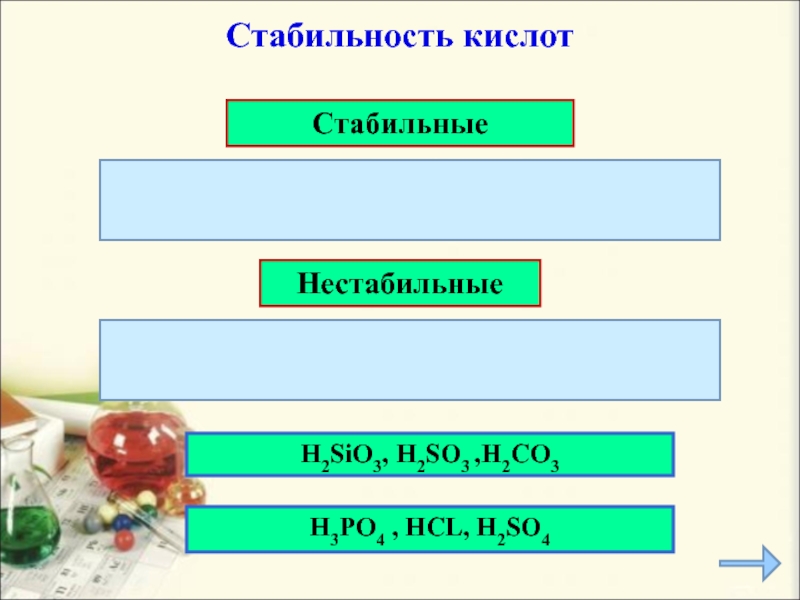
- 13. Стабильные НестабильныеH2SiO3, H2SO3 ,H2CO3 Стабильность кислотH3PO4 , HCL, H2SO4
- 14. Взаимодействуют с металламиВзаимодействуют с основаниямиВзаимодействуют с
- 15. Взаимодействие кислот с индикаторами
- 16. Диссоциация кислотHCL → H + CLCH3COOH↔ CH3COO
- 17. Изучение реакции взаимодействия кислот с металламиMg, CuHCLCH3COOHMg
- 18. Изучение реакции взаимодействия кислот с основными оксидамиCuOH2SO4CH3COOHCuO + H2SO4 → CuSO4+H2OCuO + 2CH3COOH→ (CH3COO)2Cu+H2OИзменение цвета
- 19. Изучение реакции взаимодействия кислот с основаниямиNaOHФенолфталеинHCLCH3COOHNaOH + HCL → NaCL+H2ONaOH + CH3COOH→ CH3COONa+H2OИзменение цвета
- 20. Изучение реакции взаимодействия кислот с солямиBaCL2H2SO4CH3COOHCaCO3BaCL2 +
- 21. КислотыКислоты в нашей жизни
- 22. Кислоты в природеАзотная кислота образуется при взаимодействии
- 23. Рефлексия Начните Ваш ответ словами: Узнать…Понять...Научиться… Применять...Мне удалось
- 24. Один произведенный опыт намного дороже тысячи теорий, которые так и остались мыслями.М.В. Ломоносов
- 25. Скачать презентанцию
Слайды и текст этой презентации
Слайд 5Цель урока: систематизировать и обобщить знания о номенклатуре, классификации и
общих свойствах неорганических и органических кислот,
их роли в жизни
человека Слайд 6Определение кислот
Кислоты – это сложные вещества, которые состоят из атомов
водорода, способных замещаться на металл, и кислотного остатка
Кислоты – это
молекулы или ионы, которые являются донорами катионов водорода Н+Кислоты – это молекулы или ионы, которые являются акцепторами катионов водорода Н+
Кислоты – это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотных остатков
Какое определение лишнее?
Слайд 8
HNO3, CH3COOH, H3PO4
Кислородосодержащие
Бескислородные
H2S, HCL, HBr, HCN
Наличие кислорода
в кислотном остатке
Слайд 9
HNO3
HMnO4
CH3COOH
HCl
Одноосновные
Двухосновные
Трехосновные
H2S
H2CrO4
HOOC-COOH
H2SO4
H3PO4
H3BO3
H3AsO4
лимонная
кислота
Основность кислот
Слайд 10
Растворимые
Нерастворимые
H2SiO3, C17H35COOH, H2MoO4 , C15H31COOH
Растворимость в воде
HCOOH, HNO3,
CH3COOH, H2SO4
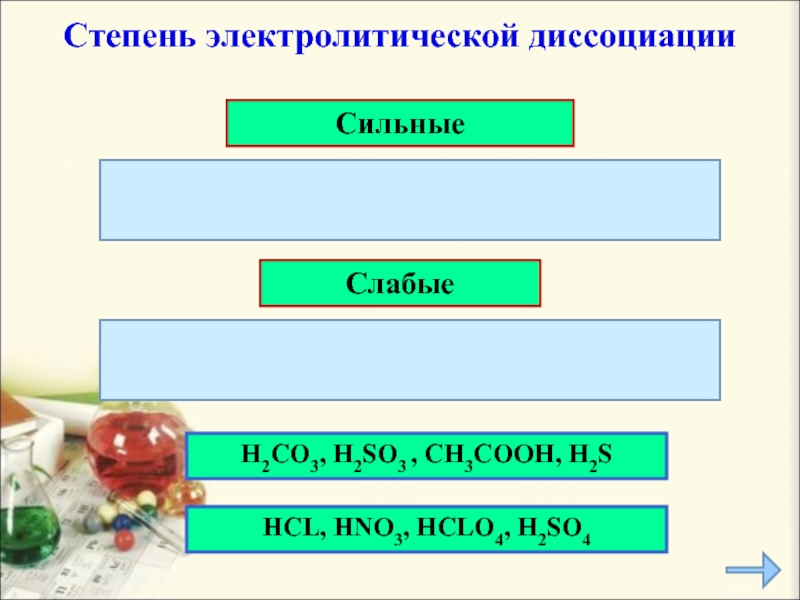
Слайд 12
Сильные
Слабые
H2CO3, H2SO3 , CH3COOH, H2S
Степень электролитической
диссоциации
HCL, HNO3, HCLO4, H2SO4
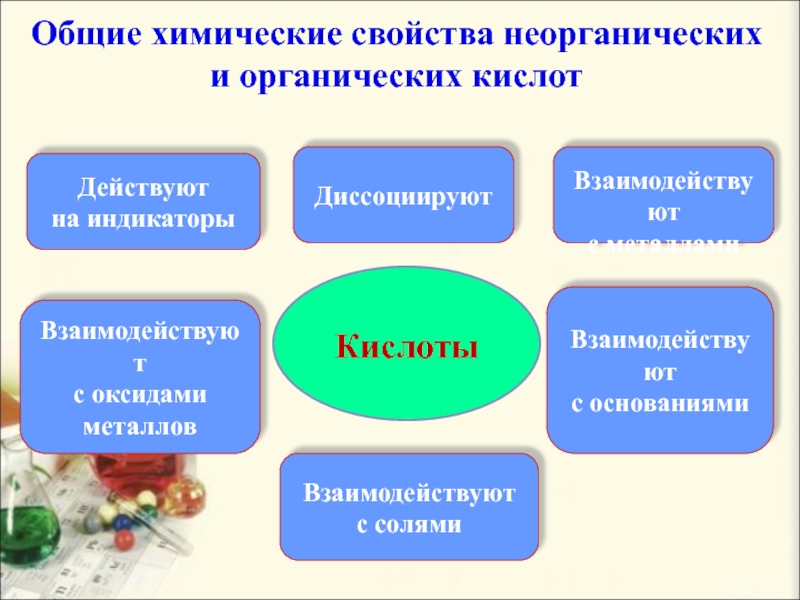
Слайд 14 Взаимодействуют
с металлами
Взаимодействуют
с основаниями
Взаимодействуют
с оксидами
металлов
Взаимодействуют
с
солями
Общие химические свойства неорганических и органических кислот
Кислоты
Действуют
на индикаторы
Диссоциируют
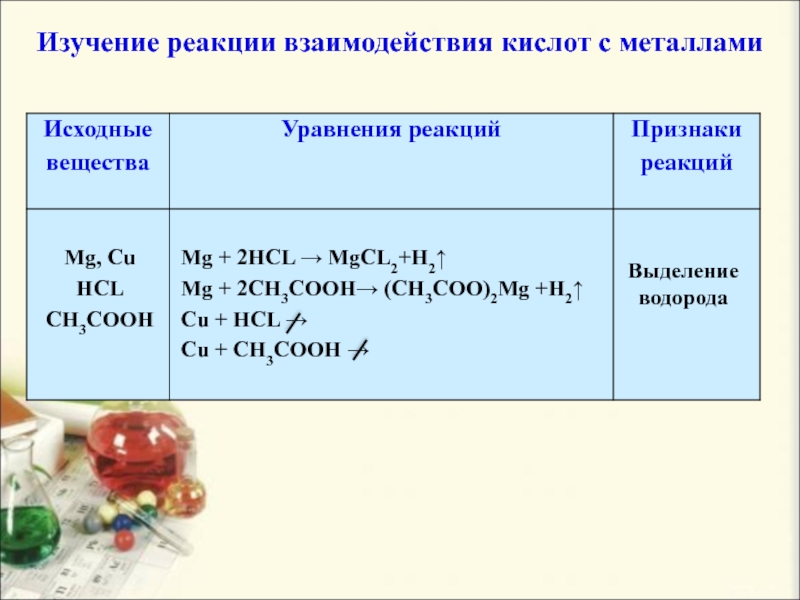
Слайд 17Изучение реакции взаимодействия кислот с металлами
Mg, Cu
HCL
CH3COOH
Mg + 2HCL →
MgCL2+H2↑
Mg + 2CH3COOH→ (CH3COO)2Mg +H2↑
Cu + HCL →
Cu +
CH3COOH →Выделение водорода
Слайд 18Изучение реакции взаимодействия кислот с основными оксидами
CuO
H2SO4
CH3COOH
CuO + H2SO4 →
CuSO4+H2O
CuO + 2CH3COOH→ (CH3COO)2Cu+H2O
Изменение цвета
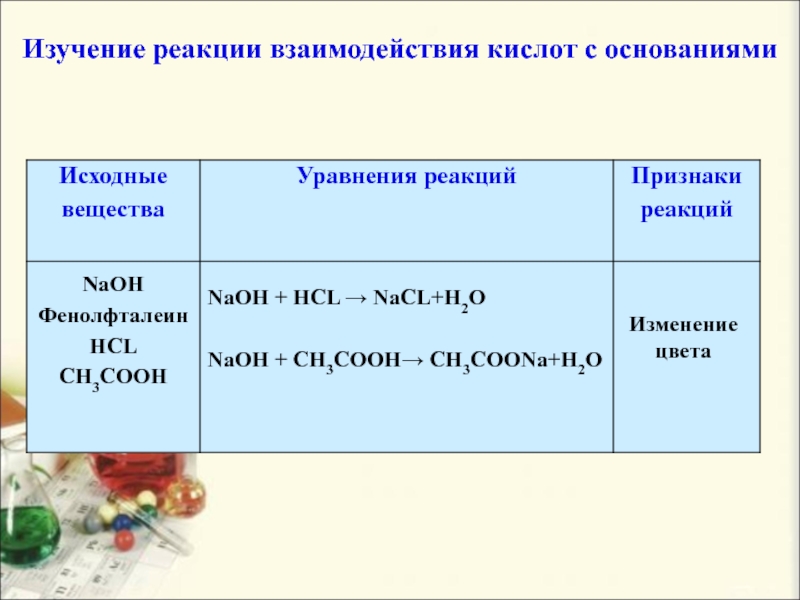
Слайд 19Изучение реакции взаимодействия кислот с основаниями
NaOH
Фенолфталеин
HCL
CH3COOH
NaOH + HCL → NaCL+H2O
NaOH
+ CH3COOH→ CH3COONa+H2O
Изменение цвета
Слайд 20Изучение реакции взаимодействия кислот с солями
BaCL2
H2SO4
CH3COOH
CaCO3
BaCL2 + H2SO4 → BaSO4↓
+ 2HCL
CaCO3+ 2CH3COOH→ (CH3COO)2Ca + H2O + CO2↑
Выпадение осадка
Выделение газа
Слайд 22Кислоты в природе
Азотная кислота образуется при взаимодействии с дождевой водой
диоксида азота, образующегося в результате грозовых разрядов
Извержения вулканов и
сгорание топлива способствуют появлению в снеговой и дождевой воде серной кислотыКислотные дожди в природе