Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Конспект урока по химии "Водород, его общая характеристика и нахождение в природе. Получение водорода и его физические свойства
Содержание
- 1. Конспект урока по химии "Водород, его общая характеристика и нахождение в природе. Получение водорода и его физические свойства
- 2. Химический диктант
- 3. Ответы на химический диктантК, Li, Ca, Ba,
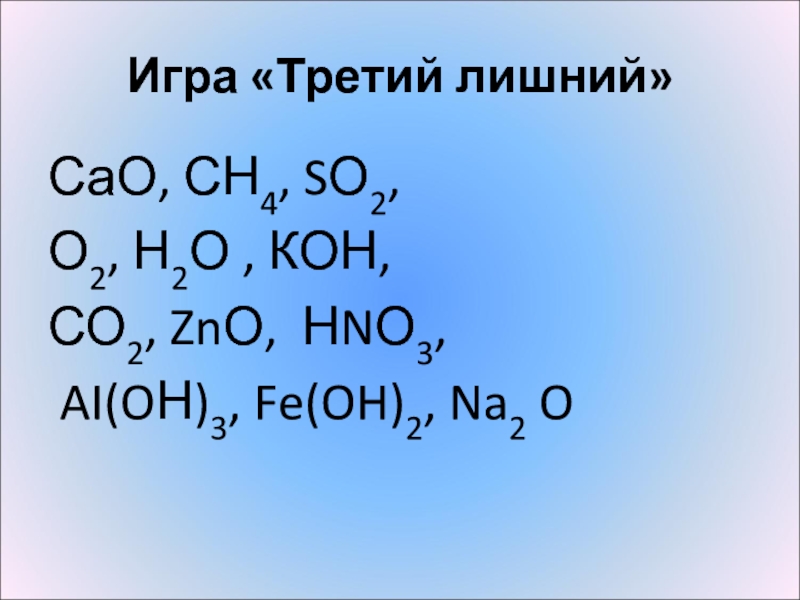
- 4. Игра «Третий лишний»СаО, СН4, SО2,О2, Н2О , КОН, СО2, ZnО, НNО3, AI(OН)3, Fe(OH)2, Na2 O
- 5. ВОДОРОД Тема урока
- 6. План 1. Общая характеристика.2. Нахождение в природе.
- 7. 1. «Общая характеристика»Химический знак – Относительная атомная
- 8. 2. Нахождение в природе. Водород в космосе
- 9. Ближайшая к нам звезда Галактики, которую мы
- 10. Водород на ЗемлеВода Нефть Природныйгаз
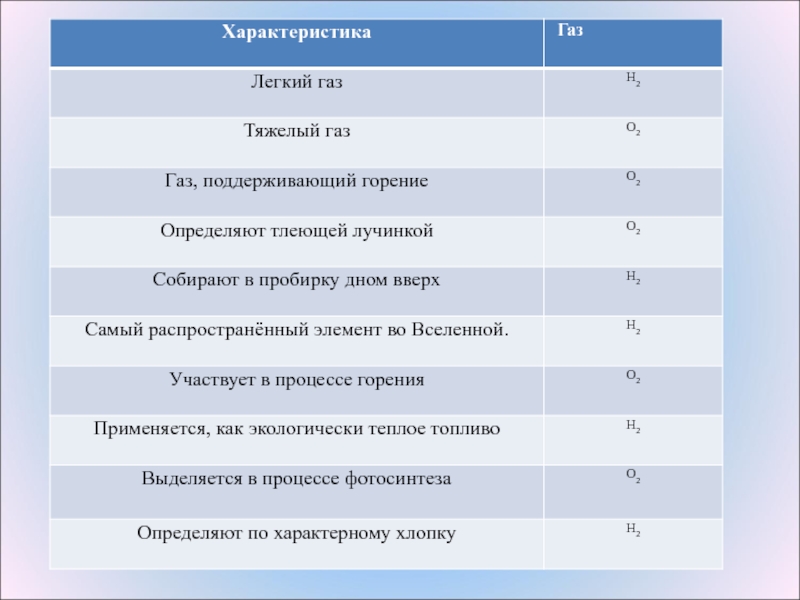
- 11. 3. Характеристика физических свойств водорода
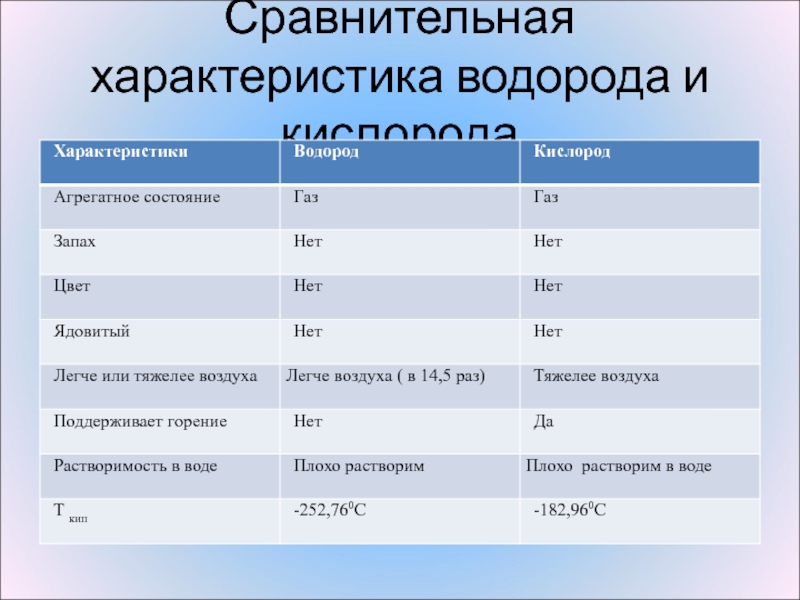
- 12. Сравнительная характеристика водорода и кислорода
- 13. История открытие водородаВодород был открыт в первой
- 14. В 1779 г. Антуан Лавуазье получил водород при
- 15. Физические свойства
- 16. Психологическая пауза
- 17. 4. Получение водородаРазложение воды:Взаимодействие цинка с кислородом:Взаимодействие натрия с водой:
- 18. Опыт Пилатра де РозьераКак-то он решил проверить,
- 19. Лабораторная работаВ пробирку положите гранулу цинка и долейте раствор соляной кислоты
- 20. Слайд 20
- 21. Задание № 3 стр. 76
- 22. План 1. Общая характеристика.2. Нахождение в природе.
- 23. Из предложенных положений неверно лишь то, что
- 24. Из предложенных положений неверно лишь то, что
- 25. Слайд 25
- 26. Слайд 26
- 27. Домашнее заданиеПараграф 25-27, Выполнить упражнения №2 стр.
- 28. Спасибо за внимание
- 29. Скачать презентанцию
Химический диктант
Слайды и текст этой презентации
Слайд 6План
1. Общая характеристика.
2. Нахождение в природе.
3. Характеристика физических
свойств водорода. Сравнение их с кислородом.
4. Способы получения водорода.
5 .
Применение водорода.6. Химические свойства
Слайд 71. «Общая характеристика»
Химический знак –
Относительная атомная масса =
Валентность в
соединениях =
Химическая формула –
Относительная молекулярная масса –
Слайд 9Ближайшая к нам звезда Галактики, которую мы знаем под именем
«Солнце», на 50 % своей массы состоит из водорода.
Слайд 13История открытие водорода
Водород был открыт в первой
половине XVI века немецким
врачом и естествоиспытателем
Парацельсом
Первым ученым, описавшим свойства
этого газа,
был английский ученыйГенри Кавендиш
Слайд 14В 1779 г. Антуан Лавуазье получил водород при разложении воды, пропуская
ее пары через раскаленную докрасна железную трубку
Слайд 174. Получение водорода
Разложение воды:
Взаимодействие цинка с кислородом:
Взаимодействие натрия с водой:
Слайд 18Опыт Пилатра де Розьера
Как-то он решил проверить, что будет,
если
вдохнуть водород; до него никто
такого эксперимента не проводил.
Не
заметив никакого эффекта, ученый решил убедиться,
проник ли водород в легкие.
Он еще раз глубоко вдохнул
этот газ, а затем выдохнул его
на огонь свечи, ожидая увидеть
вспышку пламени. Однако водород
в легких экспериментатора
смешался с воздухом, и
произошел сильный взрыв.
Слайд 20
5. Применение водорода Атомарный водород используется для атомно-водородной сварки. Химическая промышленность: При производстве аммиака, метанола, мыла и пластмасс Пищевая промышленность: При производстве маргарина из жидких растительных масел. Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ) Авиационная промышленность: Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием. Водород используют в качестве ракетного топлива. Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар. В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью "Водород".
Слайд 22План
1. Общая характеристика.
2. Нахождение в природе.
3. Характеристика физических
свойств водорода. Сравнение их с кислородом.
4. Способы получения водорода.
5 .
Применение водорода.6. Химические свойства
Слайд 23
Из предложенных положений неверно лишь то, что водород:
а) имеет приятный
запах;
б) немного тяжелее воздуха;
в) самый распространенный химический элемент во Вселенной;
г)
валентность водорода два;д) самый легкий газ;