Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неметаллы. Мышьяк
Содержание
- 1. Неметаллы. Мышьяк
- 2. МышьякХарактеристика элементаМышьяк (Arsenicum) — химический элемент с
- 3. Факты из историиИзвестен мышьяк с глубокой древности:
- 4. 6. получение свободного металлического мышьяка приписывают немецкому
- 5. Мышьяк- простое веществоМышьяк – серебристо-серое или оловянно-белое
- 6. Аллотропные модификации мышьякаНесмотря на то, что мышьяк
- 7. Нахождение в природеМышьяк — рассеянный элемент. Содержание
- 8. АрсенопиритРеальгарАурипигментТонкая (толщ. 2мм) кристаллическая корка самородного мышьяка
- 9. Получение мышьякаМышьяк получают в промышленности нагреванием мышьякового
- 10. Химические свойства мышьякаС галогенами мышьяк соединяется непосредственно;
- 11. Мышьяк-Яд В сознании многих слова «яд»
- 12. На протяжении веков соединения мышьяка привлекали (да
- 13. Симптомы отравленияСимптомы мышьяковистого отравления – металлический вкус
- 14. Мышьяк-Лекарство Мышьяк используется в стоматологии
- 15. Другие применение мышьяка Самая перспективная
- 16. Мышьяк в организмеВ качестве микроэлемента мышьяк повсеместно
- 17. Интересные факты о мышьякеА знаете ли вы,
- 18. Использованная литератураWikipediAПопулярная библиотека химических элементовГазета «Фармацевтический Вестник»
- 19. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Презентация по химии ученицы 9б класса гимназии №24 им. И.А.Крылова Сергеевой
Ирины
на тему
«Неметаллы. Мышьяк»
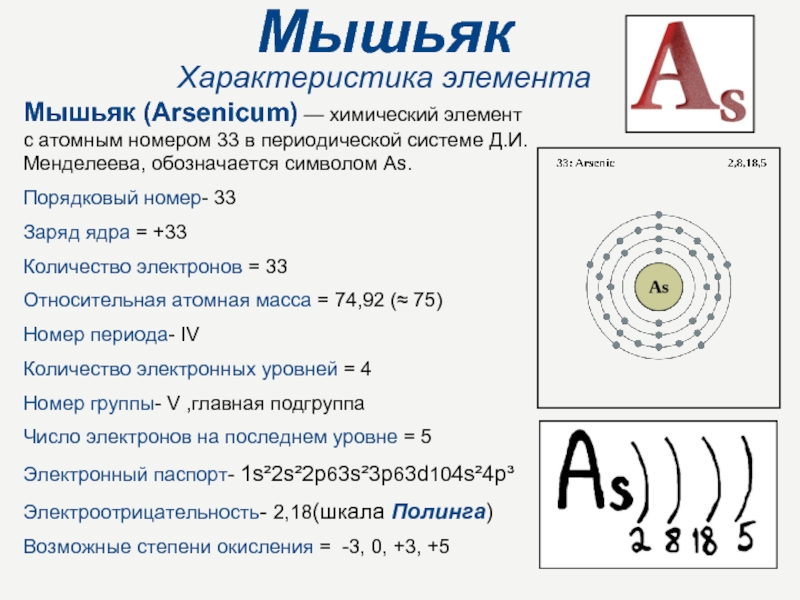
Слайд 2Мышьяк
Характеристика элемента
Мышьяк (Arsenicum) — химический элемент с атомным номером 33
в периодической системе Д.И.Менделеева, обозначается символом As.
Порядковый номер- 33
Заряд ядра = +33
Количество электронов = 33
Относительная атомная масса = 74,92 (≈ 75)
Номер периода- IV
Количество электронных уровней = 4
Номер группы- V ,главная подгруппа
Число электронов на последнем уровне = 5
Электронный паспорт- 1s²2s²2p63s²3p63d104s²4p³
Электроотрицательность- 2,18(шкала Полинга)
Возможные степени окисления = -3, 0, +3, +5
Слайд 3Факты из истории
Известен мышьяк с глубокой древности:
1. в трудах Диоскорида (I в. н.э.) упоминается о прокаливании вещества, которое сейчас называют сернистым мышьяком; 2. в III-IV в. в отрывочных записях, приписываемых Зозимосу (египетский или греческий алхимик), есть упоминание о металлическом мышьяке; 3. у греческого писателя Олимпиодоруса (V в. н.э.) описано изготовление белого мышьяка обжигом сульфида; 4. в VIII в. арабский алхимик Гебер получил трехокись мышьяка; 5. в средние века люди начали сталкиваться с трехокисью мышьяка при переработке мышьяксодержащих руд, и белый дым газообразного Аs2O3 получил название рудного дыма;
Диоскорид
Гебер
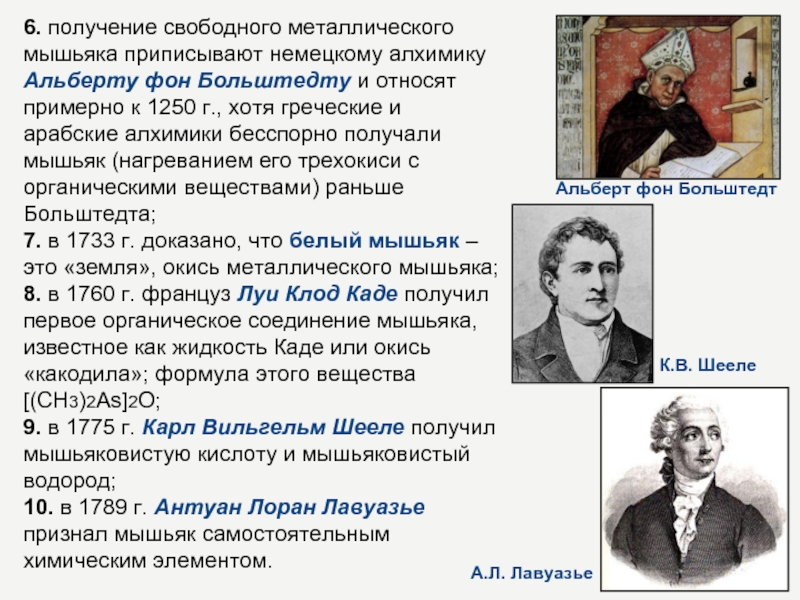
Слайд 46. получение свободного металлического мышьяка приписывают немецкому алхимику Альберту фон
Больштедту и относят примерно к 1250 г., хотя греческие и
арабские алхимики бесспорно получали мышьяк (нагреванием его трехокиси с органическими веществами) раньше Больштедта; 7. в 1733 г. доказано, что белый мышьяк – это «земля», окись металлического мышьяка; 8. в 1760 г. француз Луи Клод Каде получил первое органическое соединение мышьяка, известное как жидкость Каде или окись «какодила»; формула этого вещества [(CH3)2Аs]2O; 9. в 1775 г. Карл Вильгельм Шееле получил мышьяковистую кислоту и мышьяковистый водород; 10. в 1789 г. Антуан Лоран Лавуазье признал мышьяк самостоятельным химическим элементом.Альберт фон Больштедт
К.В. Шееле
А.Л. Лавуазье
Слайд 5Мышьяк- простое вещество
Мышьяк – серебристо-серое или оловянно-белое вещество, в свежем
изломе обладающее металлическим блеском.
Но на воздухе он быстро тускнеет. Представляет собой хрупкий полуметалл стального цвета (расположен в периодической системе на границе между металлами и неметаллами, поэтому и называется «полуметаллом»). Для мышьяка, как и для других полуметаллов характерно образование ковалентной кристаллической решётки и наличие металлической проводимости. Но все же мышьяк- неметалл.Физические свойства: 1. При нагревании выше 600°C мышьяк возгоняется, не плавясь, а под давлением 37 атм. Плавится при 818°C. 2. Плотность (при н. у.)- 5,73 г/см³ (серый мышьяк) 3. Температура кипения = 876 K (Кельвин)
Внешний вид простого вещества
Слайд 6Аллотропные модификации мышьяка
Несмотря на то, что мышьяк относится к неметаллам,
он имеет 4 аллотропные модификации- белый, желтый, черный и металлический
(или серый) мышьяк. Последние 2 обладают свойствами металлов. 1. Серый мышьяк - хрупкая серо-стальная кристаллическая масса с металлическим блеском, который на воздухе быстро пропадает из-за окисления поверхностного слоя. 2. Черный мышьяк - самая устойчивая его форма - порошок черного цвета, как и большинство металлов, в мелкодисперсном (очень мелком, который может пройти через сито.) состоянии (вспомните чернь серебра). В отличие от серой формы устойчива на воздухе, но при 2859 °С переходит в серую форму.Чёрный мышьяк
Серый мышьяк (металлический)
Слайд 7Нахождение в природе
Мышьяк — рассеянный элемент. Содержание в земной коре
1,7×10−4% по массе. В морской воде 0,003 мг/л.
Это вещество может встречаться в самородном состоянии, имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из маленьких зернышек. Известно около 200 мышьяксодержащих минералов. В небольших концентрациях часто содержится в свинцовых, медных и серебряных рудах. Довольно часто встречаются два природных соединения мышьяка с серой: оранжево-красный прозрачный реальгар AsS и лимонно-желтый аурипигмент As2S3. Минерал, имеющий промышленное значение — арсенопирит (мышьяковый колчедан) FeAsS или FeS2•FeAs2 (46 % As), также добывают мышьяковистый колчедан — лёллингит (FeAs2) (72,8 % As), скородит FeAsO4 (27 — 36 % As). Большая часть мышьяка добывается попутно при переработке мышьяксодержащих золотых, свинцово-цинковых, медноколчеданных и других руд.Скородит
Лёллингит
Слайд 8Арсенопирит
Реальгар
Аурипигмент
Тонкая (толщ. 2мм) кристаллическая корка самородного мышьяка по контакту доломитового
прожилка с вмещающим гнейсом (горная порода).
Самородный мышьяк. Воронцовское золоторудное месторождение.
Северный Урал.Почки самородного мышьяка на стенке карбонатного прожилка в рудном скарне.
Слайд 9Получение мышьяка
Мышьяк получают в промышленности нагреванием мышьякового колчедана:
FeAsS = FeS + As
или (реже) восстановлением As2O3 углем. Оба процесса ведут в ретортах из огнеупорной глины, соединенных с приемником для конденсации паров мышьяка. Мышьяковистый ангидрид получают окислительным обжигом мышьяковых руд или как побочный продукт обжига полиметаллических руд, почти всегда содержащих мышьяк. При окислительном обжиге образуются пары As2O3, которые конденсируются в уловительных камерах. Сырой As2O3 очищают возгонкой при 500-600 °C. Очищенный As2O3 служит для производства мышьяка и его препаратов.
В настоящее время для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печах без доступа воздуха. При этом освобождается мышьяк, пары которого конденсируются и превращаются в твердый мышьяк в железных трубках, идущих от печей, и в особых керамических приёмниках. Остаток в печах потом нагревают при доступе воздуха, и тогда мышьяк превращается в As2O3. Металлический мышьяк получается в довольно незначительных количествах, и главная часть мышьяксодержащих руд перерабатывается в белый мышьяк, то есть в триоксид мышьяка — мышьяковистый ангидрид As2О3.
Муфельная печь
Схема реторты из огнеупорной глины
Слайд 10Химические свойства мышьяка
С галогенами мышьяк соединяется непосредственно; при обычных условиях
AsF5 - газ; AsF3, AsCl3, AsBr3 - бесцветные легко летучие
жидкости; AsI3 и As2I4 - красные кристаллы. При нагревании мышьяка с серой получены сульфиды: оранжево-красный As4S4 и лимонно-желтый As2S3. Бледно-желтый сульфид As2S5 осаждается при пропускании H2S в охлаждаемый льдом раствор мышьяковой кислоты (или ее солей) в дымящей соляной кислоте: 2H3AsO4 + 5H2S = As2S5 + 8H2O; около 500 °C он разлагается на As2S3 и серу. Все сульфиды мышьяка нерастворимы в воде и разбавленных кислотах. Сильные окислители (смеси HNO3 + HCl, HCl + KClO3) переводят их в смесь H3AsO4 и H2SO4. Сульфид As2S3 легко растворяется в сульфидах и полисульфидах аммония и щелочных металлов, образуя соли кислот - тиомышьяковистой H3AsS3 и тиомышьяковой H3AsS4.Сера (порошок)
Слайд 11Мышьяк-Яд
В сознании многих слова «яд» и «мышьяк» идентичны.
Так уже сложилось исторически. Известны рассказы о ядах Клеопатры. В
Риме славились яды Локусты. Обычным орудием устранения политических и прочих противников яд был также в средневековых итальянских республиках. В Венеции, например, при дворе держали специалистов-отравителей. И главным компонентом почти всех ядов был мышьяк.В России закон, запрещающий отпускать частным лицам «купоросное и янтарное масло, крепкую водку, мышьяк и цилибуху», был издан еще в царствование Анны Иоанновны – в январе 1733 г. Закон был чрезвычайно строг и гласил: «Кто впредь тем мышьяком и прочими вышеозначенными материалы торговать станут и с тем пойманы или на кого донесено будет, тем и учинено будет жестокое наказание и сосланы имеют в ссылку без всякия пощады, тож учинено будет и тем, которые мимо аптек и ратуш у кого покупать будут. А ежели кто, купя таковые ядовитые материалы, чинить будет повреждение людям, таковые по розыску не токмо истязаны, но и смертию казнены будут, смотря по важности дела неотменно».
Мышьяк-Яд (Poison «Arsenious»)
Императрица Анна Иоанновна
Слайд 12На протяжении веков соединения мышьяка привлекали (да и сейчас продолжают
привлекать) внимание фармацевтов, токсикологов и судебных экспертов.
Узнавать отравление мышьяком криминалисты
научились безошибочно. Если в желудке отравленных находят белые фарфоровидные крупинки, то первым делом возникает подозрение на мышьяковистый ангидрид As2O3. Эти крупинки вместе с кусочками угля помещают в стеклянную трубку, запаивают ее и нагревают. Если в трубке есть As2O3, то на холодных частях трубки появляется серо-черное блестящее кольцо металлического мышьяка. После охлаждения конец трубки отламывают, уголь удаляют, а серо-черное кольцо нагревают. При этом кольцо перегоняется к свободному концу трубки, давая белый налет мышьяковистого ангидрида. Реакции здесь такие:As2O3 + 3С → As2 + 3CO или
2Аs2О3 + 3С → 2As2 + 3CO2;
2Аs2 + 3O2 → 2Аs2O3.
Полученный белый налет помещают под микроскоп: уже при малом увеличении видны характерные блестящие кристаллы в виде октаэдров (многогранный кристалл).
Вид октаэдра
Слайд 13Симптомы отравления
Симптомы мышьяковистого отравления – металлический вкус во рту, рвота,
сильные боли в животе. Позже судороги, паралич, смерть. Наиболее известное
и общедоступное противоядие при отравлении мышьяком – молоко, точнее главный белок молока казеин, образующий с мышьяком нерастворимое соединение, не всасывающееся в кровь.Мышьяк в форме неорганических препаратов смертелен в дозах 0,05-0,1 г., и тем не менее мышьяк присутствует во всех растительных и животных организмах. (Это доказано французским ученым Орфила еще в 1838 г.) Морские растительные и животные организмы содержат в среднем стотысячные, а пресноводные и наземные – миллионные доли процента мышьяка. Микрочастицы мышьяка усваиваются и клетками человеческого организма, элемент №33 содержится в крови, тканях и органах; особенно много его в печени – от 2 до 12 мг на 1 кг веса. Ученые предполагают, что микродозы мышьяка повышают устойчивость организма к действию вредных микробов.
Матьё Жозеф Орфила
Молоко- одно из противоядий при отравлении мышьяком (!)
Слайд 14Мышьяк-Лекарство
Мышьяк используется в стоматологии для лечения пульпы
(ткани, содержащей нервы, кровеносные и лимфатические сосуды). Всемирную известность приобрел
сальварсан, 606-й препарат Пауля Эрлиха – немецкого врача, открывшего в начале XX в. первое эффективное средство борьбы с люэсом (Сифилис- венерическое инфекционное заболевание). Это действительно был 606-й из испытанных Эрлихом мышьяковистых препаратов.Лишь в 50-х годах, когда сальварсан уже перестали применять как средство против люэса, малярии, возвратного тифа, советский ученый М.Я. Крафт установил его истинную формулу (доказал, что он имеет полимерное строение ).
На смену сальварсану пришли другие мышьяковистые препараты, более эффективные и менее токсичные, в частности его производные: новарсенол, миарсенол и др.
Используют в медицинской практике и некоторые неорганические соединения мышьяка. Мышьяковистый ангидрид As2O3, арсенит калия KAsO2, гидроарсенат натрия Na2HАsO4 · 7H2O (в минимальных дозах)-тормозят окислительные процессы в организме, усиливают кроветворение. Те же вещества – как наружное – назначают при некоторых кожных заболеваниях. Именно мышьяку и его соединениям приписывают целебное действие некоторых минеральных вод.
Пауль Эрлих
Формула сальварсана
Слайд 15Другие применение мышьяка
Самая перспективная область применения мышьяка
- несомненно полупроводниковая техника. Особое значение приобрели в ней арсениды
галлия GaАs и индия InАs. Арсенид галлия важен также для нового направления электронной техники -оптоэлектроники, возникшей в 1963-1965 годах на стыке физики твердого тела, оптики и электроники. Этот материал помог создать новые полупроводниковые лазеры.Мышьяк используют и в качестве легирующей добавки, которая придает "классическим" полупроводникам - Si, Ge - проводимость определенного типа. При этом в полупроводнике создается так называемый "переходный слой", и в зависимости от назначения кристалла его легируют так, чтобы получить этот слой на различной глубине.(например, для изготовления диодов, его "прячут" поглубже; а если из полупроводниковых кристаллов будут делать солнечные батареи, то глубина "переходного слоя" - не более одного микрона.)
Мышьяк как ценную присадку используют и в цветной металлургии. Так, добавка 0,15-0,45% мышьяка в медь увеличивает ее прочность на разрыв, твердость и коррозионную стойкость при работе в загазованной среде. Кроме того, мышьяк увеличивает текучесть меди при литье, облегчает процесс волочения проволоки. Добавляют мышьяк и в свинец, в некоторые сорта бронз, латуней, типографских сплавов.
И в то же время мышьяк очень часто вредит металлургам- его присутствие в руде делает производство вредным. Вредным дважды: во-первых, для здоровья людей, во-вторых, для металла - значительные примеси мышьяка ухудшают свойства почти всех металлов и сплавов
Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи. В пиротехнике реальгар употребляется для получения «греческого», или «индийского», огня, возникающего при горении смеси реальгара с серой и селитрой (ярко-белое пламя). Многие из мышьяковых соединений в очень малых дозах применяются в качестве лекарств для борьбы с малокровием и рядом тяжелых заболеваний, так как оказывают клинически значимое стимулирующее влияние на ряд функций организма, в частности, на кроветворение.
Лазерный диод
Краски
Пиротехника
Слайд 16Мышьяк в организме
В качестве микроэлемента мышьяк повсеместно распространен в живой
природе. Среднее содержание мышьяка в почвах 4·10-4%, в золе растений
- 3·10-5%. Содержание мышьяка в морских организмах выше, чем в наземных (в рыбах 0,6-4,7 мг в 1 кг сырого вещества, накапливается в печени). Среднее содержание мышьяка в теле человека 0,08-0,2 мг/кг. В крови мышьяк концентрируется в эритроцитах, где он связывается с молекулой гемоглобина. Наибольшее количество его (на 1 г ткани) обнаруживается в почках и печени. Много мышьяка содержится в легких и селезенке, коже и волосах; сравнительно мало - в спинномозговой жидкости, головном мозге (главном образом гипофизе), половых железах и других. Мышьяк участвует в окислительно-восстановительных реакциях: окислительном распаде сложных углеводов, брожении, гликолизе и т. п. Соединения мышьяка применяют в биохимии как специфические ингибиторы ферментов для изучения реакций обмена веществ.Поражение ладоней (1),рук и ног (2) мышьяком
Снимки людей, пострадавших от мышьяка
Слайд 17Интересные факты о мышьяке
А знаете ли вы, что…
1. В западных
странах мышьяк был известен преимущественно как сильный яд, в то
же время в традиционной китайской медицине он почти на протяжении двух тысяч лет использовался для лечения сифилиса и псориаза. Теперь медики доказали, что мышьяк оказывает положительный эффект и в борьбе с лейкемией. Китайские ученые обнаружили, что мышьяк атакует белки, которые отвечают за рост раковых клеток.2. Еще древним стеклоделам было известно, что трехокись мышьяка делает стекло «глухим», т.е. непрозрачным. Однако небольшие добавки этого вещества, напротив, осветляют стекло. Мышьяк и сейчас входит в рецептуры некоторых стекол, например, «венского» стекла для термометров и полухрусталя.
3. В высокогорном озере Моно на востоке американского штата Калифорния обитают удивительные цианобактерии. При фотосинтезе они используют не кислород, а мышьяк, ядовитый практически для всех остальных форм жизни. Возможно, именно с них и начался процесс фотосинтеза на нашей планете, а тот фотосинтез, что снабжает нас всех кислородом и энергией, появился позже.
Мышьяк
Озеро Моно
Сбор пробы в одной из луж, на дне которых обитают использующие мышьяк фотосинтезирующие цианобактерии