Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая характеристика элементов VA-группы. Азот
Содержание
- 1. Общая характеристика элементов VA-группы. Азот
- 2. Элементы VA-группы
- 3. Элементы VА-группы Общая электронная формула:[…] ns 2
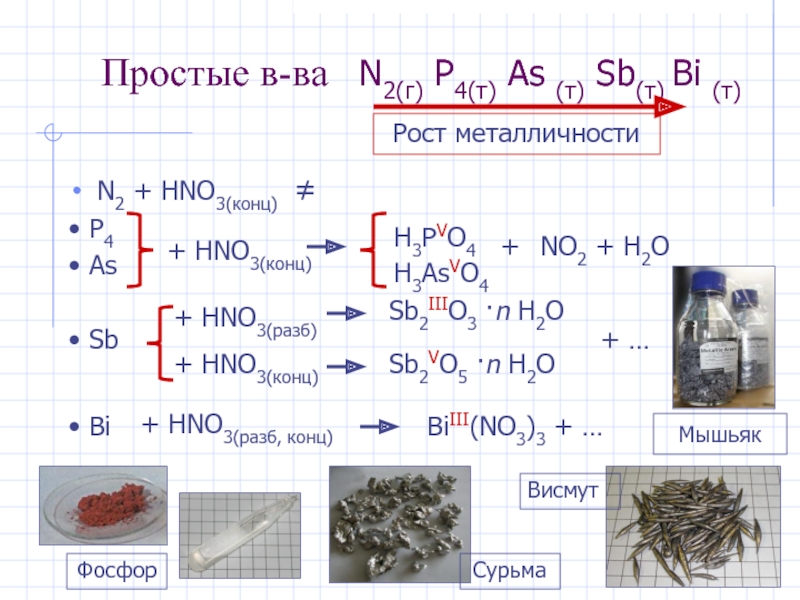
- 4. Простые в-ва N2(г) P4(т) As (т) Sb(т)
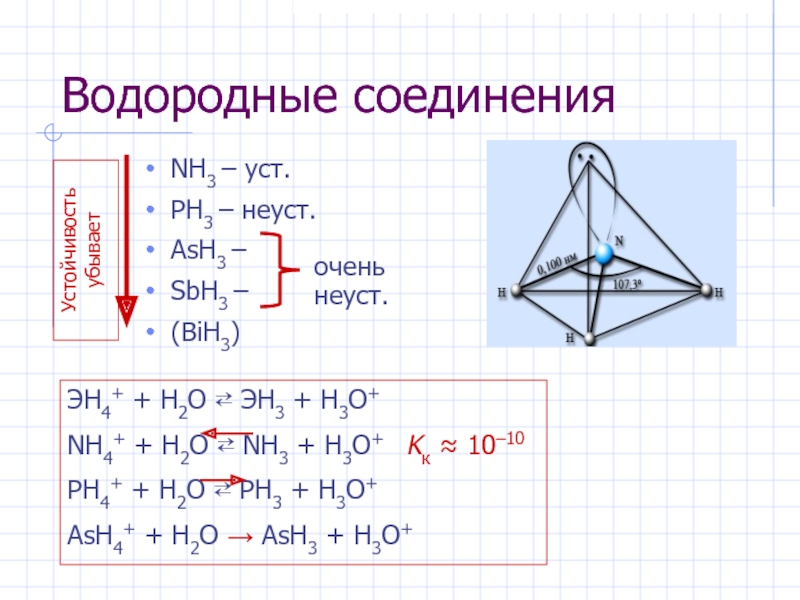
- 5. Водородные соединения NH3 – уст.PH3 – неуст.AsH3
- 6. Водородные соединенияАномалии свойств аммиака: водородные связи NH3 ··· NH3 ··· NH3 ···
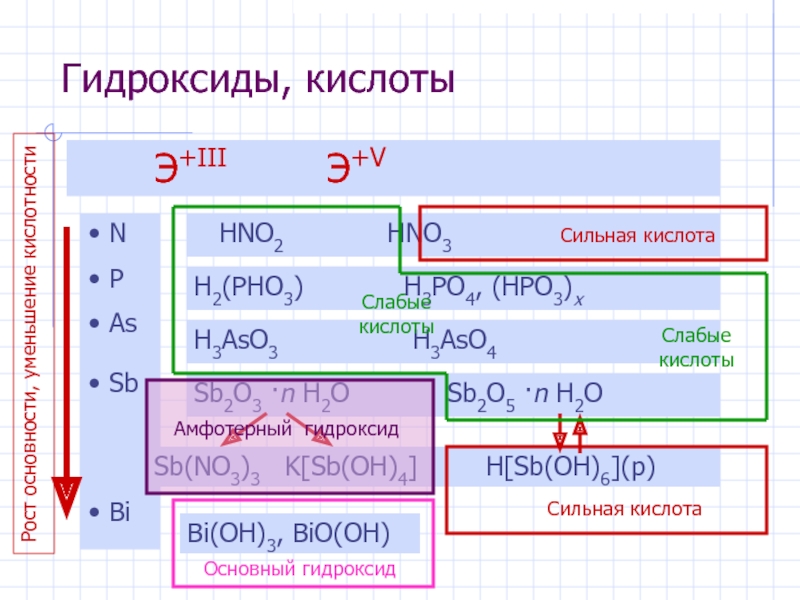
- 7. Гидроксиды, кислоты Э+III Э+V N P As
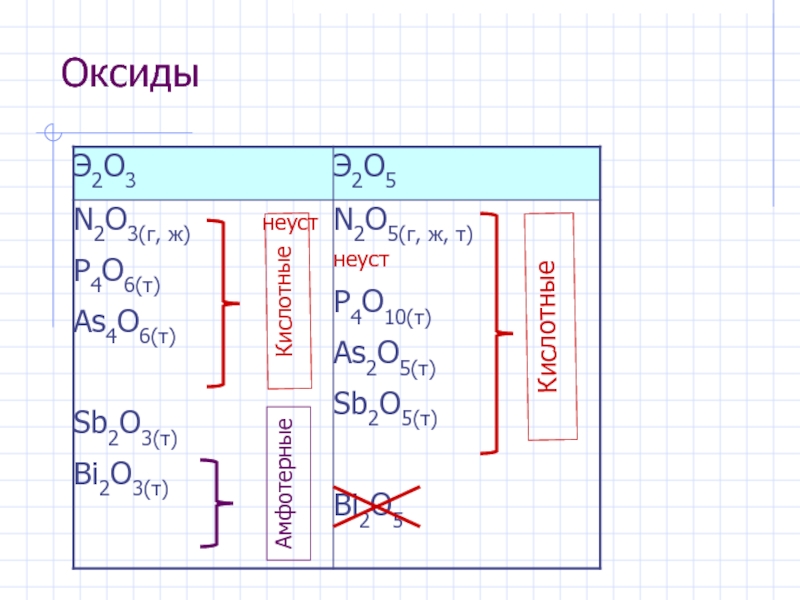
- 8. Оксиды
- 9. Степени окисления Ст.ок. +V: P, As, SbN(+V),
- 10. Распространение в природе12. P – 0,09 масс.%
- 11. Нитратин (чилийская селитра) NaNO3Нитрокалит (индийская селитра) KNO3 Нашатырь NH4Cl Апатит 3Ca3(PO4)2·Ca(Cl,OH,F)2 Фосфорит Ca3(PO4)2 Фторапатит 3Ca3(PO4)2·CaF2Азот, фосфор
- 12. Мышьяк, сурьма, висмутРеальгар As4S4Аурипигмент As2S3Арсенопирит FeAsSТетраэдрит Cul2As4S13Антимонит
- 13. История открытия элементовАзот: 1772 г., Д. Резерфорд,
- 14. Азот. Шкала степеней окисленияN2O5, NO3−, HNO3, NaNO3,
- 15. Свойства азотаN2 – бесцветный газ, без запаха
- 16. Получение и применение азота В промышленности: фракционная
- 17. Водородные соединения азота
- 18. Аммиак NH3 – бесцветный газ с резким
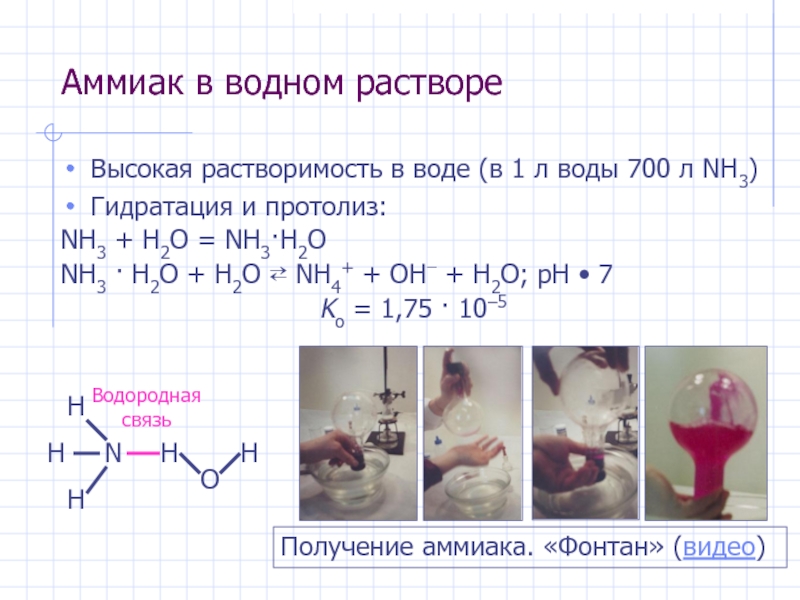
- 19. Аммиак в водном раствореВысокая растворимость в воде
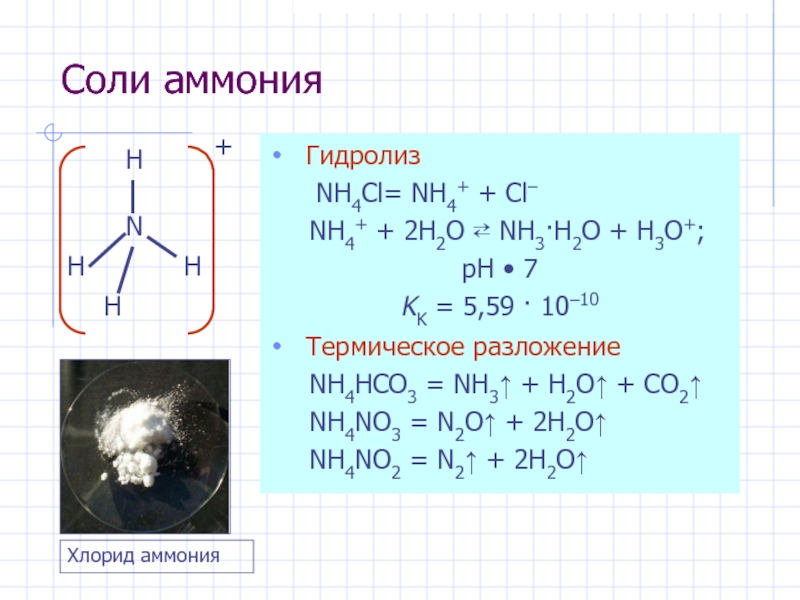
- 20. Соли аммония Гидролиз NH4Cl= NH4+ + Cl–
- 21. Окислительно-восстановительные свойстваГорение 4 NH3 + 3O2 =
- 22. Получение аммиакаВ промышленности N2 + 3H2 ⇄
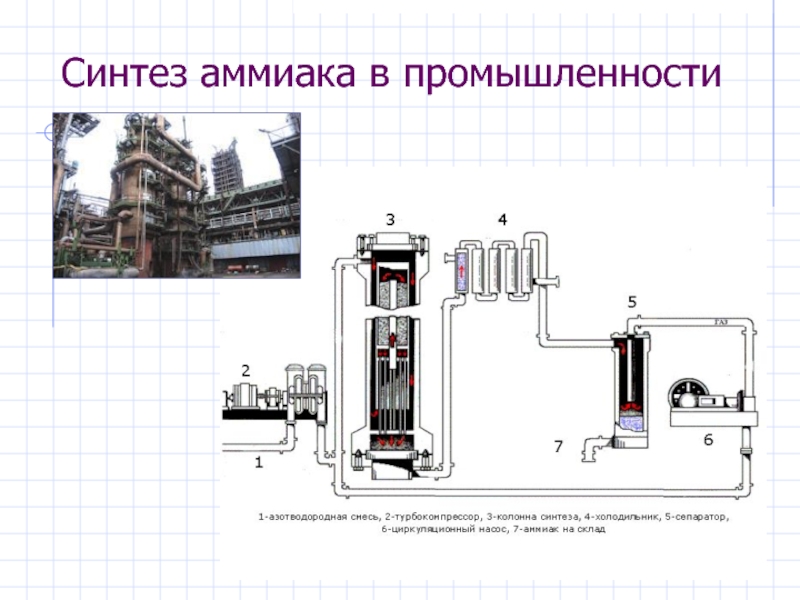
- 23. Синтез аммиака в промышленности
- 24. Гидразин N2H4 N2H4 – бесцветная, сильно дымящая
- 25. Протоноакцепторные свойстваN2H4 – акцептор протонов (две неподеленные
- 26. Окислительно-восстановительные свойства гидразинаГидразин как восстановительрН • 7:
- 27. Гидроксиламин NH2OHNH2OH – бесцветные, очень гигроскопичные кристаллы;
- 28. Окислительно-восстановительные свойства гидроксиламина Гидроксиламин как восстановительрН •
- 29. Азидоводород HN3HN3 – бесцветная летучая жидкость, неограниченно
- 30. Окислительно-восстановительные свойства Восстановительные свойства азидоводорода в растворе
- 31. Скачать презентанцию
Слайды и текст этой презентации
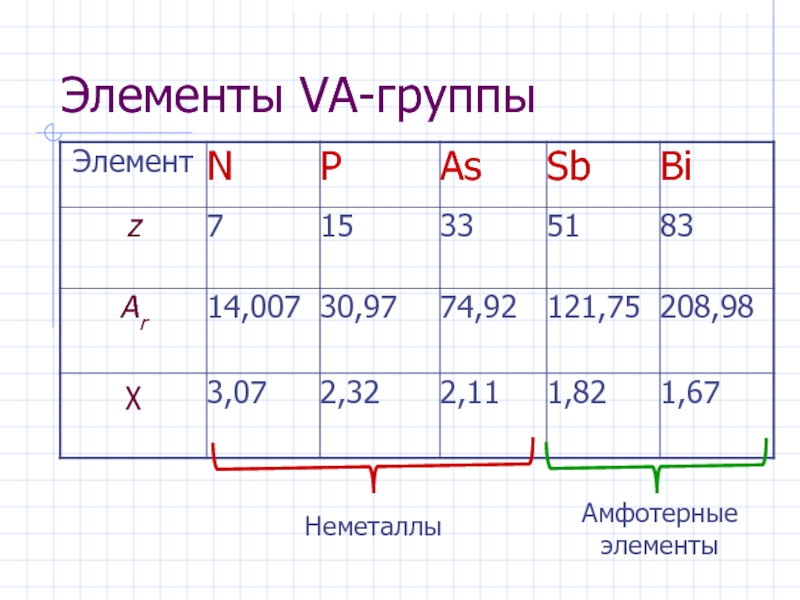
Слайд 3Элементы VА-группы
Общая электронная формула:
[…] ns 2 (n–1)d 10np 3
N – 3, 4; P, As, Sb, Bi – 3 ÷ 6
Слайд 4Простые в-ва N2(г) P4(т) As (т) Sb(т) Bi (т)
N2
+ HNO3(конц) ≠
P4
As
+ HNO3(конц)
H3PVO4
H3AsVO4
+
NO2 + H2O
Sb
+
HNO3(разб) + HNO3(конц)
Sb2IIIO3 ·n H2O
Sb2VO5 ·n H2O
+ …
Bi
+ HNO3(разб, конц)
BiIII(NO3)3 + …
Слайд 5Водородные соединения
NH3 – уст.
PH3 – неуст.
AsH3 –
SbH3 –
(BiH3)
Устойчивость
убывает
очень неуст.
ЭН4+ + H2O ⇄ ЭН3 + H3O+
NН4+ +
H2O ⇄ NН3 + H3O+ Kк ≈ 10–10 PН4+ + H2O ⇄ PН3 + H3O+
AsН4+ + H2O → AsН3 + H3O+
Слайд 7Гидроксиды, кислоты
Э+III Э+V
N
P
As
Sb
Bi
HNO2 HNO3
H2(PHO3) H3PO4, (HPO3)x
H3AsO3
H3AsO4Sb2O3 ·n H2O
Sb(NO3)3 K[Sb(OH)4]
Sb2O5 ·n H2O
H[Sb(OH)6](р)
Bi(OH)3, BiO(OH)
Сильная кислота
Амфотерный гидроксид
Слайд 9Степени окисления
Ст.ок. +V: P, As, Sb
N(+V), Bi(+V) –
сильные окислители
Ст.ок. +III: P, As, Sb, Bi
N(+III) – активный
окислитель и восстановительСт.ок. 0: N
Слайд 10Распространение в природе
12. P – 0,09 масс.%
16. N –
0,03 масс.%
47. As – 5·10–4 масс.%
62.
Sb – 5·10–5 масс.% 66. Bi – 1·10–5 масс.%
Азот атмосферы N2 (самородный)
Слайд 11Нитратин (чилийская селитра) NaNO3
Нитрокалит (индийская селитра) KNO3
Нашатырь NH4Cl
Апатит
3Ca3(PO4)2·Ca(Cl,OH,F)2
Фосфорит Ca3(PO4)2
Фторапатит 3Ca3(PO4)2·CaF2
Азот, фосфор
Слайд 12Мышьяк, сурьма, висмут
Реальгар As4S4
Аурипигмент As2S3
Арсенопирит FeAsS
Тетраэдрит Cul2As4S13
Антимонит (сурьмяный блеск) Sb2S3
Висмутин
(висмутовый блеск) Bi2S3
Редкие минералы
Анимикит (Ag, Sb)
Арсенопалладинит Pd3As
Геверсит
PtSb2Стибиопалладинит Pd3Sb
Слайд 13История открытия элементов
Азот: 1772 г., Д. Резерфорд, Г.Кавендиш, 1769-1771 гг.,
К.Шееле, А.Л. Лавуазье
Фосфор: 1669 г., Хённиг Бранд
Мышьяк: XIII в.,
Альберт Великий, XVI в., Парацельс, 1735 г., Г. БрандтСурьма: 3000 лет до н.э.; XVI в., Парацельс, Василий Валентин, 1735 г., Г. Брандт
Висмут: XV-XVI вв., Агрикола, Василий Валентин, 1739 г., И.Потт
Слайд 14Азот. Шкала степеней окисления
N2O5, NO3−, HNO3, NaNO3, AgNO3
NO2, N2O4
N2O3, NO2−, HNO2, NaNO2, NF3
NO, N2O2
H2N2O2
N2
NH2OH,
NH3OH+ N2H4, N2H5+, N2H62+
NH3, NH4+, NH3·H2O, NH4Cl, Li3N, Cl3N
Слайд 15Свойства азота
N2 – бесцветный газ, без запаха и вкуса, т.пл.
–210,0 °С, т.кип. –195,8 °С
малорастворим в воде и орг.
р-рителях энергия связи в молекуле N2 равна 945 кДж/моль, длина связи 110 пм.
N2 + F2 ≠
N2 + 6Li = 2 Li3N нитрид лития (катализатор – вода)
Слайд 16Получение и применение азота
В промышленности:
фракционная дистилляция сжиженного воздуха
(жидкий кислород остается в жидкой фазе).
В лаборатории:
термич. разл.
NH4NO2 (расплав, конц. водн. р-р):NH4NO2 = N2 + 2H2O; NH4+ + NO2− = N2 + 2H2O
окисление аммиака (без катализатора):
4NH3 + 3O2 = 2N2 + 6H2O
Применение
Синтез аммиака (… азотная к-та, нитраты и т.д.)
Создание инертной атмосферы (металлургия и др.)
Слайд 18Аммиак
NH3 – бесцветный газ с резким запахом. Ядовит.
Автопротолиз
NH3 +
NH3 ⇄ NH2– + NH4+; Ks ≈ 10–33 (–50 °С)
NH3 – активный акцептор протонов. sp 3 –гибридизация
μ = 2,46 Д
Слайд 19Аммиак в водном растворе
Высокая растворимость в воде (в 1 л
воды 700 л NH3)
Гидратация и протолиз:
NH3 + H2O =
NH3·H2O NH3 · H2O + H2O ⇄ NH4+ + OH− + H2O; pH • 7
Kо = 1,75 · 10–5
Получение аммиака. «Фонтан» (видео)
Слайд 20Соли аммония
Гидролиз
NH4Cl= NH4+ + Cl–
NH4+
+ 2H2O ⇄ NH3·H2O + H3O+;
pH • 7
KK =
5,59 · 10–10Термическое разложение
NH4HCO3 = NH3↑ + H2O↑ + CO2↑
NH4NO3 = N2O↑ + 2H2O↑
NH4NO2 = N2↑ + 2H2O↑
Слайд 21Окислительно-восстановительные свойства
Горение
4 NH3 + 3O2 = 2N2 + 6H2O
(без кат.)
4 NH3 + 5O2 = 4NO + 6H2O (кат.
Pt, Cr2O3)В водном растворе
pH • 7: 2 NH3·H2O + 6OH− −6e− = N2 + 8H2O; ϕ° = –0,74В
pH • 7: 2NH4+ −6e− = N2 + 8H+; ϕ° = +0,27В
8 NH3·H2O −6e− = N2 + 8H2O + 6NH4+; ϕ° = +0,23В
Примеры:
8 NH3·H2O + 3Br2 = N2↑ + 8H2O + 6 NH4Br
2 NH3·H2O + 2KMnO4 = N2↑ + 2MnO2↓ + 4H2O + 2KOH
Слайд 22Получение аммиака
В промышленности
N2 + 3H2 ⇄ 2NH3 + Q
(300-500
°С, 300 атм, катализатор: Fe, Pt)
В лаборатории (при нагревании)
NH4Cl +
NaOH = = NaCl + H2O + NH3↑
NH3·H2O = H2O + NH3↑
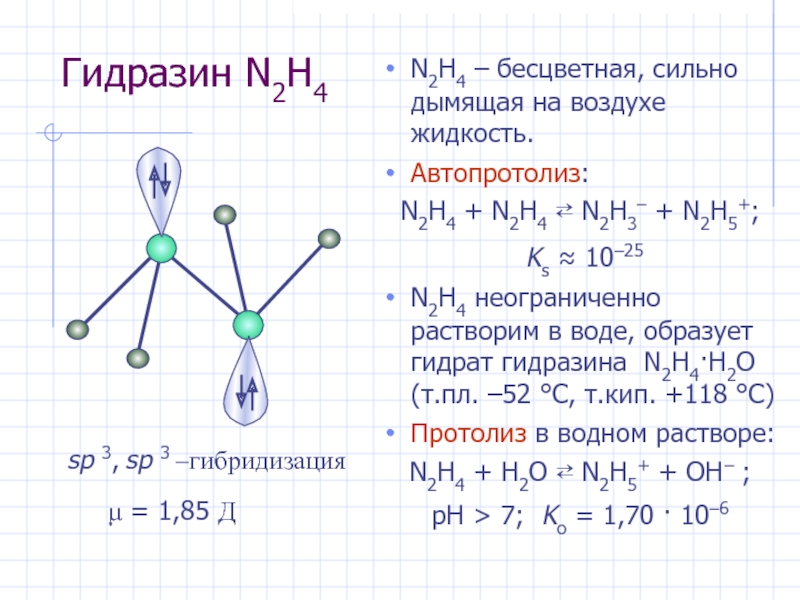
Слайд 24Гидразин N2H4
N2H4 – бесцветная, сильно дымящая на воздухе жидкость.
Автопротолиз:
N2H4
+ N2H4 ⇄ N2H3– + N2H5+;
Ks ≈ 10–25
N2H4
неограниченно растворим в воде, образует гидрат гидразина N2H4·H2O (т.пл. –52 °С, т.кип. +118 °С)Протолиз в водном растворе:
N2H4 + H2O ⇄ N2H5+ + OH− ;
pH > 7; Kо = 1,70 · 10–6
μ = 1,85 Д
sp 3, sp 3 –гибридизация
Слайд 25Протоноакцепторные свойства
N2H4 – акцептор протонов (две неподеленные пары электронов):
N2H4 +
H3O+ = N2H5+ + H2O
катион гидразиния(1+)
N2H4 + 2H3O+ =
N2H62+ + 2H2Oкатион гидразиния(2+)
Соли: [N2H5]Cl, [N2H5]2SO4, [N2H6]SO4 (получ. в изб.к-ты)
Слайд 26Окислительно-восстановительные свойства гидразина
Гидразин как восстановитель
рН • 7: N2H4·H2O + 4OH−
−4e − = N2 + 5H2O;
ϕ° = –1,12ВрН • 7: N2H5+ −4e − = N2 + 5H+; ϕ° = –0,23 В
Гидразин как окислитель
рН • 7: N2H4·H2O + 3H2O + 2e − = 2 NH3·H2O + 2OH−; ϕ° = +0,03 В
рН • 7: N2H5+ + 3H+ + 2e − = 2NH4+; ϕ° = +1,27 В
Восстановительные свойства гидразина ярче выражены в щелочной среде, а окислительные – в кислотной.
Пример: N2H4 + 2I2 = N2 + 4 HI (pH • 7)
Получение: 2NH3 + NaClO = N2H4 + NaCl + H2O
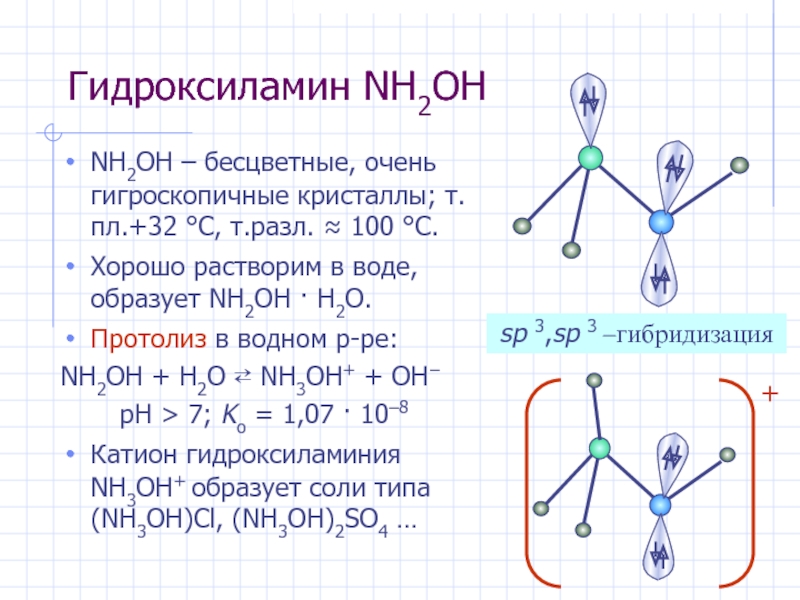
Слайд 27Гидроксиламин NH2OH
NH2OH – бесцветные, очень гигроскопичные кристаллы; т.пл.+32 °С, т.разл.
≈ 100 °С.
Хорошо растворим в воде, образует NH2OH · H2O.
Протолиз в водном р-ре:
NH2OH + H2O ⇄ NH3OH+ + OH−
pH > 7; Kо = 1,07 · 10–8
Катион гидроксиламиния NH3OH+ образует соли типа (NH3OH)Cl, (NH3OH)2SO4 …
sp 3,sp 3 –гибридизация
Слайд 28Окислительно-восстановительные свойства гидроксиламина
Гидроксиламин как восстановитель
рН • 7: 2(NH2OH·H2O) +
2OH− −2e − = N2 + 6H2O;
ϕ° = –3,04
В рН • 7: 2NH3OH+ −2e − = N2 + 4H+ + 2H2O; ϕ°= –1,87 В
Гидроксиламин как окислитель
рН • 7: (NH2OH·H2O) + H2O +2e − = NH3·H2O + 2OH−; ϕ° = +0,52 В
рН • 7: NH3OH+ + 2H+ + 2e − = NH4+ + H2O; ϕ° = +1,35 В
Получение: пропускание смеси NO и H2 через суспензию катализатора (Pt) в разб. HCl
Слайд 29Азидоводород HN3
HN3 – бесцветная летучая жидкость, неограниченно растворимая в воде
(при содержании в растворе свыше 3% масс. – взрывоопасен).
Протолиз в
водн. р-ре:HN3 + H2O ⇄ N3− + H3O+
рН • 7; KK = 1,90 · 10–5
Азид-анион N3− имеет линейную форму.
Соли MN3 подвергаются гидролизу (рН • 7).
Соли MN3 (M = Ag, Cu…) взрывоопасны (разл. на металл и N2).
⇅
тип гибридизации sp 2, sp
σ,π
σ,π
σ,π,π
σ
тип гибридизации sp, sp
Таутомерия
μ = 0,85 Д
Слайд 30Окислительно-восстановительные свойства
Восстановительные свойства азидоводорода в растворе обусловлены легкостью превращения
его в молекулярный азот:
2HN3 −2e − = 3N2 +
2H+; ϕ° = –3,10 В Азидоводород – окислитель по отношению к веществам с сильными восстановительными свойствами:
HN3 + 3HI = N2 + NH4I + I2

![Общая характеристика элементов VA-группы. Азот Элементы VА-группы Общая электронная формула:[…] ns 2 (n–1)d 10np 3 Степени Элементы VА-группы Общая электронная формула:[…] ns 2 (n–1)d 10np 3 Степени окисления: –III, 0, +III, +V Валентные](/img/thumbs/a98d955fa92e9bf2ff3e27df08465ce7-800x.jpg)