Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
"Окислительно-восстановительные реакции"
Содержание
- 1. "Окислительно-восстановительные реакции"
- 2. Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением
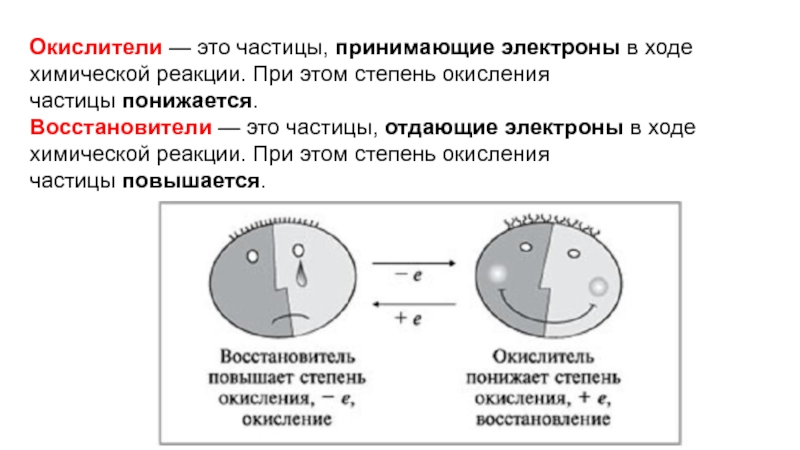
- 3. Окислители — это частицы, принимающие электроны в ходе химической
- 4. Слайд 4
- 5. В лабораторной практике наиболее часто используются следующие окислители:перманганат
- 6. Среда
- 7. Классификация окислительно–восстановительных реакцийМежмолекулярные реакции протекают с изменением
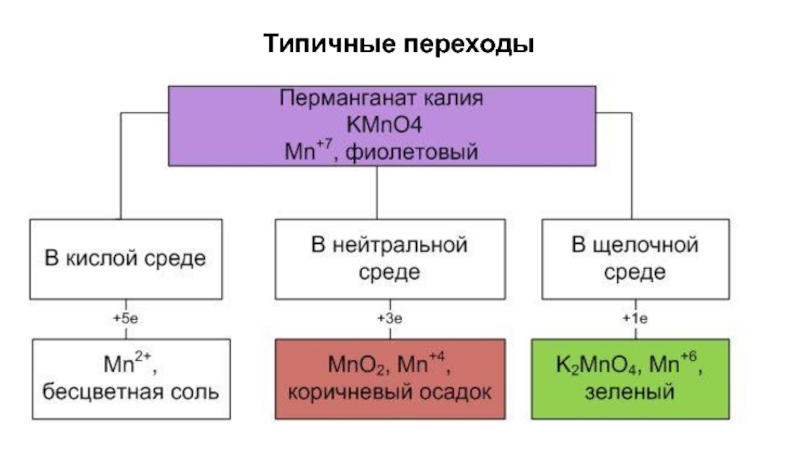
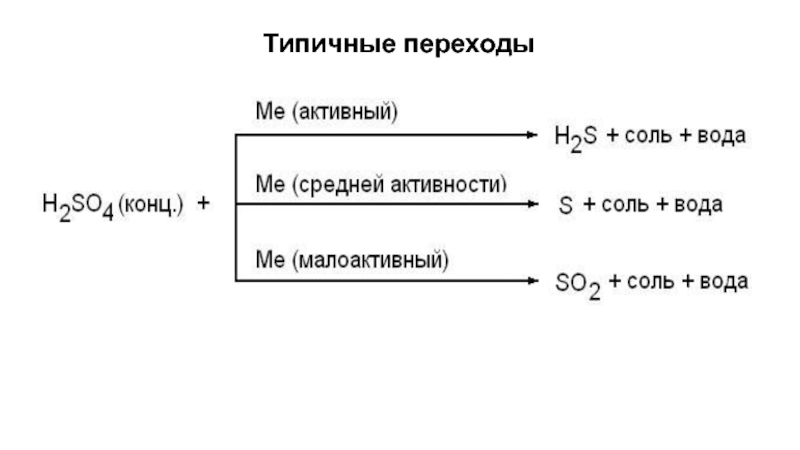
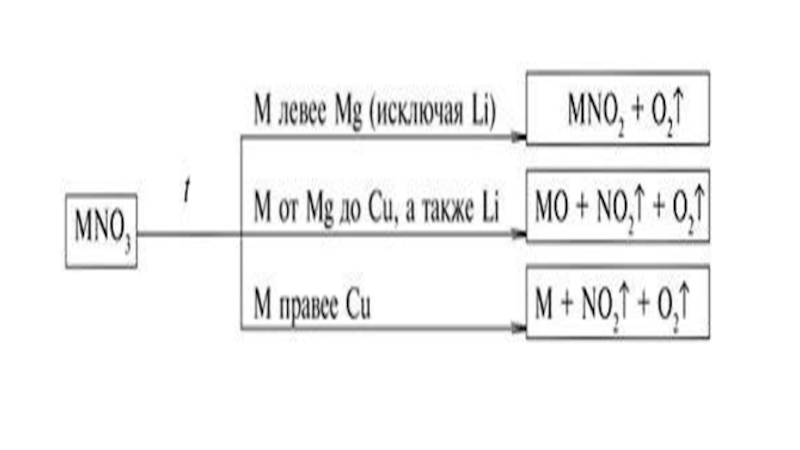
- 8. Типичные переходы
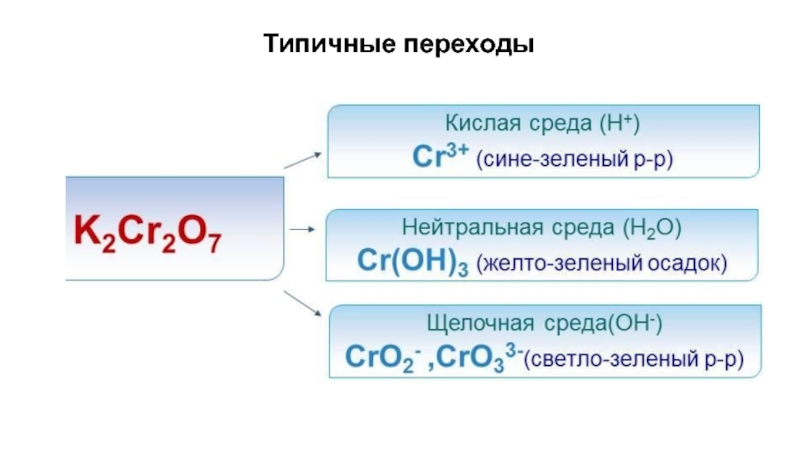
- 9. Типичные переходы
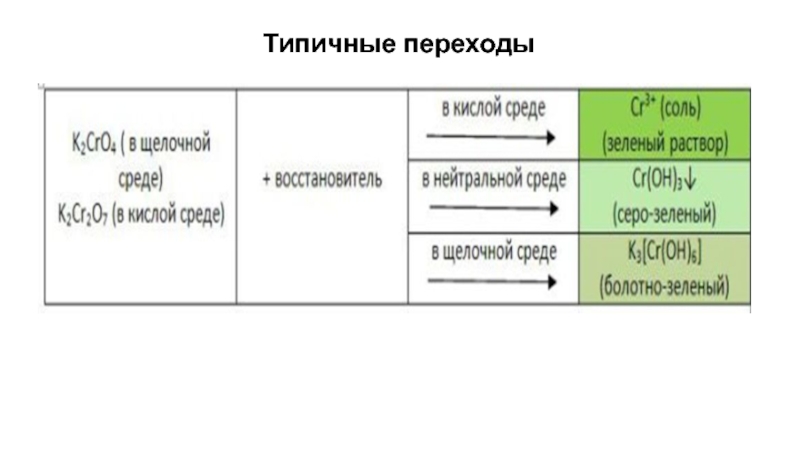
- 10. Типичные переходы
- 11. Типичные переходы
- 12. Типичные переходы
- 13. Типичные переходы
- 14. Типичные переходы
- 15. Слайд 15
- 16. Типичные переходы
- 17. Скачать презентанцию
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ.окислитель + восстановитель + среда = продукты реакции
Слайды и текст этой презентации
Слайд 2
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у
атомов реагирующих веществ.
Слайд 3
Окислители — это частицы, принимающие электроны в ходе химической реакции. При этом
степень окисления частицы понижается.
Восстановители — это частицы, отдающие электроны в ходе химической реакции. При
этом степень окисления частицы повышается.Слайд 5
В лабораторной практике наиболее часто используются следующие окислители:
перманганат калия (KMnO4);
дихромат калия
(K2Cr2O7);
азотная кислота (HNO3);
концентрированная серная кислота (H2SO4);
пероксид водорода (H2O2);
оксиды марганца (IV)
и свинца (IV) (MnO2, PbO2);расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов
К восстановителям, которые применяются в лабораторной практике относятся:
магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
водород (Н2) и углерод (С);
иодид калия (KI);
сульфид натрия (Na2S) и сероводород (H2S);
сульфит натрия (Na2SO3);
хлорид олова (SnCl2).
Слайд 7
Классификация окислительно–восстановительных реакций
Межмолекулярные реакции протекают с изменением степени окисления атомов,
которые находятся в различных молекулах.
Внутримолекулярные реакции — это такие реакции, в которых окислитель и
восстановитель входят в состав одной и той же молекулы.Реакции диспропорционирования (самоокисления-самовосстановления) — это такие реакции, в которых атом (ион) одного и того же элемента является и окислителем, и восстановителем.
Репропорционирование (конпропорционирование) — это реакция, в которой и окислитель, и восстановитель образуют при восстановлении и окислении одинаковый продукт. Реакция, обратная диспропорционированию.