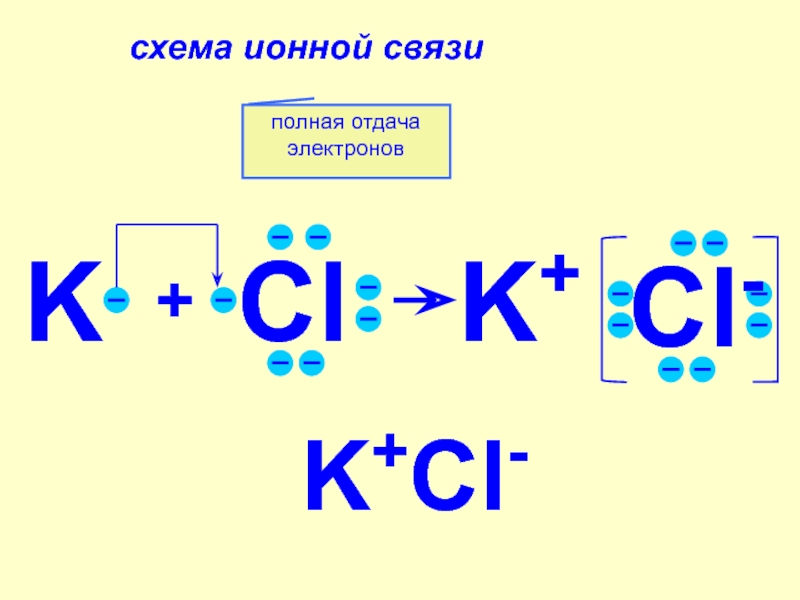
единицу времени в единице объёма.
r – скорость химической реакции,
V –
объём м3, Δv – количество вещества в молях,Δτ – промежуток времени сек.,
ΔС – молярная концентрация (Δv/ V)