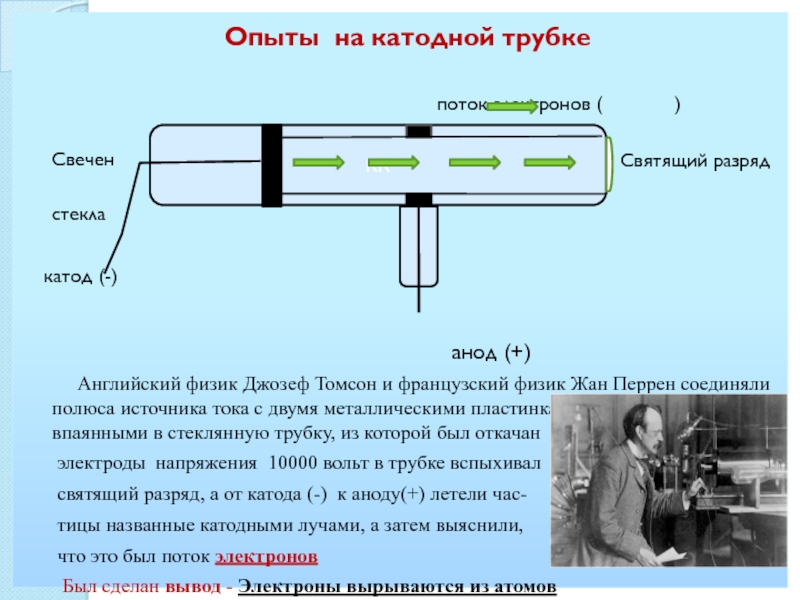
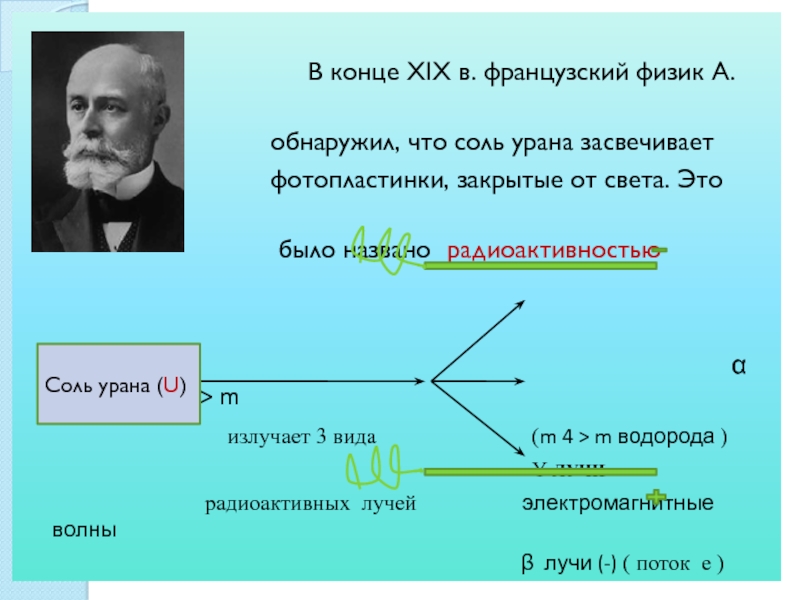
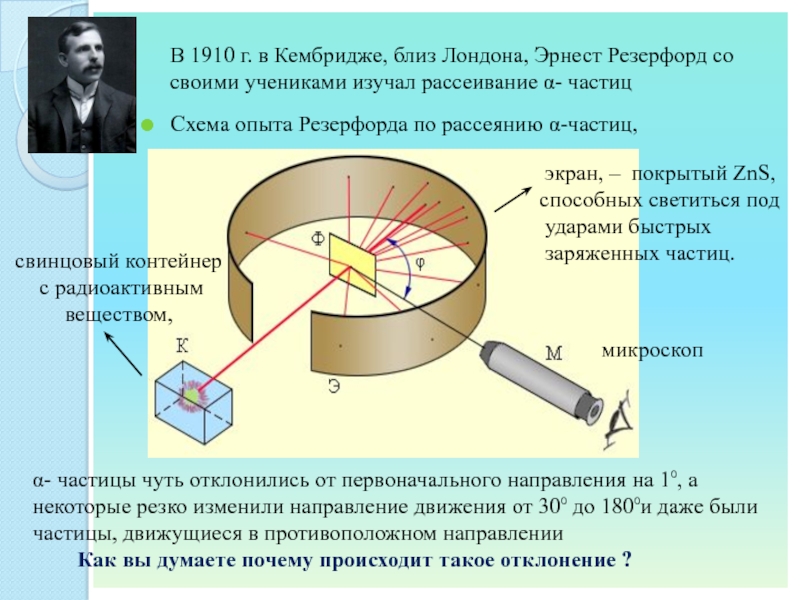
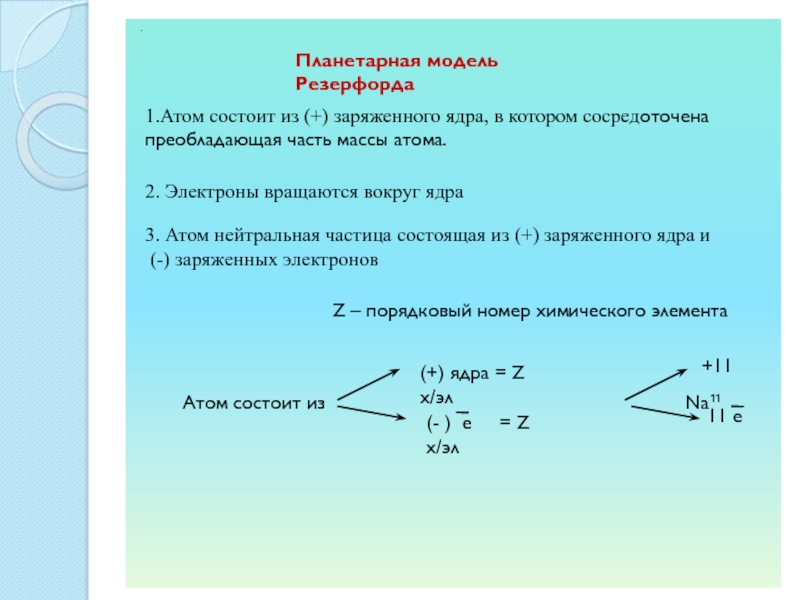
СТОНЕИ (Стони)
Джордж Джонстон
1. высказал, что электричество переносится
мельчайшими частицами
2.В 1891 г. Стони назвал эти частицы
электронами
( «электрон» происходит от греческое слово и
переводится как «янтарь» )