Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодическая система химических элементов в свете строения атома.
Содержание
- 1. Периодическая система химических элементов в свете строения атома.
- 2. Слайд 2
- 3. Д.И.Менделеев расположил калий (К)за аргоном (Ar)
- 4. .
- 5. Структура периодической системы
- 6. Слайд 6
- 7. .Выводы
- 8. 3. Номер группы показывает число электронов на
- 9. 6. Химическая активность металлов обуславливается легкостью отдавать
- 10. 8. Изменение свойств металлов в группе +3
- 11. 9. Неметаллические свойства проявляют элементы имеющие на
- 12. .Увеличивается радиус атома11. В группе с увеличением
- 13. Почему химические элементы проявляют одинаковые свойства?+3+112
- 14. Почему химические элементы обладают различными
- 15. Периодичность химических свойств элементов объясняетсяII период
- 16. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1.
Периодический закон
и
периодическая система химических элементов Д.И.Менделеева
в свете
теории строения
Слайд 2
и разработка периодической системы
химических элементов Д. И. Менделеевым
явились вершиной развития химии в XIX
веке.
Он расположил все химические элементы
по возвростании атомных масс
H, He, Li, Be, B, C, N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, K, Ar
1 4 7 9 11 12 14 16 19 20 23 24 27 28 31 32 35,5 39 40
и обнаружил, что через каждые семь химических элементов
периодически повторяются сходные свойства элементов
Слайд 3
Д.И.Менделеев расположил калий (К)за аргоном (Ar)
так
как калий щелочной металл, поэтому должен стоять в группе с
щелочными металлами , а аргон инертный газ, должен стоять в группе с инертными газамиСвойства простых тел, а также свойства их соединений находятся в периодической зависимости от величины атомных весов элементов.
I период H, He,
II период Li, Be, B, C, N, O, F, Ne
III период Na, Mg, Al, Si, P, S, Cl,
Iv период , Са …
Ar
K
В 1869 г. впервые сформулировал периодический закон.
Слайд 4.
Этим открытием Мозле подтвердил,
что порядковый номер химического элемента равна заряду ядра и количеству электроновзаряд ядра + 19 заряд ядра +18
количество электронов 19 е 18 е
В 1913 английский физик Генри Мозле
установил, что величина зарядов ядер атомов
последовательно возрастает от элемента к
элементу на единицу.
Ar¹⁸ K¹⁹ и Co²⁷ и Ni²⁸ Te ⁵² и I⁵³
39 40 58.9 58.7 127.6 126.9
К¹⁹
Свойства простых тел, а также свойства их соединений находятся в периодической зависимости от величины заряда ядра элементов.
Ar¹⁸
Поэтому современная формулировка периодического закона гласит
Слайд 5 Структура периодической системы
По горизонтали расположены 7 периодов;
3 малых (I, II, III периоды, они состоят из 1 - го ряда нечетного)
4 больших (IV, V, VI, VII периоды, они состоят из 2-х рядов; четного и
нечетного)
По вертикали расположены 8 групп
главной подгруппы
каждая группа состоит из 2-х подгрупп
побочной подгруппы
3. Внизу периодической системы расположены;
формулы высших оксидов
летучих водородных соединений
ряд лантаноидов и актиноидов
Слайд 6
Д.И.Менделеев говорил :
«Периодическому закону будущее не грозит
разрушением, а надстройку и развитие обещает
И действительно последующее развитие науки позволило
глубже познать строение материи.
Открытие строения атома придала периодическому закону новое
теоретическое освещение, подчеркнув его огромное значение и
подтвердив гениальность и истинность периодического закона
Слайд 7.Выводы
1.Физический смысл порядкового номера элемента,
означает величину заряда ядра атома и количествo
электронов
Na¹¹ 11 заряд ядра и 11 электронов
2. Номер периода показывает число энергетических уровней (электронных оболочек или электронных слоев)
I период один энергетический уровень
II период две энергетических уровеней
III период три энергетических уровней
Na ¹¹
3s¹ 22,9898
натрий
+11
+3
+1
+11
Слайд 83. Номер группы показывает число электронов на наружном энергетическом уровне
и величину положительной валентности.
II группаМg¹²
2 8 2 - 2 ē = Mg ⁺²
4. Атомная масса составляет сумму протонов и нейтронов
Ar = p + n p = 11 n⁰= Ar – p
n⁰= 23 – 11 = 12
5. Металлические свойства проявляют элементы имеющие на наружном энергетическом уровне мало электронов (от 1 до 3 ē ) и которые обладают свойством отдавать электроны
Например: Na
2 8 1 металл - 1 ē
+12
Na ¹¹
3s¹ 22,9898
натрий
+11
Слайд 96. Химическая активность металлов обуславливается легкостью отдавать электроны из внешнего
энергетического уровня
7. В периоде с возрастанием заряда ядра металлические свойства
ослабевают, т.к. отдача электронов ослабевает.Например элементы III периода:
Na¹¹ Mg¹² Al¹³ Si¹⁴ P¹⁵ S¹⁶ Cl¹⁷
2 8 1 2 8 2 2 8 3 284 285 286 287
увеличивается (+) заряд ядра от +11 до +17, поэтому усиливается сила притяжения
электронов к ядру, что приводит к уменьшению радиуса атома (R) .
с уменьшением радиуса атома отдача электронов ослабевают.
+11
+12
+13
+14
+15
+16
+17
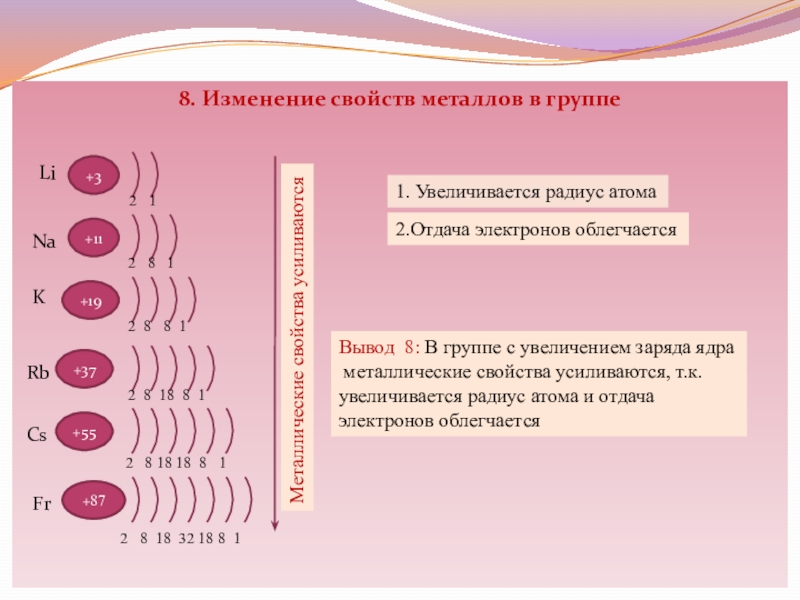
Слайд 108. Изменение свойств металлов в группе
+3
2
1
+11
+19
2 8 1
2 8 8
1Li
Na
K
Rb
+37
Cs
Fr
+55
+87
2 8 18 8 1
2 8 18 18 8 1
2 8 18 32 18 8 1
1. Увеличивается радиус атома
2.Отдача электронов облегчается
Металлические свойства усиливаются
Вывод 8: В группе с увеличением заряда ядра
металлические свойства усиливаются, т.к.
увеличивается радиус атома и отдача
электронов облегчается
Слайд 119. Неметаллические свойства проявляют элементы имеющие на наружном энергетическом уровне
много электронов (от 3 до 7 ē ) и которые
обладают свойством принимать электроныНапример: Р
+15 ) ) )
2 8 5 неметалл + 3 ē = Рˉ³
10. Химическая активность неметаллов обуславливается
легкостью принимать электроны недостающих до завершения
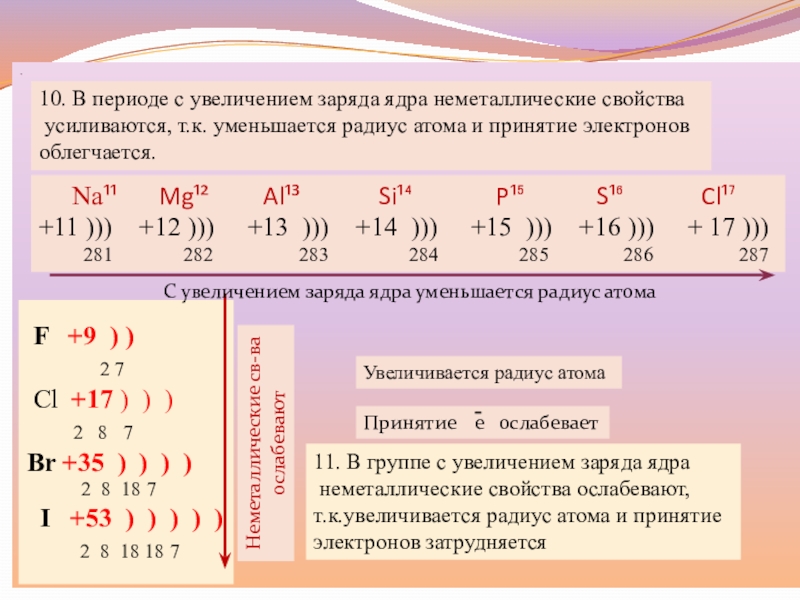
Слайд 12.
Увеличивается радиус атома
11. В группе с увеличением заряда ядра
неметаллические
свойства ослабевают,
т.к.увеличивается радиус атома и принятие
электронов затрудняется
F
+9 ) )2 7
Cl +17 ) ) )
2 8 7
Br +35 ) ) ) )
2 8 18 7
I +53 ) ) ) ) )
2 8 18 18 7
Принятие е оcлабевает
Неметаллические св-ва
ослабевают
Na¹¹ Mg¹² Al¹³ Si¹⁴ P¹⁵ S¹⁶ Cl¹⁷
+11 ))) +12 ))) +13 ))) +14 ))) +15 ))) +16 ))) + 17 )))
281 282 283 284 285 286 287
С увеличением заряда ядра уменьшается радиус атома
10. В периоде с увеличением заряда ядра неметаллические свойства
усиливаются, т.к. уменьшается радиус атома и принятие электронов
облегчается.
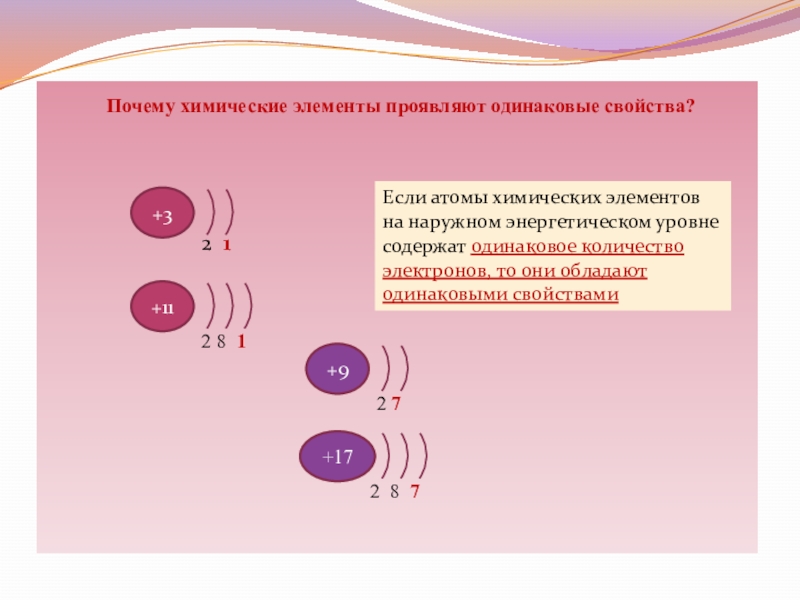
Слайд 13 Почему химические элементы проявляют одинаковые свойства?
+3
+11
2 1
2 8 1
Если
атомы химических элементов
на наружном энергетическом уровне
содержат одинаковое количество
электронов, то они
обладаютодинаковыми свойствами
+9
+17
2 7
2 8 7
Слайд 14
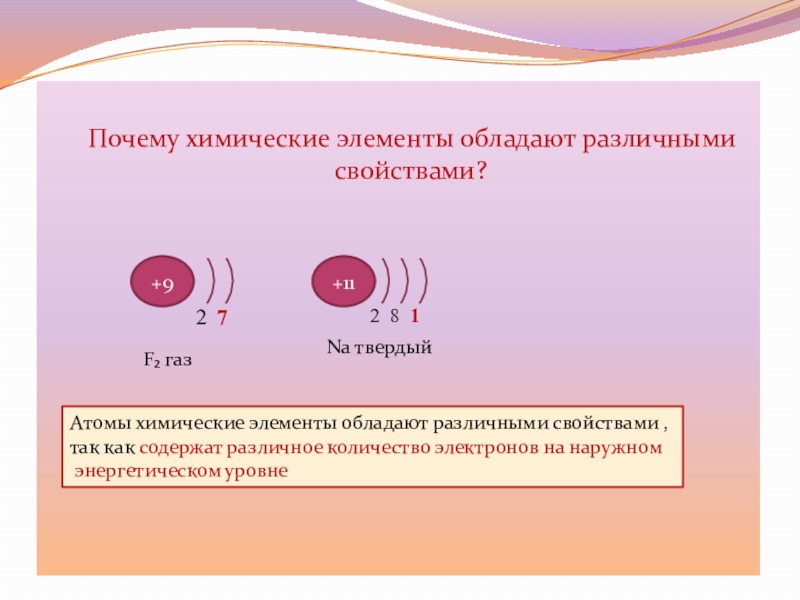
Почему химические элементы обладают различными свойствами?
+9
+11
2 7
2 8
1
Атомы химические элементы обладают различными свойствами ,
так как содержат различное
количество электронов на наружномэнергетическом уровне
F₂ газ
Na твердый
Слайд 15Периодичность химических свойств элементов объясняется
II период
Li³
Be⁴ B⁵
C⁶ N⁷ O⁸ F⁹ Ne¹⁰III период
Na¹¹ Mg¹² Al¹³ Si¹⁴ P¹⁵ S¹⁶ Cl¹⁷ Ar¹⁸
+11
+12
+13
+14
+15
+16
+17
+18
+10
+9
+8
+7
+6
+5
+4
+3
2 1 2 2 2 3 24 2 5 26 2 7 2 8
28 1 282 283 284 285 286 287 288
В каждом периоде с возрастанием заряда ядра на наружном энергетическом уровне идет накопление электронов от 1 до 8, что и является причиной периодичности, повторяемости свойств элементов.