Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Периодический закон Д.И. Менделеева
Содержание
- 1. Периодический закон Д.И. Менделеева
- 2. Периодическая система химических элементов (табли́ца Менделе́ева) — классификация
- 3. Периодическая система химических элементов является графическим отображением
- 4. Слайд 4
- 5. Д. И. Менделеев дал следующую формулировку
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Современная формулировка периодического закона несколько изменена: «Свойства
- 11. В каком ряду химических элементов
- 12. Слайд 12
- 13. В каком ряду химических элементов
- 14. Неметаллические свойства простых веществ усиливаются в ряду
- 15. Слайд 15
- 16. Неметаллические свойства простых веществ усиливаются в ряду
- 17. От кислотных к основным меняются свойства оксидов
- 18. Слайд 18
- 19. От кислотных к основным меняются свойства оксидов
- 20. Неметаллические свойства углерода выражены сильнее, чем неметаллические свойства 1) кислорода2) кремния3) азота4) фтора
- 21. Слайд 21
- 22. Неметаллические свойства углерода выражены сильнее, чем
- 23. Валентность элемента в летучем водородном соединении уменьшается
- 24. Слайд 24
- 25. Валентность элемента в летучем водородном соединении уменьшается
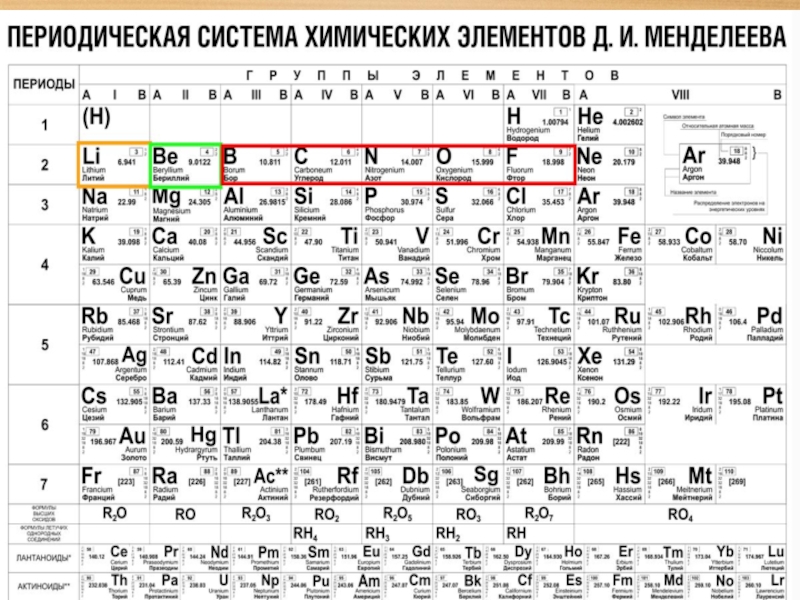
- 26. Вывод:Периодическая система химических элементов является графическим отображением
- 27. Спасибо за внимание!
- 28. Скачать презентанцию
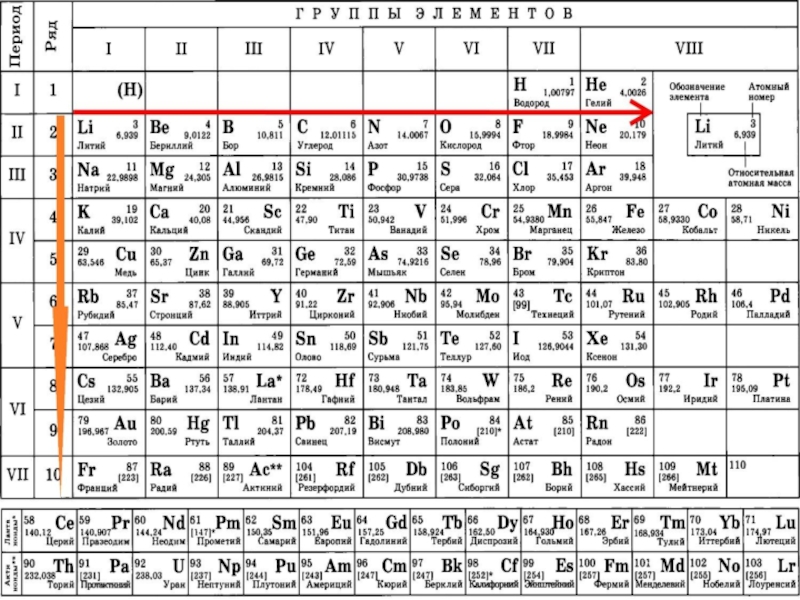
Периодическая система химических элементов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра.
Слайды и текст этой презентации
Слайд 2Периодическая система химических элементов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая
зависимость различных свойств элементов от заряда атомного ядра.
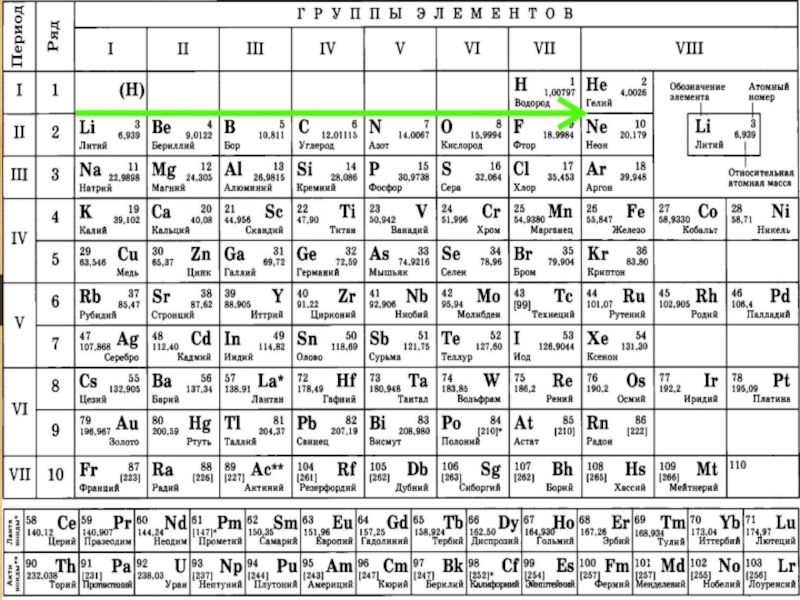
Слайд 3Периодическая система химических элементов является графическим отображением Периодического закона.
Периодический
закон сформулирован
Д. И. Менделеевым в 1869 году.
Слайд 5 Д. И. Менделеев дал следующую формулировку периодического закона:
«Свойства простых
веществ, а также состав и свойства соединений элементов находятся в
периодической зависимости от относительных атомных масс».Слайд 10Современная формулировка периодического закона несколько изменена:
«Свойства химических элементов и
их соединений находятся в периодической зависимости от зарядов атомных ядер».
Слайд 11 В каком ряду химических элементов усиливаются металлические свойства соответствующих им
простых веществ?
1) кислород → фтор → неон
2) кремний →
сера → хлор3) селен → сера → кислород
4) алюминий → магний → натрий
Слайд 13 В каком ряду химических элементов усиливаются металлические свойства соответствующих им
простых веществ?
1) кислород → фтор → неон
2) кремний →
сера → хлор3) селен → сера → кислород
4) алюминий → магний → натрий
Ответ: Металлические свойства простых веществ усиливаются по ряду элементов периодической системы сверху вниз и справа налево. Поэтому верен ряд №4.
Слайд 14Неметаллические свойства простых веществ усиливаются в ряду
1) фосфор → кремний
→ алюминий
2) фтор → хлор → бром
3) селен → сера
→ кислород4) азот → фосфор → мышьяк
Слайд 16Неметаллические свойства простых веществ усиливаются в ряду
1) фосфор → кремний
→ алюминий
2) фтор → хлор → бром
3) селен → сера
→ кислород4) азот → фосфор → мышьяк
Ответ : Неметаллические свойства простых веществ усиливаются по ряду элементов периодической системы снизу вверх и слева направо. Поэтому среди среди представленных неметаллические свойства простых веществ усиливаются в ряду
селен → сера → кислород.
Слайд 17От кислотных к основным меняются свойства оксидов в ряду
1) CaO
– SiO2 – SO3
2) Na2O - MgO – AI2O3
3) CO2
- AI2O3 - MgO 4) SO2 – P2O5 – SiO2
Слайд 19От кислотных к основным меняются свойства оксидов в ряду
1) CaO
– SiO2 – SO3
2) Na2O - MgO – AI2O3
3) CO2
- AI2O3 - MgO 4) SO2 – P2O5 – SiO2
Ответ: В первом ряду свойства оксидов меняются от основных к кислотным, во втором — от основных к амфотерным, в четвёртом — представлены только кислотные оксиды, а в третьем — от кислотного через амфотерный к основному.
Слайд 20
Неметаллические свойства углерода выражены сильнее, чем неметаллические свойства
1) кислорода
2) кремния
3)
азота
4) фтора
Слайд 22
Неметаллические свойства углерода выражены сильнее, чем неметаллические свойства
1) кислорода
2) кремния
3)
азота
4) фтора
Ответ: Неметаллические свойства простых веществ усиливаются по ряду элементов
периодической системы снизу вверх и слева направо. Поэтому неметаллические свойства углерода выражены сильнее, чем неметаллические свойства кремния.Слайд 23Валентность элемента в летучем водородном соединении уменьшается в ряду
1) O
– S – Se
2) C – Si – Ge
3) CI
– Br – I 4) C – N – O
Слайд 25Валентность элемента в летучем водородном соединении уменьшается в ряду
1) O
– S – Se
2) C – Si – Ge
3) CI
– Br – I 4) C – N – O
Ответ: Валентность элемента в летучем водородном соединении уменьшается по ряду от IV к VII группе, поэтому верный ответ под номером 4
Слайд 26Вывод:
Периодическая система химических элементов является графическим отображением Периодического закона.
В периоде:
постепенно
ослабляются металлические свойства простых веществ и усиливаются неметаллические;
высшая валентность элементов
по кислороду возрастает от I (у щелочных металлов) до VII (у галогенов);валентность элементов неметаллов в летучих водородных соединениях уменьшается от IV до I (у галогенов);
свойства высших оксидов и гидроксидов постепенно изменяются от основных через амфотерные до кислотных.