с различными типами химической связи.
Степень электролитической диссоциации.
Сильные и
слабые электролиты. Основные положения теории электролитической диссоциации.
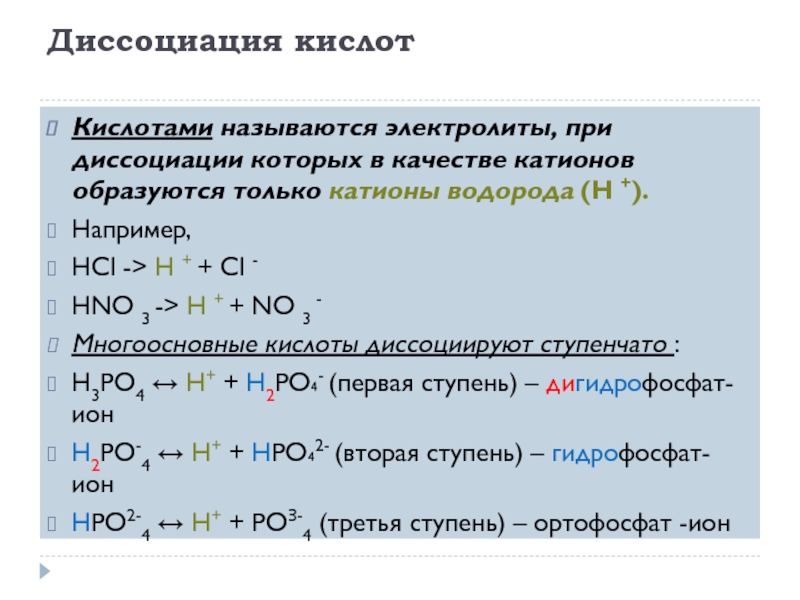
Кислоты, основания и соли как электролиты.





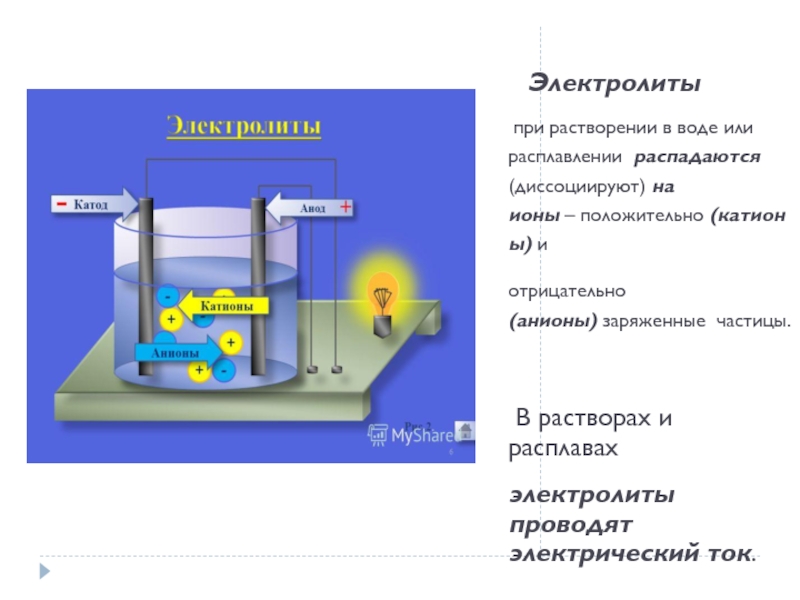
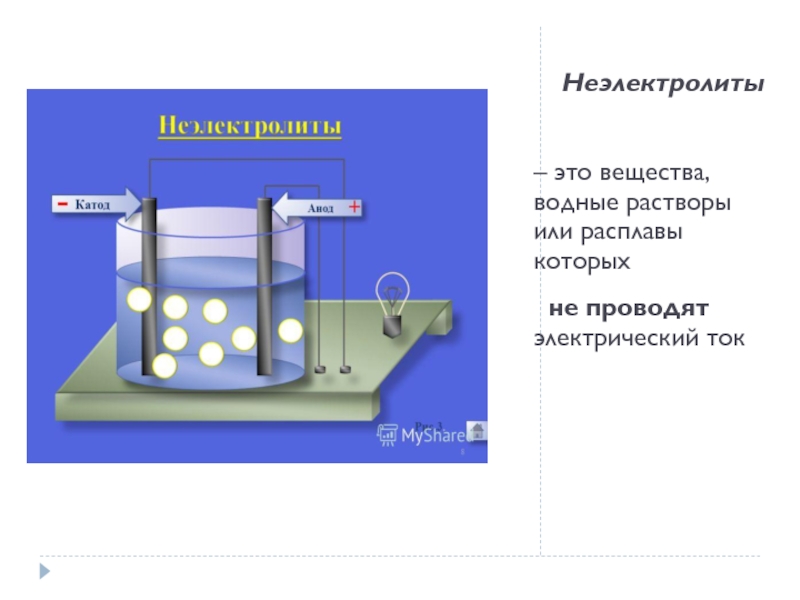
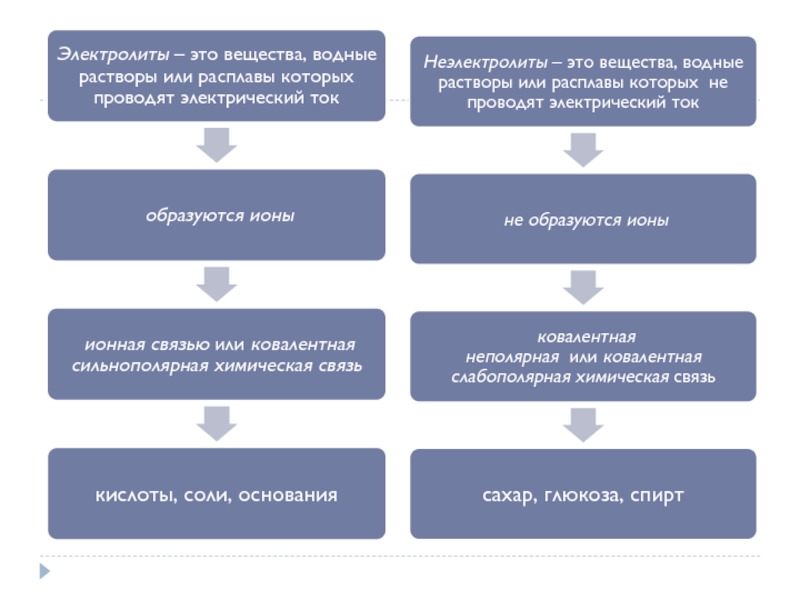
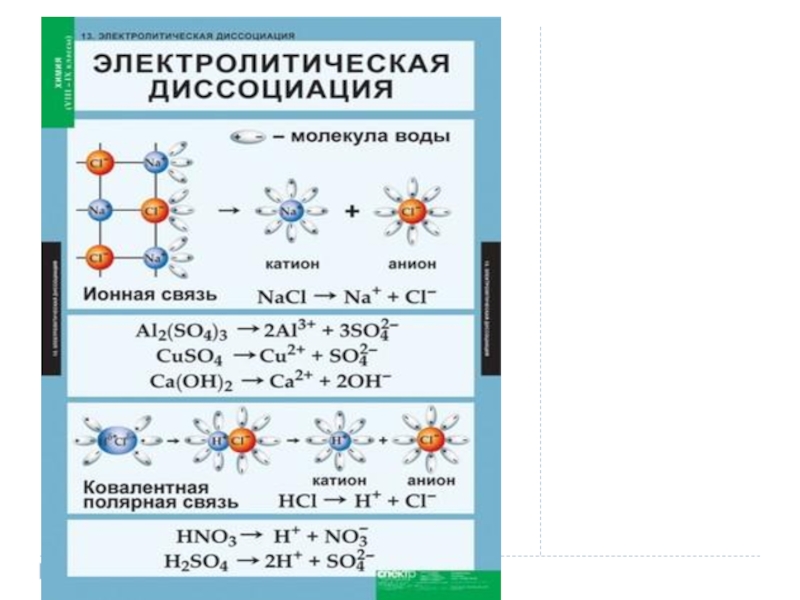




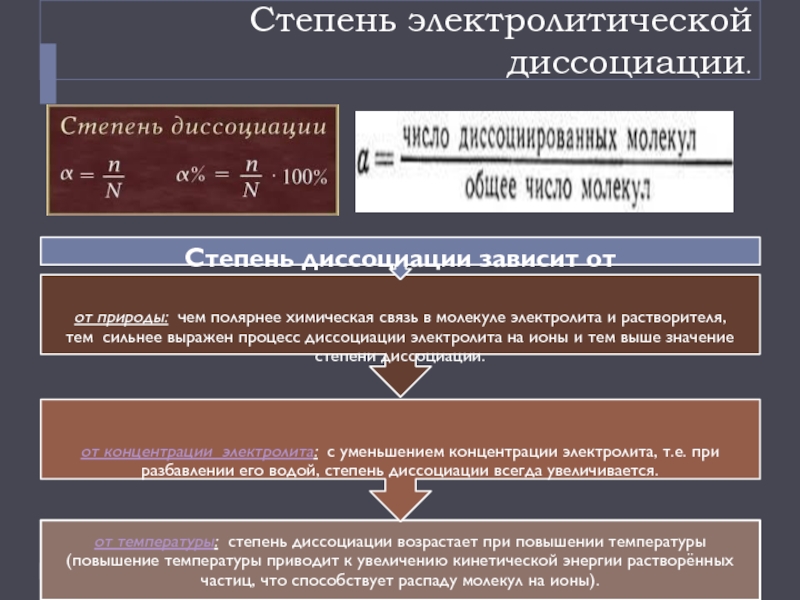
 30%1. Растворимые соли;2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));3. Сильные основания – щёлочи.α" alt="электролитысильныеслабыеα>30%1. Растворимые соли;2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));3. Сильные основания – щёлочи.α">
30%1. Растворимые соли;2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));3. Сильные основания – щёлочи.α" alt="электролитысильныеслабыеα>30%1. Растворимые соли;2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));3. Сильные основания – щёлочи.α">




















