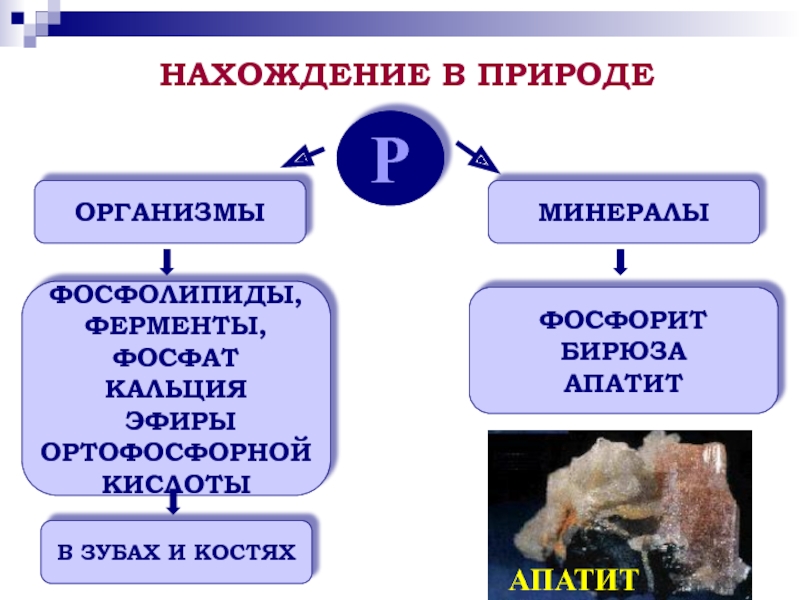
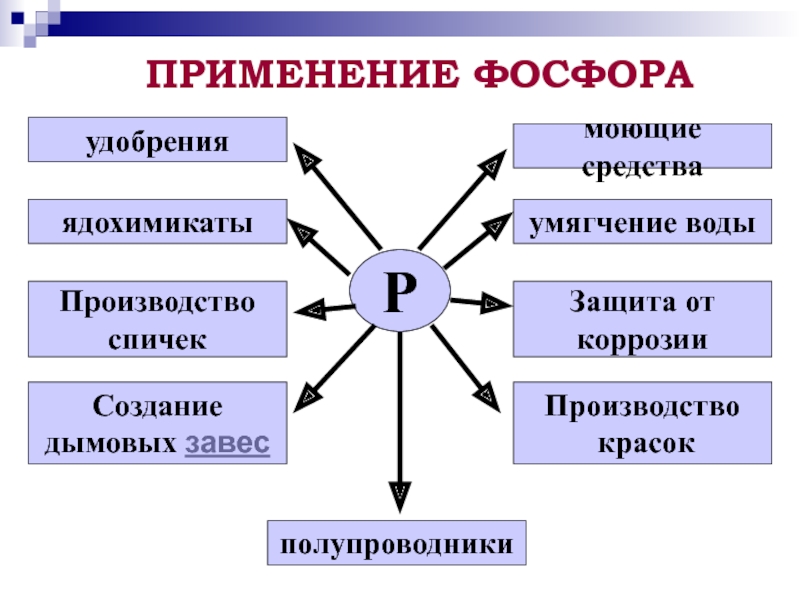
элементе и простом веществе;
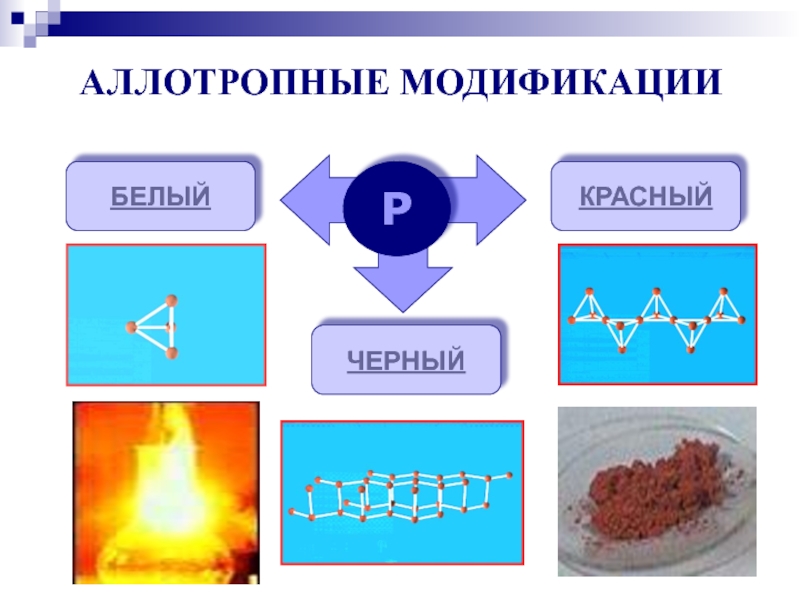
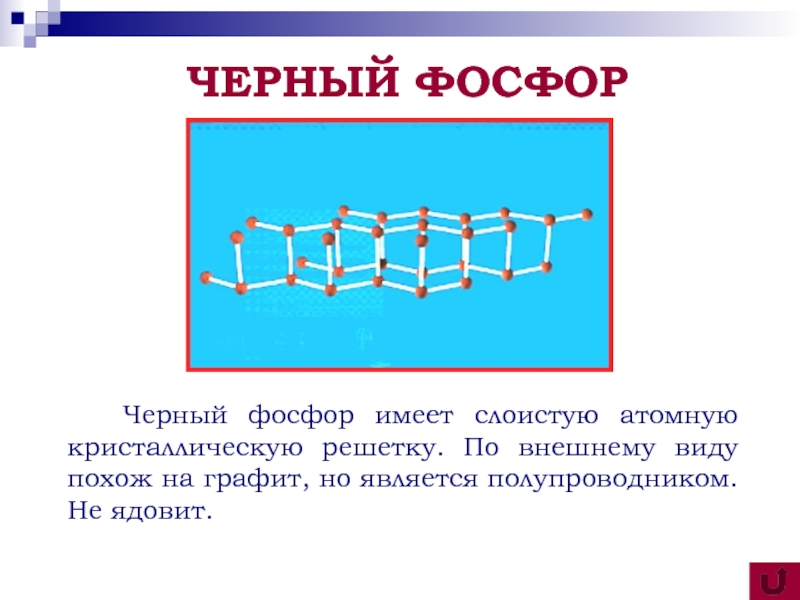
аллотропных видоизменениях фосфора;
повторить зависимость свойств
вещества от его состава и строения; развивать умение сравнивать;
способствовать формированию материалистического мировоззрения, нравственному воспитанию школьников.