Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соединения серы
Содержание
- 1. Соединения серы
- 2. Серная кислота - этоСильная двухосновная кислота, степень окисления серы в которой +6.Формула серной кислоты:H2SO4
- 3. Техника безопасности при работе
- 4. получение и производствоПромышленные методы производства
- 5. рассмотрим каждую стадию подробнее:
- 6. 1 стадияПолучение SO2В качестве сырья применяют серу , колчедан или сероводород.S+ O2 = SO2
- 7. 2 стадияПолучение SO3 Окисление кислорода проводят с помощью катализатора.2SO2 + O2 = 2SO3
- 8. Получение H2SO4Процесс растворения серы (VI) проводят в
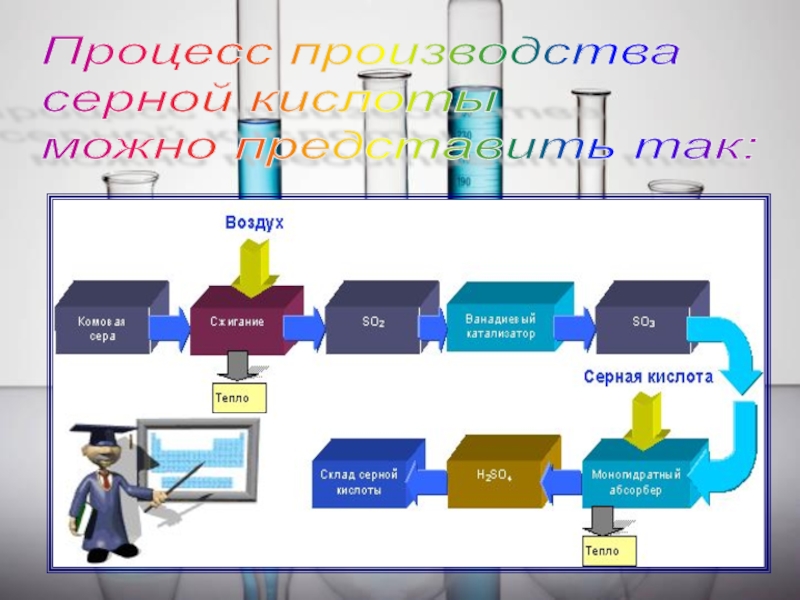
- 9. Процесс производства серной кислоты можно представить так:
- 10. Производство H2SO4 в мире неуклонно растет. Так,
- 11. Но, помимо этого, производство серной
- 12. H2SO4 - важнейший продукт основной
- 13. Серная кислота используется в качестве электролита в автомобильных аккумуляторах.
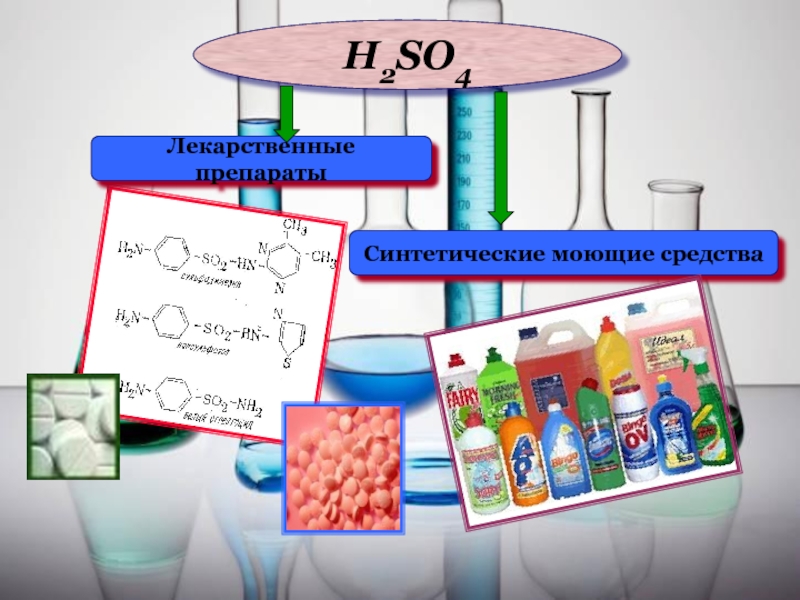
- 14. H2SO4Лекарственные препаратыСинтетические моющие средства
- 15. Спасибо за внимание!!!
- 16. Скачать презентанцию
Серная кислота - этоСильная двухосновная кислота, степень окисления серы в которой +6.Формула серной кислоты:H2SO4
Слайды и текст этой презентации
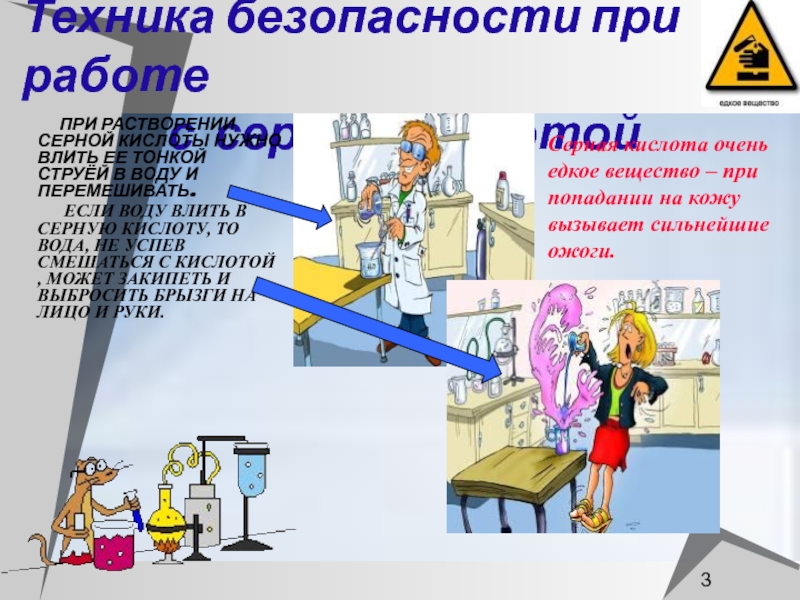
Слайд 3Техника безопасности при работе
с серной кислотой
ПРИ РАСТВОРЕНИИ СЕРНОЙ
КИСЛОТЫ НУЖНО ВЛИТЬ ЕЕ ТОНКОЙ СТРУЁЙ В ВОДУ И ПЕРЕМЕШИВАТЬ.ЕСЛИ ВОДУ ВЛИТЬ В СЕРНУЮ КИСЛОТУ, ТО ВОДА, НЕ УСПЕВ СМЕШАТЬСЯ С КИСЛОТОЙ , МОЖЕТ ЗАКИПЕТЬ И ВЫБРОСИТЬ БРЫЗГИ НА ЛИЦО И РУКИ.
Серная кислота очень едкое вещество – при попадании на кожу вызывает сильнейшие ожоги.
Слайд 4получение
и
производство
Промышленные методы производства H2SO4 основаны на получении сначала
оксида серы (IV) SO2, окислении его в оксид серы (VI)
SO3 и взаимодействии последнего с водой.Слайд 8Получение H2SO4
Процесс растворения серы (VI) проводят в концентрированной серной кислоте,
при этом получается:
SO3 + H2 O = H2SO4
3 стадия
Слайд 10Производство H2SO4 в мире неуклонно растет. Так, в период с
2000 по 2005 год оно возросло со 160 до 189
млн. тонн.В России объём производства серной кислоты c 2000 по 2005 год возрос в среднем на 1 млн. тонн и составил 9,3 млн. тонн.