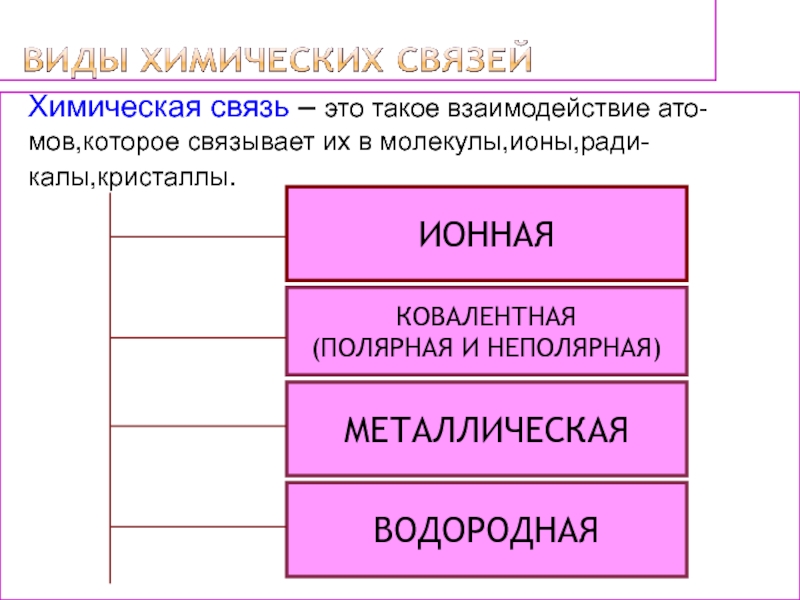
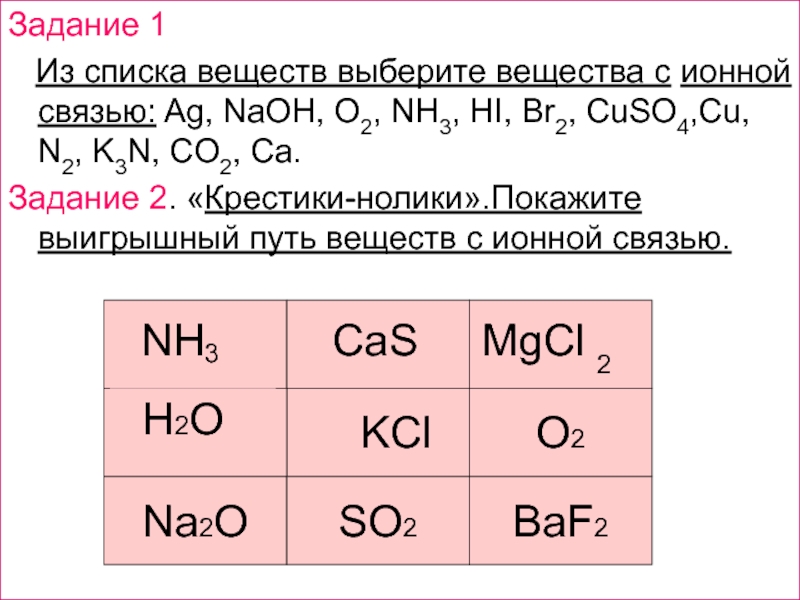
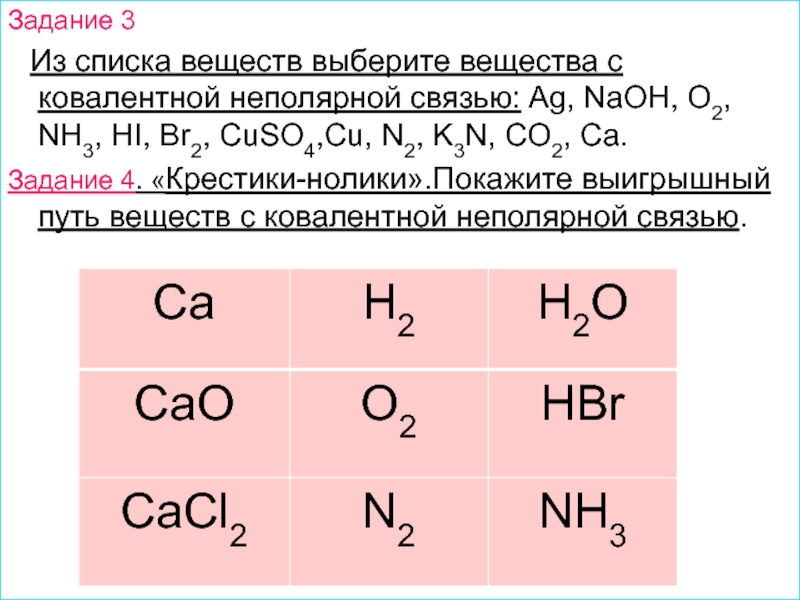
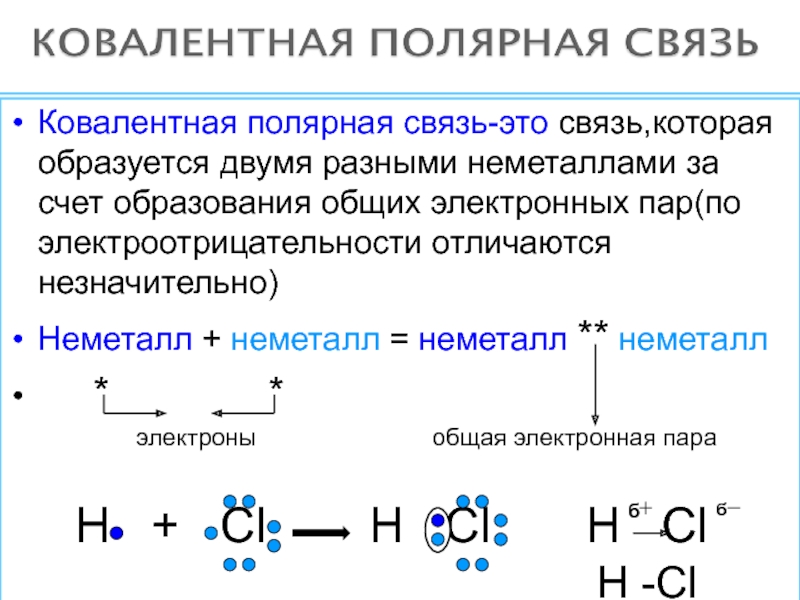
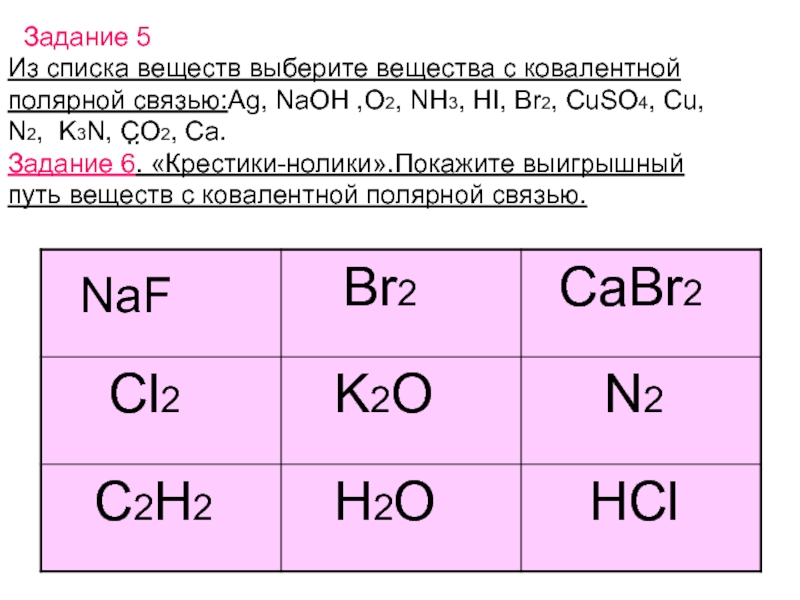
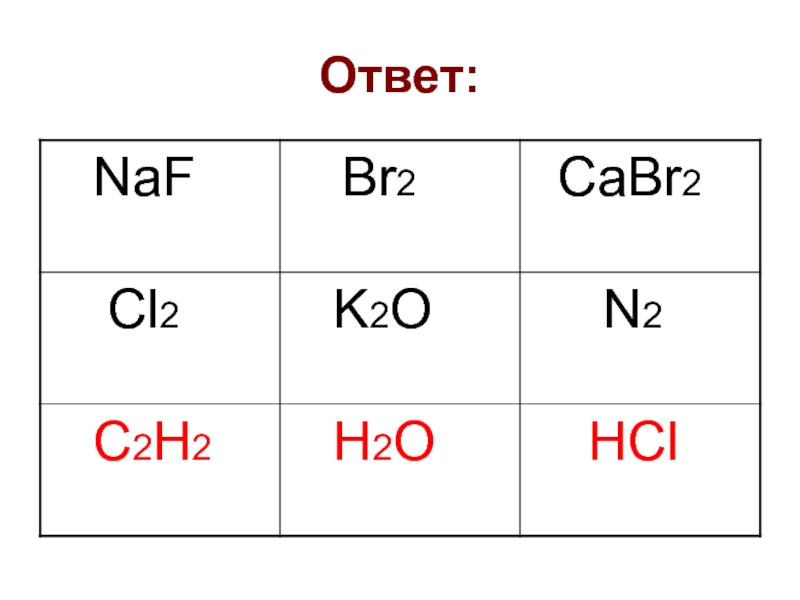
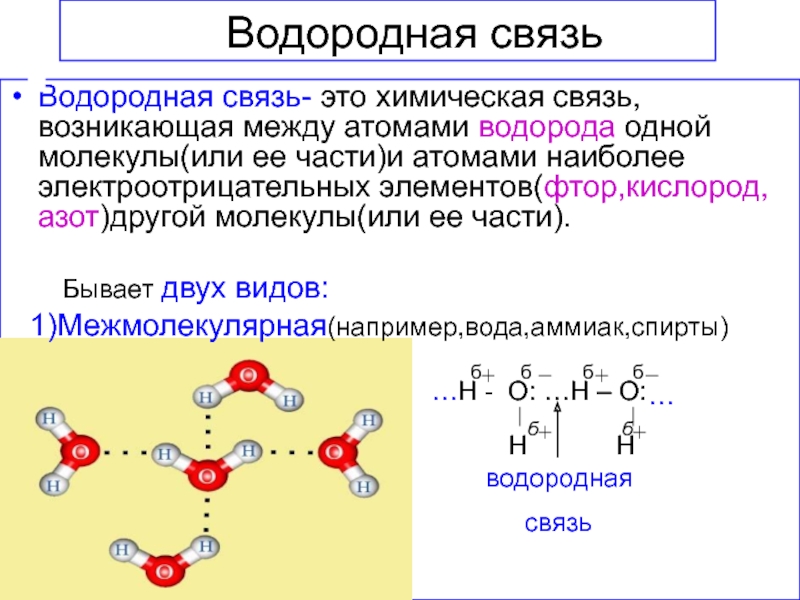
решеток.
2)Повторить схемы образования веществ с разными видами связей.
3)Продолжить формирование умения
записывать их на примерах.4)Сравнить разные виды химических связей.
5)Выявить зависимость свойств веществ от типов кристаллических решеток.