Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Все о предельных одноатомных спиртах
Содержание
- 1. Все о предельных одноатомных спиртах
- 2. Определение спиртовКлассификация спиртовНоменклатураИзомерияФизические свойстваХимические свойстваФизиологическое действие спиртовПрименение спиртовПолучение спиртовСодержание
- 3. Спиртами называются органические вещества, молекулы которых содержат
- 4. По характеру углеводородного радикала:СН3СН2ОН спиртыалифатическиеалициклическиеароматическиециклогексанол
- 5. По числу гидроксильных групп: СН3 – ОНметанол
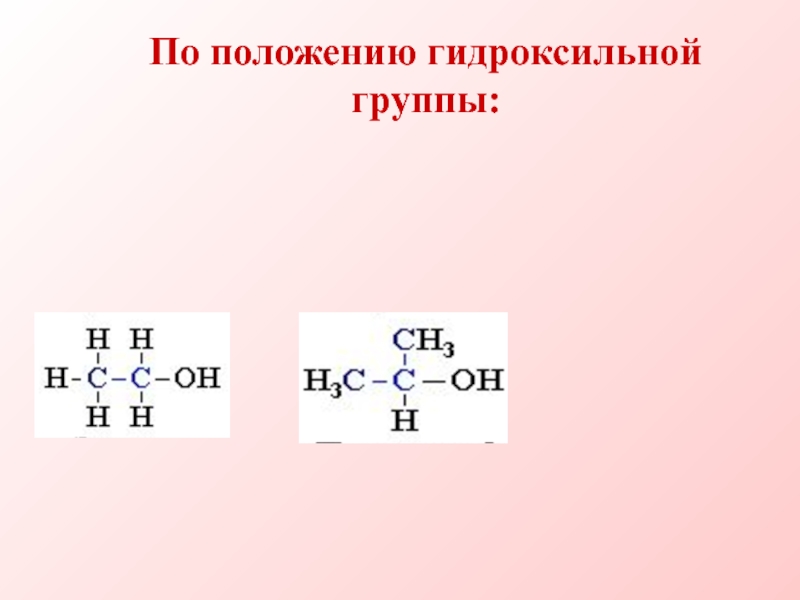
- 6. По положению гидроксильной группы:
- 7. Этанол, пентанол-2Номенклатура
- 8. Названия одноатомных спиртов образуются из названия углеводорода
- 9. Виды изомерии спиртовСтруктурная 1. Углеродной цепи 2. Положения функциональной группы
- 10. Физические свойства.Температура кипения спиртов выше температуры кипения
- 11. Это объясняется наличием межмолекулярной водородной связи, которая
- 12. Физические свойства гомологического ряда
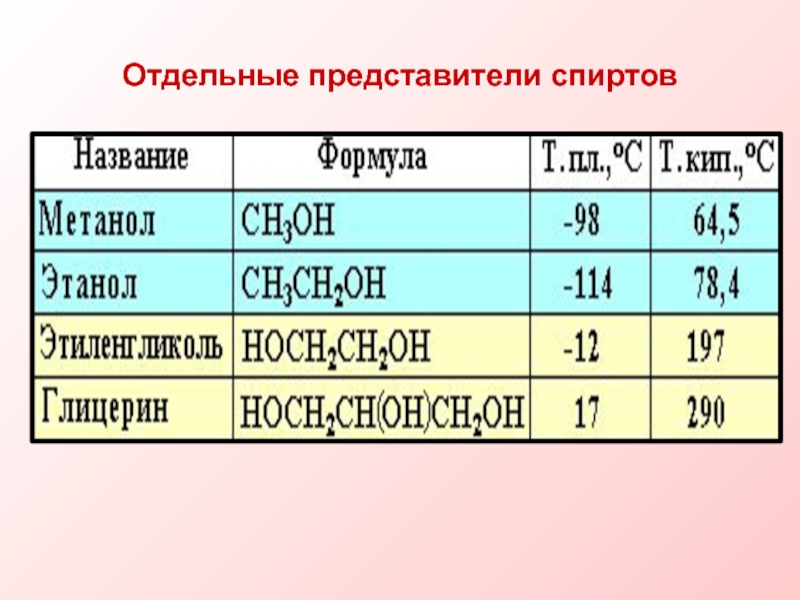
- 13. Отдельные представители спиртов
- 14. Химические свойстваСпирты являются амфотерными соединениями.I По связи
- 15. Реакция этерификации(от лат. ester – эфир) –
- 16. II По связи C – O.Спирты взаимодействуют
- 17. Реакции, идущие по нескольким связям одновременно Реакция
- 18. Взаимодействие спирта с оксидом меди(II)
- 19. Вредное воздействие этанолаИзменения структуры мозга, вызванные многолетней
- 20. Вредное воздействие этанолаАлкоголь крайне неблагоприятно влияет на
- 21. Получение.Общие способы:1) Взаимодействие галогеналканов с растворами щелочей:
- 22. Получение Частные способы.Метанол получают из синтез – газа.
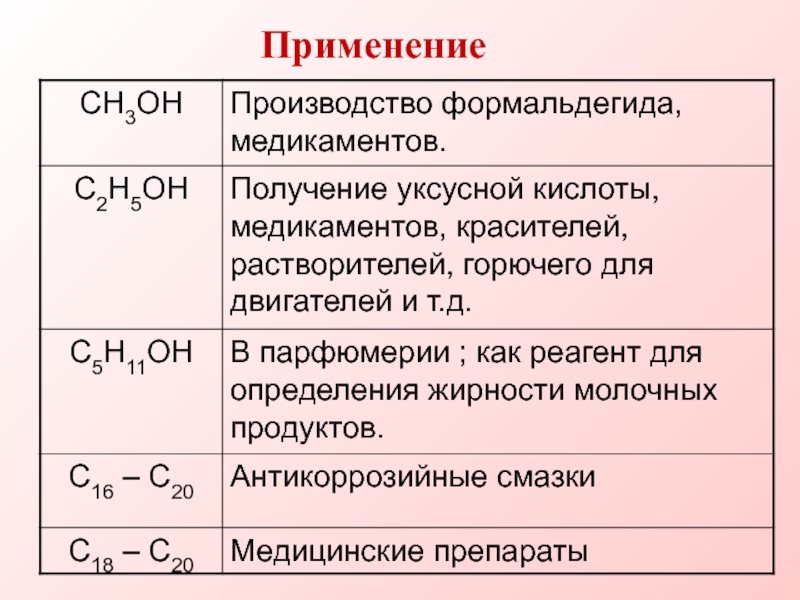
- 23. Применение
- 24. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Определение спиртов
Классификация спиртов
Номенклатура
Изомерия
Физические свойства
Химические свойства
Физиологическое действие спиртов
Применение спиртов
Получение спиртов
Содержание
Слайд 3 Спиртами называются органические вещества, молекулы которых содержат одну или несколько
функциональных гидроксильных групп, соединенных с углеводородным радикалом.
Слайд 4По характеру углеводородного радикала:
СН3СН2ОН
спирты
алифатические
алициклические
ароматические
циклогексанол
бензиловый
спиртэтанол
Слайд 5По числу гидроксильных групп:
СН3 – ОН
метанол
СН2 –
СН – СН2
ОН ОН
ОН глицерин
СН2 – СН2
ОН ОН
этиленгликоль
Слайд 8Названия одноатомных спиртов образуются из названия углеводорода с самой длинной
углеродной цепью, содержащей гидроксильную группу, путём добавления суффикса -ол.
Для
многоатомных спиртов перед суффиксом -ол по-гречески (-ди-, -три-, ...) указывается количество гидроксильных групп.Например: CH3-CH2-OH этанол
Вывод
Слайд 10Физические свойства.
Температура кипения спиртов выше температуры кипения соответствующих углеводородов.
Среди
спиртов нет газов.
С увеличением относительной молекулярной массы спиртов повышаются их
температуры кипения, уменьшается растворимость в воде. Слайд 11Это объясняется наличием межмолекулярной водородной связи, которая может образовываться как
между молекулами спиртов, так и между молекулами спиртов и воды.
R - O RHδ+--- Oδ- H
R – O H Hδ+--- Oδ- H
Слайд 14Химические свойства
Спирты являются амфотерными соединениями.
I По связи O – H.
1)
Взаимодействие со щелочными и щелочно-земельными металлами
2 R – OH +
2 Na2 R – O-Na + H2
алкоголятNa
Алкоголяты легко гидролизуются:
R – ONa + HOH ROH + NaOH
Слайд 15Реакция этерификации(от лат. ester – эфир) – образование сложных эфиров.
O t,H2SO4
R - OH + HO - C – R|
О
H2O + R - O - C – R|
сложный эфир
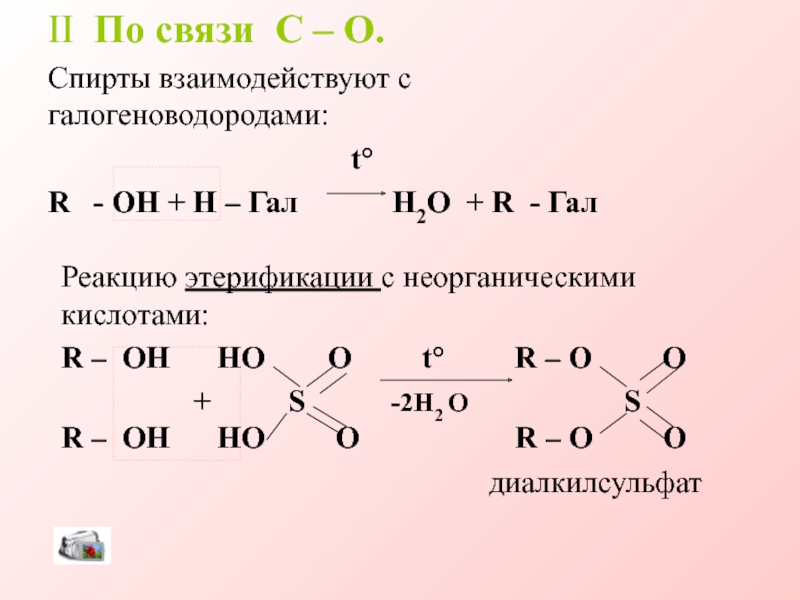
Слайд 16II По связи C – O.
Спирты взаимодействуют с галогеноводородами:
t
R - OH + H – Гал H2O + R - Гал
Реакцию этерификации с неорганическими кислотами:
R – OH HO O t R – O O
+ S -2H2 O S R – OH HO O R – O O
диалкилсульфат
Слайд 17Реакции, идущие по нескольким связям одновременно
Реакция межмолекулярной дегидратации:
H2SO4 (к), t<140
R-OH + HO-R H2O + R- O- R
Простой эфир
Реакция внутримолекулярной дегидратации:
H2SO4 (к), t<140
R - CH - CH - R R - CH = CH - R
OH H -H2O Алкен
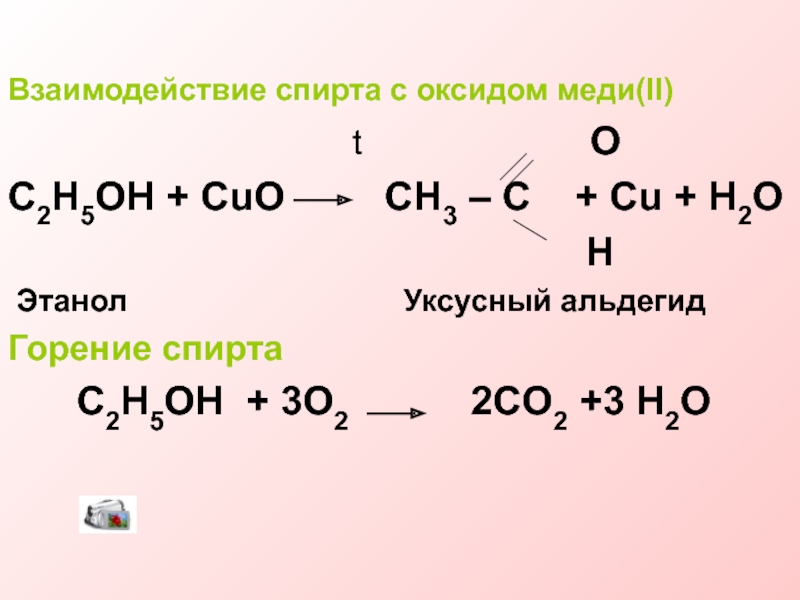
Слайд 18Взаимодействие спирта с оксидом меди(II)
t O
C2H5OH + CuO CH3 – C + Cu + H2O
H
Этанол Уксусный альдегид
Горение спирта
C2H5OH + 3O2 2CO2 +3 H2O
Слайд 19Вредное воздействие этанола
Изменения структуры мозга, вызванные многолетней алкогольной интоксикацией, почти
необратимы, и даже после длительного воздержания от употребления спиртных напитков
они сохраняются. Если же человек не может остановиться, то органические и, следовательно, психические отклонения от нормы идут по нарастающей.Слайд 20Вредное воздействие этанола
Алкоголь крайне неблагоприятно влияет на сосуды головного мозга.
В начале опьянения они расширяются, кровоток в них замедляется, что
приводит к застойным явлениям в головном мозге. Затем, когда в крови помимо алкоголя начинают накапливаться вредные продукты его неполного распада, наступает резкий спазм, сужение сосудов, развиваются такие опасные осложнения, как мозговые инсульты, приводящие к тяжелой инвалидности и даже смерти.Слайд 21Получение.
Общие способы:
1) Взаимодействие галогеналканов с растворами щелочей:
R-Гал + NaOH
R-OH + Na Гал
2) Гидратация
алкенов:H+, t
R - CH=CH – R + HOH R – CH – CH2 – R
ОH 3) Восстановление альдегидов и кетонов:
R t, kat R
C = O + H2 CHOH
R R
Слайд 22Получение
Частные способы.
Метанол получают из синтез – газа.
t,
P, ZnOCO + 2H2 CH3OH
Этанол получают брожением глюкозы.
дрожжи
C6H12O6 2CO2 + 2C2H5OH