Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Мое любимое вещество - магний
Содержание
- 1. Мое любимое вещество - магний
- 2. Миасс 2015Электронное строение атома Электронное строение атома
- 3. Электронное строение атома Mg24Mg+1202e8e2e1s22s22p63s2Краткая электронная запись1s22s22p63s2Порядок заполнения
- 4. Строение простого вещества Металл Связь
- 5. Физические свойства Mg
- 6. Химические свойства Mg2Mg + O2 = 2MgO
- 7. Горение Mg в кислороде 2Mg + O2 = 2MgO2Mg + O2 = 2MgO
- 8. Слайд 8
- 9. Горение Mg в хлореMg + Cl2 = MgCl2
- 10. Вспышка смеси Mg + AgNO3 от капли
- 11. Лабораторная работа: «Горение магния на воздухе» 2Mg + O2 = 2MgO
- 12. МагнийтермияМагнийтермия –
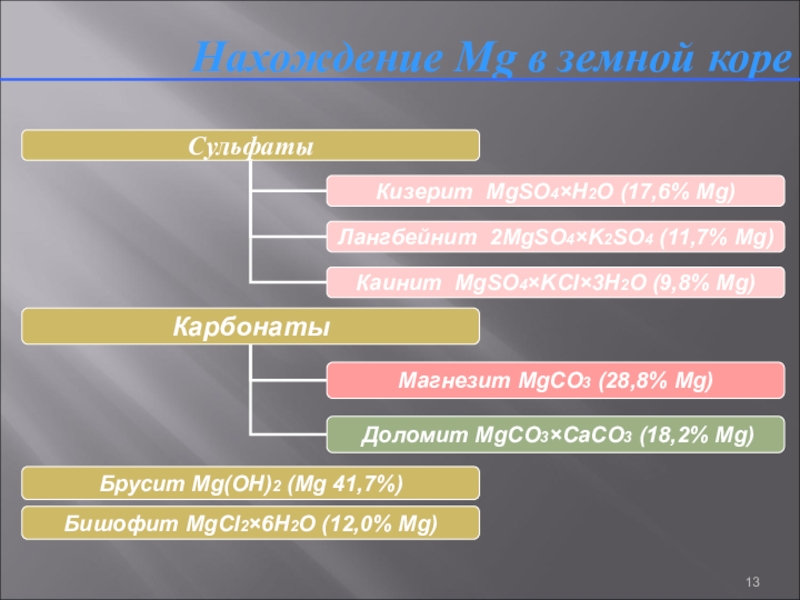
- 13. Нахождение Mg в земной коре
- 14. Получение Mg
- 15. Применение Mg и его сплавов
- 16. Выводы Магний – химический элемент II группы ПСХЭ
- 17. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Миасс 2015
Электронное строение атома Электронное строение атома Mg
Строение простого вещества
Физические
свойства Физические свойства Mg
Химические свойства Химические свойства Mg
Горение Горение Mg
Горение Mg в кислородеГорение Горение Mg Горение Mg в воде
Горение Горение Mg Горение Mg в хлоре
Вспышка смеси Mg + AgNO3 от капли воды
Лабораторная работа: «Горение магния на воздухе»
Магнийтермия
Нахождение Нахождение Mg Нахождение Mg в земной коре
Получение Получение Mg
ПрименениеПрименение Mg Применение Mg и его сплавов
Отзыв
Интернет-ресурсы
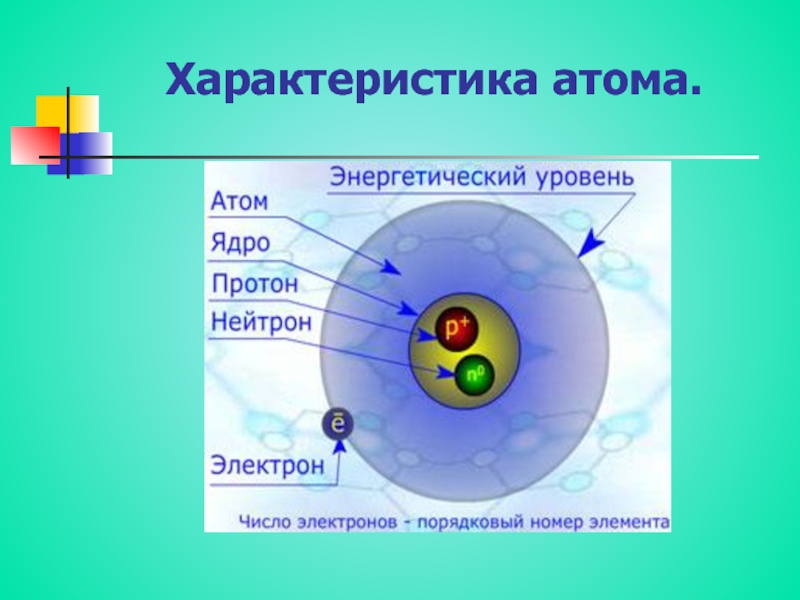
Слайд 3Электронное строение атома Mg
24
Mg
+12
0
2e
8e
2e
1s2
2s2
2p6
3s2
Краткая электронная запись
1s2
2s2
2p6
3s2
Порядок заполнения
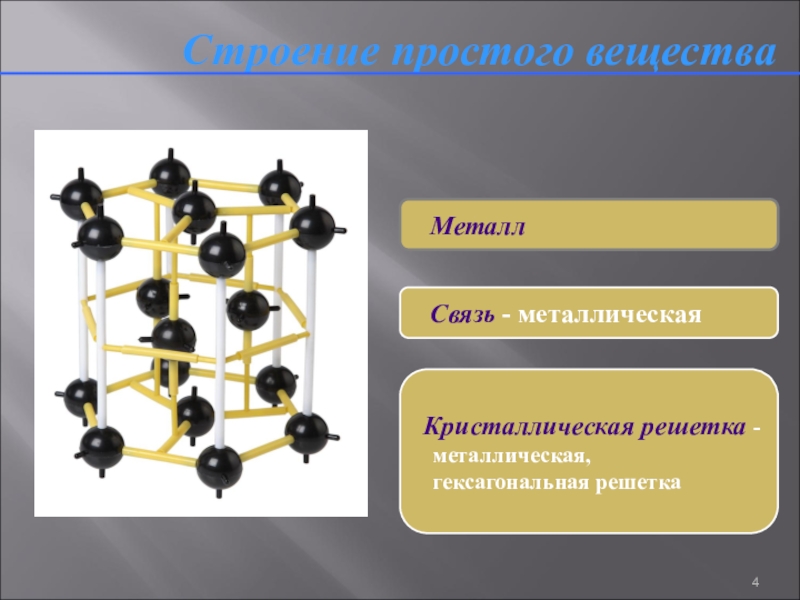
Слайд 4Строение простого вещества
Металл
Связь - металлическая
Кристаллическая
решетка -
металлическая,
гексагональная решетка
Слайд 6Химические свойства Mg
2Mg + O2 = 2MgO
t
Mg
+ S = Mg S
C неметаллами ( кислородом, серой)
Mg+ Cl2
= Mg Cl23Mg + N2 = Mg3N2
C неметаллами ( галогенами, азотом)
Mg + 2H2O = Mg(OH)2 + H2↑
C водой
Mg + 2HCl = Mg Cl2 + H2↑
4Mg+5H2SO4=4MgSO4+H2S+4H2O
C кислотами
4Mg + Fe3O4 = 4MgO + 3Fe
3Mg + Al2O3 = 3Mg O + 2Al
C оксидами металлов
Слайд 8
Горение Mg в воде
Что будет, если тушить магний
водой? На заводе по переработке вторичного сырья в Уолтон Хиллс, штат Огайо возник пожар. В здании было большое количество металлов, среди них титан, сталь и магний. Пожарные, опасаясь, что огонь перекинется на соседнюю бензозаправку решили залить горящее здание водой. Результат не заставил себя ждать - произошел сильный взрыв, во все стороны разлетелись куски раскаленного добела магния. Ослепительный огонь поднялся на высоту 50 м. Однако пожарных это ни чему не научило - они продолжили заливать здание, что вызвало новые взрывы магния. Пожарные вынуждены были отступать под дождем горящего магния. От жара огня начали плавиться стены здания. Единственный способ погасить пожар магния - засыпать металл большим количеством песка, что было в данном случае технически невозможно, но это не повод заливать горящий магний водой. Некомпетентные действия пожарных значительно усугубили масштаб аварии.
Mg + 2H2O = Mg(OH)2 + H2
Слайд 12 Магнийтермия
Магнийтермия – получение металлов восстановлением
оксидов металлов магнием, которое сопровождается выделением значительного количества теплоты.
4Mg+
Fe3O4 = 4MgO + 3Fe3Mg + Al2O3 = 3MgO + 2Al