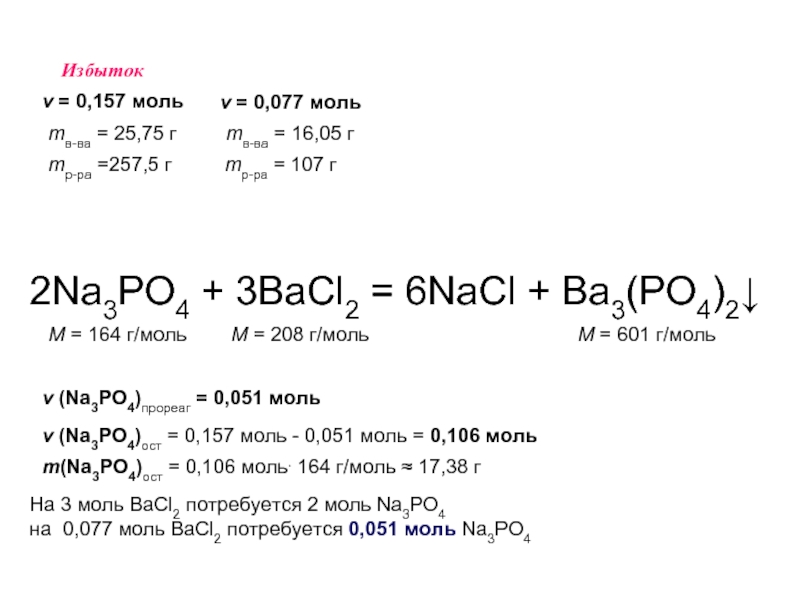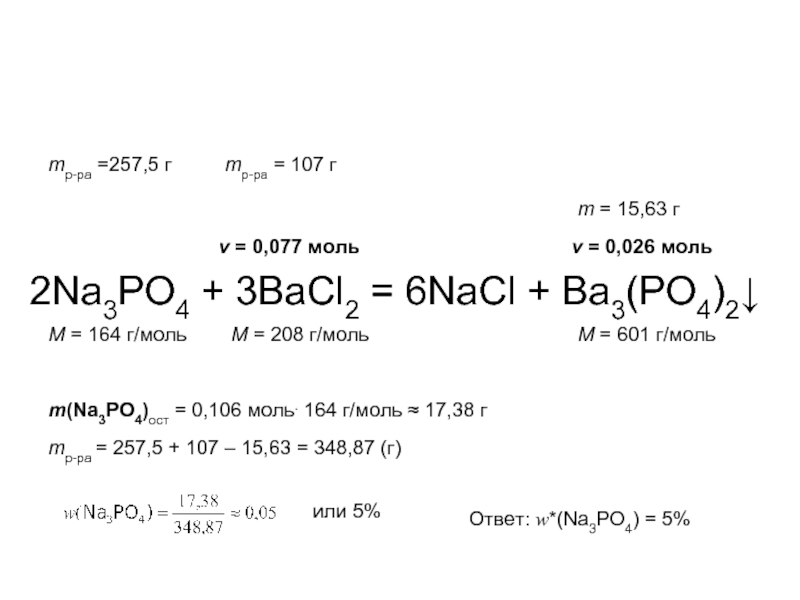100 мл 15%-ного раствора хлорида бария (ρ = 1,07 г/мл).
Определите массовую долю ортофосфата натрия
в образовавшемся растворе.
2Na3PO4 + 3BaCl2 = 6NaCl + Ba3(PO4)2↓
Vр-ра=250 мл
w = 0,1
ρ= 1,03 г/мл
Vр-ра= 100 мл
w = 0,15
ρ= 1,07 г/мл
M = 164 г/моль
M = 208 г/моль
M = 601 г/моль
mр-ра =257,5 г
mв-ва = 25,75 г
ν = 0,157 моль
mр-ра = 107 г
mв-ва = 16,05 г
ν = 0,077 моль
Избыток
На 2 моль Na3PO4 потребуется 3 моль BaCl2
На 0,157 моль ----------------------- x моль BaCl2
x = 0,236 моль
Имеется – 0,077 моль → BaCl2 в недостатке