Слайд 1Тема урока: «Законы
электролиза»
Слайд 2Задачи урока:
1. Обучающие: обеспечить усвоение предметного содержания темы «Законы электролиза»:
- на первом уровне отличать электролиты
от других видов веществ по электропроводности;
- на втором уровне формировать понятие электролитов и их практического применения;
- на третьем уровне сравнивать, анализировать, формировать их физические свойства;
- на четвертом уровне оперировать понятиями темы, применять практические знания для объяснения закона Фарадея;
- на пятом уровне осознанно использовать полученные знания.
Слайд 3Задачи урока:
2. Развивающая. Развитие основных способов мыслительной деятельности (сравнение, сопоставление,
анализ, обобщение). Развивать память, познавательные интересы, самостоятельность в организации труда
с персональным компьютером. Оценить результаты своей работы.
Слайд 4Задачи урока:
3. Воспитательная. Способствовать формированию коммуникативных качеств, трудолюбия, ответственности за
порученное дело.
Слайд 5Методическая цель.
Показать эффективность использования элементов технологии критического мышления.
Слайд 6Тип урока
Комбинированный урок (использование элементов технологии критического мышления)
Слайд 7Изучать, открывать, удивлять,
Верить в силу наук для людей
И природы закон
применять,
Как его применял Фарадей.
Слайд 9Вспомним, что мы знаем об электролитах.
Для этого заполним кластер.
Слайд 13
Проверим ваши знания.
Для этого проведем
физический диктант
Слайд 14Электролиты – это
растворы неорганических солей, кислот, щелочей
растворы органических солей,
кислот, щелочей
Слайд 15
Ответ правильный.
Вы получаете 1 балл.
Слайд 16Ответ неправильный.
Правильный ответ:
Электролиты – это растворы неорганических солей, кислот,
щелочей.
Вы получаете 0 баллов.
Слайд 17Носителями зарядов в электролитах являются
положительные и отрицательные ионы, которые
образуются
вследствие электролитической диссоциации
молекулы входящих в раствор веществ
Слайд 18
Ответ правильный.
Вы получаете 1 балл.
Слайд 19Ответ неправильный.
Правильный ответ:
Носителями зарядов в электролитах являются положительные и
отрицательные ионы, которые образуются вследствие электролитической диссоциации.
Вы получаете 0 баллов.
Слайд 20Электролитическая диссоциация
распад молекул электролитов на ионы
соединение молекул электролитов из ионов
Слайд 21
Ответ правильный.
Вы получаете 1 балл.
Слайд 22Ответ неправильный.
Правильный ответ:
Электролитическая диссоциация - это распад молекул электролитов
на ионы.
Вы получаете 0 баллов.
Слайд 23Рекомбинация – это
процесс, противоположный диссоциации
то же самое, что и
диссоциация
Слайд 24
Ответ правильный.
Вы получаете 1 балл.
Слайд 25Ответ неправильный.
Правильный ответ:
Рекомбинация - это процесс, противоположный диссоциации.
Вы получаете
0 баллов.
Слайд 26Электролиз - это
окислительно-восстановительная реакция, протекающая на
электродах при прохождении
электрического тока через электролит
химическая реакция, протекающая в электролите
при
прохождении электрического тока
Слайд 27
Ответ правильный.
Вы получаете 1 балл.
Слайд 28Ответ неправильный.
Правильный ответ:
Электролиз - это окислительно-восстановительная реакция, протекающая на
электродах при прохождении электрического тока через электролит.
Вы получаете 0 баллов.
Слайд 29Окислительно-восстановительная реакция - это
реакция с изменением степени окисления элементов
физическое
явление с изменением массы элементов
Слайд 30
Ответ правильный.
Вы получаете 1 балл.
Слайд 31Ответ неправильный.
Правильный ответ:
Окислительно-восстановительная реакция - это реакция с изменением
степени окисления элементов.
Вы получаете 0 баллов.
Слайд 32Проводимость электролитов называют
ионной.
молекулярной.
Слайд 33
Ответ правильный.
Вы получаете 1 балл.
Слайд 34Ответ неправильный.
Правильный ответ:
Проводимость электролитов называют ионной.
Вы получаете 0
баллов.
Слайд 35Катод – это
электрод, соединенный с отрицательным полюсом источника
тока.
электрод, соединенный с положительным полюсом источника тока.
Слайд 36
Ответ правильный.
Вы получаете 1 балл.
Слайд 37Ответ неправильный.
Правильный ответ:
Катод – это электрод, соединенный с отрицательным
полюсом источника тока.
Вы получаете 0 баллов.
Слайд 38Анод – это
электрод, соединенный с отрицательным полюсом источника
тока.
электрод, соединенный с положительным полюсом источника тока.
Слайд 39
Ответ правильный.
Вы получаете 1 балл.
Слайд 40Ответ неправильный.
Правильный ответ:
Анод – это электрод, соединенный с положительным
полюсом источника тока.
Вы получаете 0 баллов.
Слайд 41Электролиз применяют
для получения солей различных элементов и их
растворов.
для получения металлов (меди, алюминия) электролитическим
способом, в гальванопластике и
др.
Слайд 42
Ответ правильный.
Вы получаете 1 балл.
Слайд 43Ответ неправильный.
Правильный ответ:
Электролиз применяют для получения металлов (меди, алюминия)
электролитическим способом, в гальванопластике и др.
Вы получаете 0 баллов.
Слайд 44Посчитайте свои баллы и сообщите учителю.
Слайд 46Фаза осмысления
Продолжаем нашу работу.
Следующая фаза осмысления.
Попробуем установить основные
закономерности протекания электрического тока в растворах электролитов.
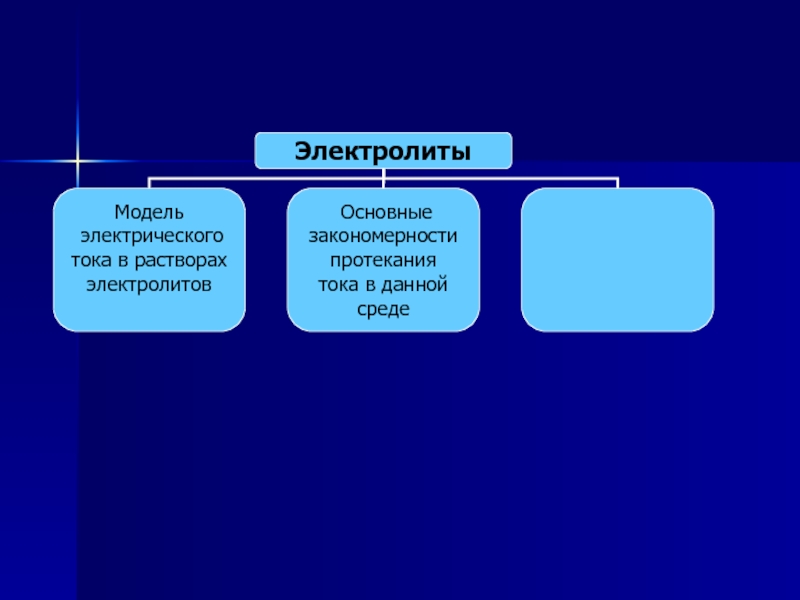
Слайд 47Основные закономерности протекания электрического тока в растворах электролитов
Зависимость силы тока
от напряжения I (U)
Зависимость силы тока от температуры I (t)
Зависимость
массы вещества, выделившегося
на катоде, от силы тока m (I)
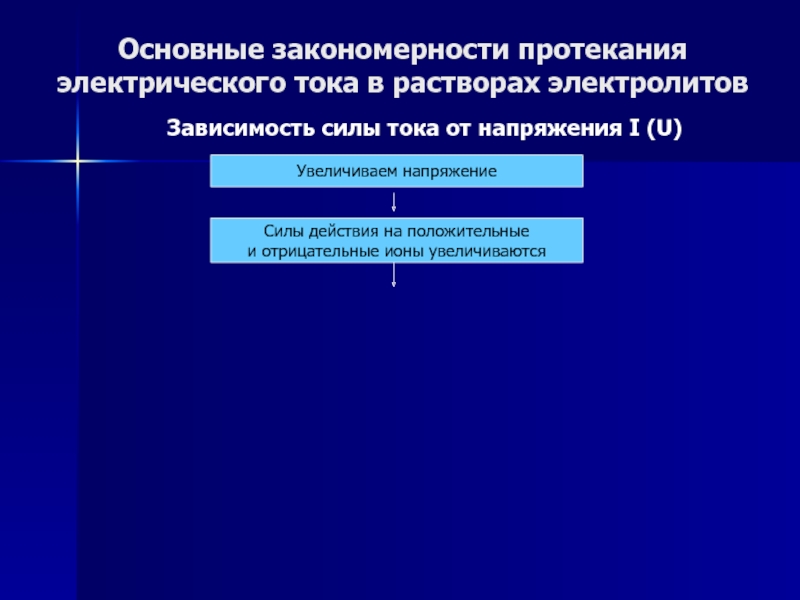
Слайд 48Основные закономерности протекания электрического тока в растворах электролитов
Зависимость силы тока
от напряжения I (U)
Увеличиваем напряжение
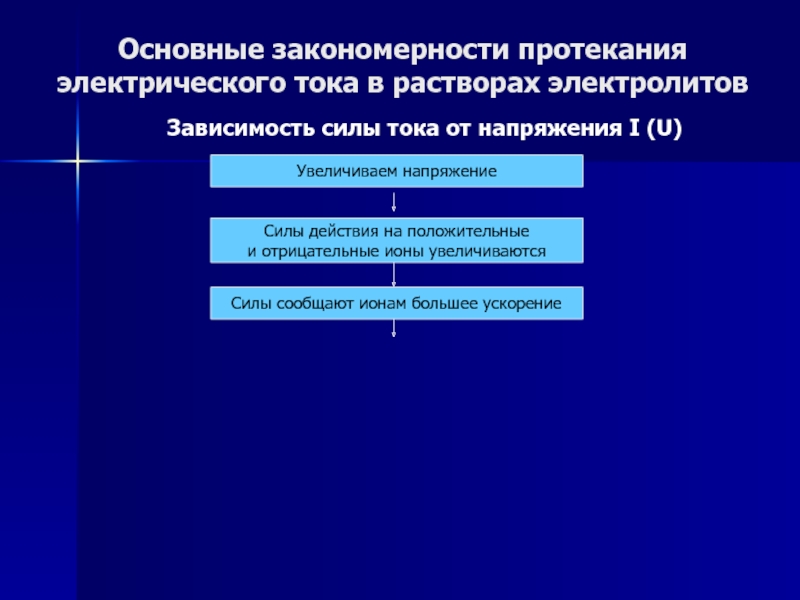
Слайд 49Основные закономерности протекания электрического тока в растворах электролитов
Зависимость силы тока
от напряжения I (U)
Увеличиваем напряжение
Силы действия на положительные
и отрицательные
ионы увеличиваются
Слайд 50Основные закономерности протекания электрического тока в растворах электролитов
Зависимость силы тока
от напряжения I (U)
Увеличиваем напряжение
Силы действия на положительные
и отрицательные
ионы увеличиваются
Силы сообщают ионам большее ускорение
Слайд 51Основные закономерности протекания электрического тока в растворах электролитов
Зависимость силы тока
от напряжения I (U)
Увеличиваем напряжение
Силы действия на положительные
и отрицательные
ионы увеличиваются
Силы сообщают ионам большее ускорение
Скорость направленного движения носителей
заряда увеличивается
Слайд 52Основные закономерности протекания электрического тока в растворах электролитов
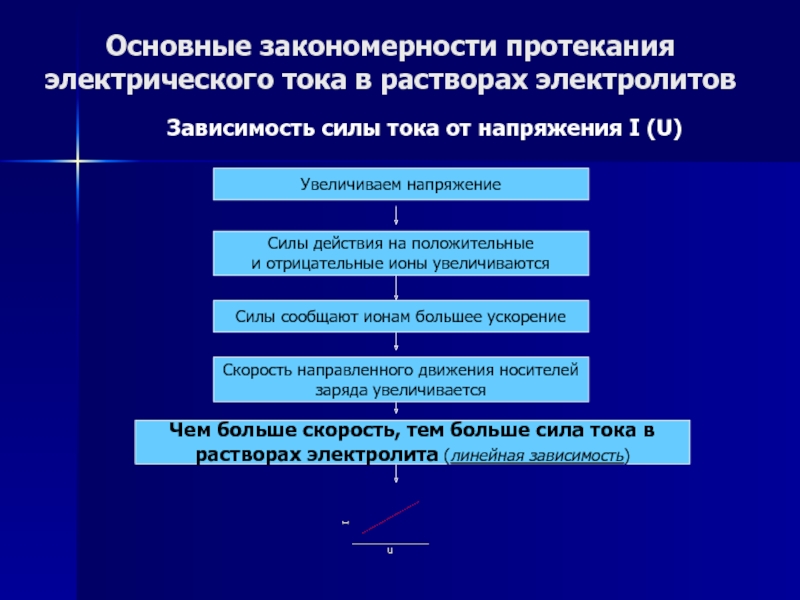
Зависимость силы тока
от напряжения I (U)
Увеличиваем напряжение
Силы действия на положительные
и отрицательные
ионы увеличиваются
Силы сообщают ионам большее ускорение
Скорость направленного движения носителей
заряда увеличивается
Чем больше скорость, тем больше сила тока в
растворах электролита (линейная зависимость)
Слайд 53Основные закономерности протекания электрического тока в растворах электролитов
Зависимость силы тока
от температуры I (t)
Мысленно нагреем раствор электролита, через который протекает
электрический ток (U – constant)
Процесс электролитической диссоциации
пойдет быстрее
Слайд 54Основные закономерности протекания электрического тока в растворах электролитов
Зависимость силы тока
от температуры I (t)
Мысленно нагреем раствор электролита, через который протекает
электрический ток (U – constant)
Процесс электролитической диссоциации
пойдет быстрее
в результате число положительных и
отрицательных ионов увеличится
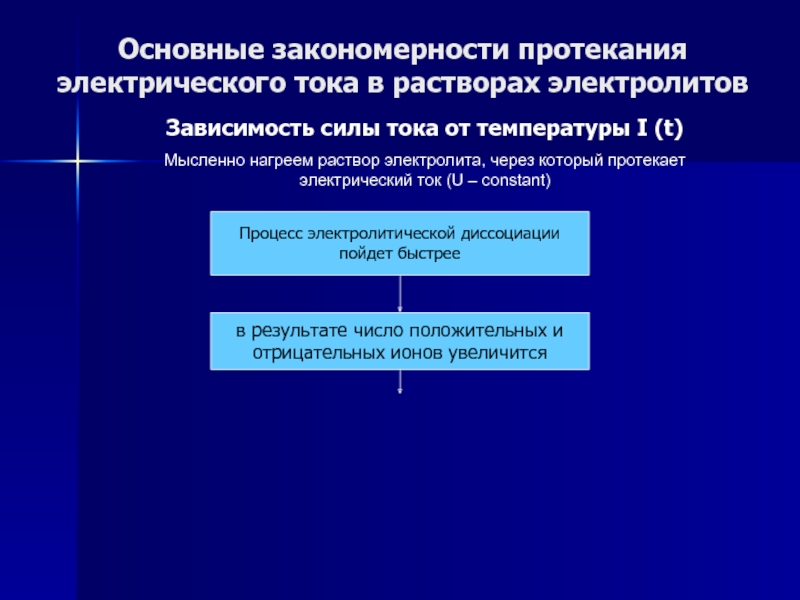
Слайд 55Основные закономерности протекания электрического тока в растворах электролитов
Зависимость силы тока
от температуры I (t)
Мысленно нагреем раствор электролита, через который протекает
электрический ток (U – constant)
Процесс электролитической диссоциации
пойдет быстрее
в результате число положительных и
отрицательных ионов увеличится
Заряд переносится большим числом частиц.
Следовательно, при нагревании
сила тока увеличится
Слайд 56Основные закономерности протекания электрического тока в растворах электролитов
Зависимость массы вещества,
выделившегося на катоде, от силы тока m (I)
Мысленно увеличим
силу тока в растворе электролита ( t – constant)
При увеличении силы тока увеличивается
скорость заряженных частиц
Слайд 57Основные закономерности протекания электрического тока в растворах электролитов
Зависимость массы вещества,
выделившегося на катоде, от силы тока m (I)
Мысленно увеличим
силу тока в растворе электролита ( t – constant)
При увеличении силы тока увеличивается
скорость заряженных частиц
При увеличении скорости движения катионов
за определенный промежуток времени большее
их количество достигнет катода
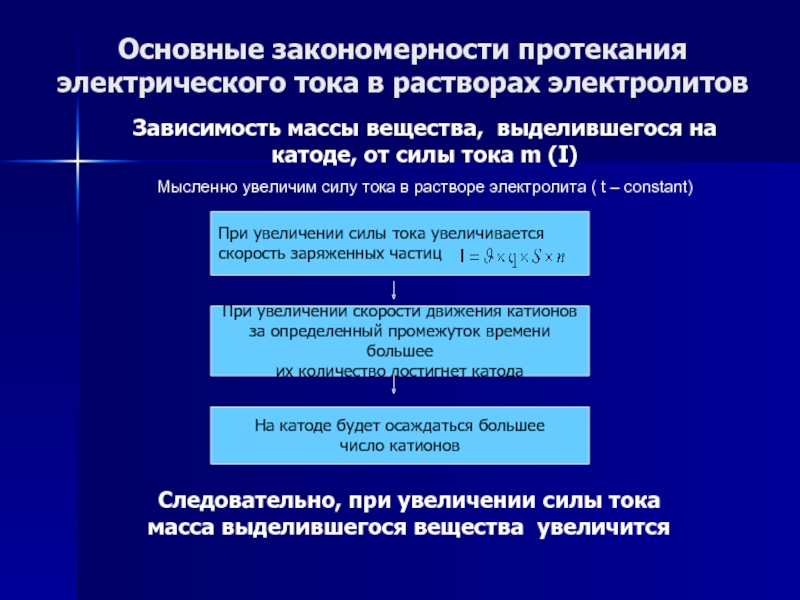
Слайд 58Основные закономерности протекания электрического тока в растворах электролитов
Зависимость массы вещества,
выделившегося на катоде, от силы тока m (I)
Мысленно увеличим
силу тока в растворе электролита ( t – constant)
При увеличении силы тока увеличивается
скорость заряженных частиц
При увеличении скорости движения катионов
за определенный промежуток времени большее
их количество достигнет катода
На катоде будет осаждаться большее
число катионов
Следовательно, при увеличении силы тока масса выделившегося вещества увеличится
Слайд 59Повторим основные закономерности протекания электрического тока в растворах электролитов.
Слайд 60Основные закономерности протекания электрического тока в растворах электролитов
Зависимость силы тока
от напряжения I (U)
Увеличиваем напряжение
Силы действия на положительные
и отрицательные
ионы увеличиваются
Силы сообщают ионам большее ускорение
Скорость направленного движения носителей
заряда увеличивается
Чем больше скорость, тем больше сила тока в
растворах электролита (линейная зависимость)
Слайд 61Основные закономерности протекания электрического тока в растворах электролитов
Зависимость силы тока
от температуры I (t)
Мысленно нагреем раствор электролита, через который протекает
электрический ток (U – constant)
Процесс электролитической диссоциации
пойдет быстрее
в результате число положительных и
отрицательных ионов увеличится
Заряд переносится большим числом частиц.
Следовательно, при нагревании
сила тока увеличится
Слайд 62Основные закономерности протекания электрического тока в растворах электролитов
Зависимость массы вещества,
выделившегося на катоде, от силы тока m (I)
Мысленно увеличим
силу тока в растворе электролита ( t – constant)
При увеличении силы тока увеличивается
скорость заряженных частиц
При увеличении скорости движения катионов
за определенный промежуток времени большее
их количество достигнет катода
На катоде будет осаждаться большее
число катионов
Следовательно, при увеличении силы тока масса выделившегося вещества увеличится
Слайд 63Итог по фазе осмысления.
«Фишбон»
Слайд 64Фаза осмысления
(продолжение)
Зная механизм проводимости электролитов можно определить массу вещества, выделившегося
при электролизе. Чтобы решить эту задачу, необходимо получить и изучить
законы Фарадея.
Слайд 65Самостоятельная работа с учебником
I закон Фарадея.
Алгоритм.
Слайд 661. Запишите формулу массы вещества
m0 – масса атома
N – число
ионов
Слайд 672. Свяжите массу атома с молярной массой.
тогда
(1)
Слайд 683. Находим N – число ионов, проходящих через раствор электролитов.
а)
Каждый одновалентный ион несет заряд, равный заряду электрона e. Если
валентность равна n, кратный ему заряд равен ne.
б) Все количество электричества, переносимое N – ионами, равно
отсюда
в) Подставим значение N в выражение (1), получим
(2) (объединенный закон Фарадея)
Слайд 693. Находим N – число ионов, проходящих через раствор электролитов.
г)
так как в выражении (2) правой части все физические величины,
кроме q, постоянны, формулу (2) записываем
где
д) Так как q=It, записываем I закон Фарадея – масса вещества, выделившегося на электроде при электролизе, пропорциональна количеству электричества, прошедшего через раствор (или расплав) электролита.
Слайд 704. Электрохимический эквивалент
Физический смысл электрохимического эквивалента к
– это масса вещества в кг, выделившаяся при прохождении через
электролит 1 кулона электричества.
Слайд 71Самостоятельная работа с учебником
II закон Фарадея.
Алгоритм.
Слайд 721. Дайте определение химического эквивалента.
Химический эквивалент - это отношение атомной
(А) массы вещества к его валентности (n)
Слайд 732. Запишите второй закон Фарадея.
Второй закон Фарадея: электрохимический эквивалент
пропорционален химическому эквиваленту данного вещества.
где А – атомная масса вещества
n – валентность
- коэффициент пропорциональности, который имеет одно и то же значение для всех веществ
F – постоянная Фарадея
Слайд 743. Дайте определение постоянной Фарадея.
Постоянная Фарадея F – численно равна
заряду, который должен пройти через электролит для выделения на электроде
количества вещества, равного его химическому эквиваленту.
Слайд 75Итог по фазе осмысления.
«Фишбон»
Слайд 76Фаза практического осмысления
(работа с дополнительной литературой)
Законы Фарадея нашли практическое применение
в науке и технике, в частности для определения заряда одновалентного
иона.
Благодаря законам Фарадея Германом Людвигом Фердинандом Гельмгольцем (1821 – 1894) еще в 1881 году был сделан вывод о существовании в природе элементарного электрического заряда. В дальнейшем на основании законов Фарадея установлено, что заряд одновалентного иона представляет собой наименьшее (элементарное) количество электричества, существующее в природе. Любой электрический заряд состоит из целого числа элементарных зарядов и имеет дискретный характер. Зная постоянную Фарадея F и постоянную Авогадро NA был вычислен заряд одновалентного иона, т.е. заряд электрона
Слайд 77Мозговая атака
(мысли по кругу)
Как решать задачи, используя законы электролиза (памятка).
1.
Для электролитов справедлив закон Ома.
2. Сила тока в электролите равна
силе тока в проводящих проводах.
3. Если в задаче рассматривается выделение газа при электролизе, его массу определим из уравнения Менделеева - Клапейрона .
Слайд 78Мозговая атака
(мысли по кругу)
Последовательность решения задач.
1. Установить сущность процесса, связанного
с прохождением электрического тока через электролит.
2. Записать уравнения законов Фарадея.
3.
Записать дополнительные формулы.
4. Решить систему уравнений и найти искомую величину.
5. Проанализируйте результат и сформулируйте ответ.
Слайд 79Фаза практического осмысления
(работа с дополнительной литературой)
Применение законов Фарадея при решении
качественных и количественных задач.
Задача:
Электролиз воды ведется при токе I=2,5А. В
течение одного часа получен объем V=0,5 л кислорода под давлением p=1,3x105 Па. Найдите температуру кислорода.
Решение:
I=2,5A
t=1ч=3600с
V=0,5л=0,5x10-3м3
p=1,3x105Па
T – ?
АО2=16x10-3 кг/моль
nO2=2
Слайд 80Рефлексия
Подведем итоги урока.
Перед вами Фарадеево дерево, где можно проследить процесс
восхождения на него. Определите уровень усвоения знаний.
Электролиты
Электролиз
Ионная проводимость
Механизм электропроводности
Зависимость I
(U)
Зависимость m (I)
Зависимость I (T)
Фарадеево дерево
I закон Фарадея
II закон Фарадея
Практическое применение
Слайд 81Рефлексия
Подведем итоги урока.
Электролиты
Электролиз
Ионная проводимость
Механизм электропроводности
Зависимость I (U)
Зависимость m (I)
Зависимость I
(T)
Фарадеево дерево
I закон Фарадея
II закон Фарадея
Практическое применение
Слайд 82Рефлексия
Подведем итоги урока.
Электролиты
Электролиз
Ионная проводимость
Механизм электропроводности
Зависимость I (U)
Зависимость m (I)
Зависимость I
(T)
Фарадеево дерево
I закон Фарадея
II закон Фарадея
Практическое применение
Слайд 83Рефлексия
Подведем итоги урока.
Электролиты
Электролиз
Ионная проводимость
Механизм электропроводности
Зависимость I (U)
Зависимость m (I)
Зависимость I
(T)
Фарадеево дерево
I закон Фарадея
II закон Фарадея
Практическое применение
Слайд 84Рефлексия
Подведем итоги урока.
Электролиты
Электролиз
Ионная проводимость
Механизм электропроводности
Зависимость I (U)
Зависимость m (I)
Зависимость I
(T)
Фарадеево дерево
I закон Фарадея
II закон Фарадея
Практическое применение
Слайд 85Рефлексия
Подведем итоги урока.
Электролиты
Электролиз
Ионная проводимость
Механизм электропроводности
Зависимость I (U)
Зависимость m (I)
Зависимость I
(T)
Фарадеево дерево
I закон Фарадея
II закон Фарадея
Практическое применение