Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
12-лек-РАВ.ppt
Содержание
- 1. 12-лек-РАВ.ppt
- 2. Динамическое равновесиереакция aA + bB
- 3. 6.1 Константа равновесияKX - концентрации задаются мольными
- 4. 6.2 Равновесный состав газовой смеси1. Расчет К0(Т)Т
- 5. Пример.
- 6. 6.3 Равновесие в растворах
- 7. Электролитическая диссоциацияС0α →1 КД → ∞
- 8. 6. 4 Диссоциация водыH2O ⇔ H+ +
- 9. Водородный показательpH = –lg[H+]Нейтральная среда pH
- 10. 6.5 Растворы кислот и основанийМеOH ⇔ Ме+
- 11. Многоосновные кислоты и основания H2An ⇔ H+
- 12. Скачать презентанцию
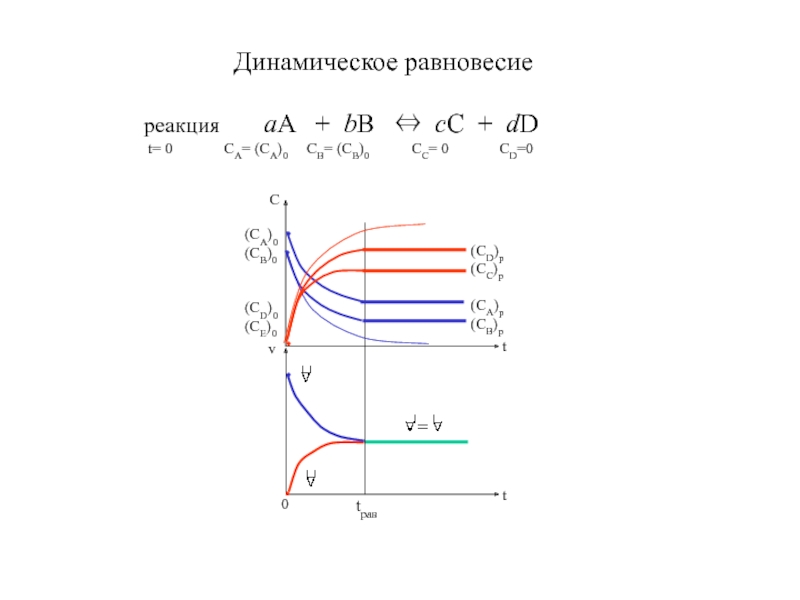
Динамическое равновесиереакция aA + bB ⇔ cC + dD t= 0 CA= (CA)0 CB= (CB)0 CC= 0 CD=0
Слайды и текст этой презентации
Слайд 16. Химическое равновесие
Термодинамические параметры: T; P; νi; Сi – const
1.
Термодинамическое условие равновесия - ΔrG = 0
bB ⇔ cC + dDСлайд 36.1 Константа равновесия
KX - концентрации задаются мольными долями (безразмерная величина)
Kp
- концентрации задаются парциальными давлениями - (Па)Δν
Δν = (c +
d) - (a + b)KC – концентрации задаются молярной концентрацией - (моль/л)Δν
р0 = 1,013⋅105 Па
Слайд 46.2 Равновесный состав газовой смеси
1. Расчет К0(Т)
Т → ΔrG0(T)=ΔrH0(T) –Т·ΔrS0(T)
→
КX → Xi при Р -const
Кр → рi - при V - const
2. Расчет КX или Кр
Слайд 86. 4 Диссоциация воды
H2O ⇔ H+ + OH-
Нейтральная среда
[H+] = [OH–] = 10-7 [моль/л]
Кислая среда
[H+] > 10-7 [OH–] <10-7 [моль/л]Щелочная среда [H+] < 10-7 [OH–] > 10-7 [моль/л]
Слайд 9Водородный показатель
pH = –lg[H+]
Нейтральная среда pH = 7
Кислая среда
pH < 7
Щелочная среда
pH > 7pОH = –lg[ОH–]
pH + pОH = 14
Слайд 106.5 Растворы кислот и оснований
МеOH ⇔ Ме+ + OH-
α →0
α
→1
рН = –lg[α⋅Скисл]
pH = 14 + lg[α⋅Cосн]
HAn ⇔ H+ +
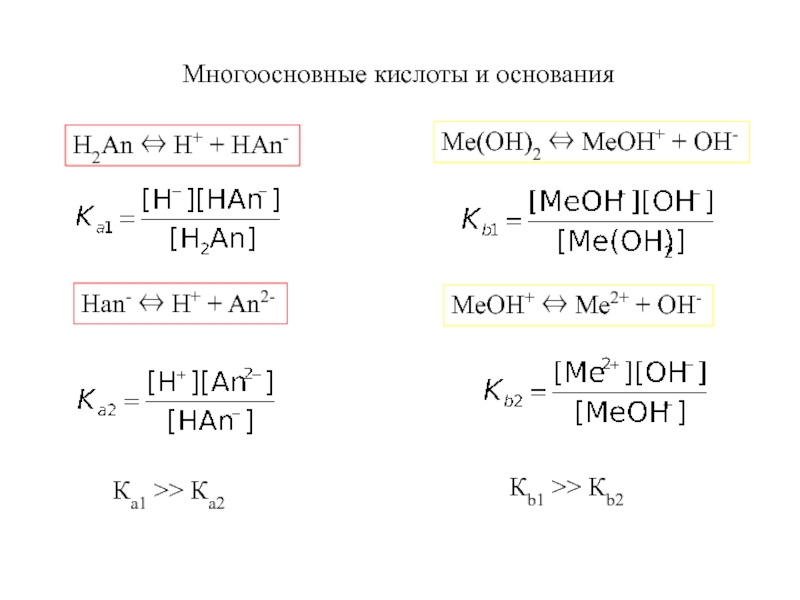
An-Слайд 11Многоосновные кислоты и основания
H2An ⇔ H+ + НAn-
Han- ⇔
H+ + An2-
Ка1 >> Ка2
Ме(OH)2 ⇔ МеOH+ + OH-
МеOH+ ⇔
Ме2+ + OH-Кb1 >> Кb2






![12-лек-РАВ.ppt 6. 4 Диссоциация водыH2O ⇔ H+ + OH-Нейтральная среда [H+] = 6. 4 Диссоциация водыH2O ⇔ H+ + OH-Нейтральная среда [H+] = [OH–] = 10-7 [моль/л]Кислая среда](/img/thumbs/b11937fd468a25f7f8bd19ee17e70671-800x.jpg)
![12-лек-РАВ.ppt Водородный показательpH = –lg[H+]Нейтральная среда pH = 7Кислая среда Водородный показательpH = –lg[H+]Нейтральная среда pH = 7Кислая среда pH <](/img/tmb/2/150627/e3a60dc08e2f13feda433167a719f2c9-800x.jpg)
![12-лек-РАВ.ppt 6.5 Растворы кислот и основанийМеOH ⇔ Ме+ + OH-α →0α →1рН 6.5 Растворы кислот и основанийМеOH ⇔ Ме+ + OH-α →0α →1рН = –lg[α⋅Скисл]pH = 14 + lg[α⋅Cосн]HAn](/img/thumbs/746a13e60c1677150635fdb771462010-800x.jpg)