Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь.ppt
Содержание
- 1. Химическая связь.ppt
- 2. Химическая связь - это различные виды взаимодействия,
- 3. Основные черты химической связи:А) снижение общей энергии
- 4. Ковалентная связь. Механизм образования ковалентной связи в
- 5. По закону Гесса то же количество выделится
- 6. Взаимодействие атомов водорода происходит или на стенках
- 7. Поэтому добавление инертных газов ускоряет процесс:
- 8. Объединяются атомы только с противоположными спинами. На
- 9. Проникновение электронных облаков взаимодействующих атомов друг в
- 10. Изменение потенциальной энергии Е системы из двух
- 11. Льюис предположил: устойчивые внешние электронные конфигурации у
- 12. Правило октета: стремление к созданию устойчивой электронной
- 13. Энергия и длина связи Энергия выделяющаяся при
- 14. С уменьшением длины связи энергия связи растёт и соответственно, устойчивость молекул увеличивается.
- 15. Метод валентных связей (ВС)1) Химическая связь между
- 16. 3) В соответствии с принципом Паули химическая
- 17. При сближении атомов с антипараллельными спинами происходит
- 18. В образовании химической связи участвуют электроны внешней
- 19. В рассмотренных соединениях используется правило октета.Ковалентная связь
- 20. При образовании связи изменения претерпевает электронная структура
- 21. Механизм образования ковалентной связи Обменный механизм: каждый
- 22. Образование молекулы Н2ОАтом кислорода имеет два неспаренных
- 23. 2) Донорно-акцепторный механизм:Механизм образования ковалентной связи за
- 24. Характеристики ковалентной связиПолярность. Связь осуществляется двумя одинаковыми
- 25. Способность атома перетягивать на себя область перекрывания
- 26. Два атома А и В образуют молекулу
- 27. Образование молекулы А+В- можно разбить на две
- 28. В сумме энергетические изменения составляет:ΔНиониз.А -ΔНсрод.В Для
- 29. Неравенство можно переписать в виде: ΔНиониз.В +ΔНсрод.В> ΔНиониз.А +ΔНсрод. А ΔНиониз+ΔНсрод-электроотрицательность
- 30. Электроотрицательность позволяет сравнивать атомы по их способности
- 31. Электрический момент диполя μм - равен векторной
- 32. = ql1-расстояние между центрами положительных и отрицательных зарядов. Единица измерения - D - дебай
- 33. Дипольный момент, приходящийся на связь, рассматривают как
- 34. Дипольный момент многоатомной молекулы можно считать равным
- 35. Синтезировали дихлорбензол С6Н4С12 с дипольным моментом μ,
- 36. Необходимо учитывать природу многоатомных заместителей в молекуле.
- 37. Эффективные заряды.Эффективные заряды (δ) - (в единицах
- 38. Значения эффективных зарядов в подгруппе уменьшаются, например:
- 39. Поляризуемость, (α) - способность молекулы становиться полярной
- 40. Насыщаемость.Насыщаемость-невозможность присоединения других атомов к атому, у
- 41. Валентность - число связей, которые данный атом
- 42. Например, углерод в основном состоянии имеет структуру:
- 43. При возбуждении атома – происходит разъединение 2s
- 44. Суммарная валентность равна числу неспаренных электронов (обменный механизм) плюс число связей, образованных по донорно-акцепторному механизму.
- 45. Направленность.Атомные орбитали пространственно ориентированы, и перекрывание электронных
- 46. Может возникать при перекрывании орбиталей s -
- 47. Связь, образованная перекрыванием АО по обе стороны
- 48. Число связей между атомами называется кратностью связи.
- 49. Строение бензола является промежуточным между: Правильно записывать
- 50. Для более точного решения вводятся ещё 3
- 51. Гибридизация атомных орбиталейРассмотрим атом углерода 1s22s22p2.В возбуждённом
- 52. Гибридизация – это изменение формы атомной орбитали
- 53. Волновая функция гибридной орбитали: ψгибрид =аψs +bψр(х)+сψр(у)
- 54. Условия устойчивости гибридизации:1) По сравнению с исходными
- 55. Виды гибридизации sр – составлены из одной
- 56. sр2- составлены из одной s и двух
- 57. sp3 - составлены из одной s и
- 58. Пространственная структура молекул Двухатомные молекулы всегда линейны.Геометрия
- 59. Состояние sp3-гибридизации - угловая структура Пример: В
- 60. Четырехатомные молекулы имеют два типа структур Плоская
- 61. Тяжелые элементы, из-за рыхлой структуры электронных оболочек
- 62. В молекулах СН4, NН3, Н2О углерод,
- 63. Гибридизация с участием d – орбиталей Конфигурации
- 64. Недостатки метода валентных связейПостулируется участие в образовании
- 65. Атом кислорода имеет два неспаренных электрона.На основании
- 66. Метод молекулярных орбиталей (МО)В многоатомных системах (молекулах,
- 67. 3) В результате атомные орбитали трансформируются в
- 68. Молекулярная орбиталь (МО) – волновая функция, которая
- 69. Метод ЛКАО Волновая функция электрона в молекуле
- 70. Перекрывание атомных орбиталей ψа и ψв соответствует
- 71. Если спины электронов атомных орбиталей параллельны, то
- 72. При сложении, электронная плотность в области между
- 73. При вычитании электронная плотность между ядрами равна
- 74. Образование связывающей и разрыхляющей молекулярной орбитали из атомных s-орбиталей.
- 75. Две атомные s – орбитали дают две
- 76. При комбинации 2рх атомный орбиталей образуются две
- 77. При комбинации двух ру и двух рz
- 78. У связывающих МО электронная плотность сосредоточена между
- 79. σр(х) связывание сильнее πр(у) и πр(z) связывания,
- 80. Поэтому уровень σсв2р(х) перемещен несколько выше уровней
- 81. Порядок заполнения МОσsсв(1s)
- 82. Значения констант Nсв и Nразр определяют из
- 83. Приближенные молекулярные орбитали для Н2+ имеют вид:
- 84. Кулоновские интегралы – это энергия, необходимая для
- 85. Порядок связи = (Nесв - Nераз) /
- 86. Второй электрон поступит на ту же орбиталь
- 87. Молекула Не2 должна была бы содержать 4
- 88. Схема образования молекулярных орбиталей у двухатомных молекул второго периода
- 89. По мере заполнения связывающих МО прочность связи
- 90. Если два электрона находятся на одной орбитали,
- 91. Для разноименных атомов учитывается I.Чем выше I
- 92. Построение МО для молекул с гибридизациейВ молекуле
- 93. Достоинства метода МО: более универсален, позволяет объяснить
- 94. Общие черты ММО и МВС1) они дают
- 95. Ионная связь Теория ионной связи:самой устойчивой электронной
- 96. Атомы, отдавшие часть электронов, приобретают положительный заряд
- 97. Схема образования NaC1Электронная конфигурация натрия 1S22S22Р63S1.Легко отдает
- 98. Связь, которая образуется за счёт электростатического взаимодействия
- 99. Энергия ионной связи Сила притяжения между недеформированными
- 100. Ионная связь, характеризуется:ненаправленностью, т.к. ионы можно представить,
- 101. Поляризация иона - это относительное смещение ядра
- 102. Различают поляризуемость и поляризующую силу.Поляризуемость ионов -
- 103. Поляризующая сила иона – это способность деформировать,
- 104. Поляризационные свойства катионов одинакового заряда и радиуса
- 105. Поляризация ионов влияет на свойства соединений:понижает температуры
- 106. Металлическая связьОтличие свойств металлов от других веществ:
- 107. Металлическая связь – это связь, в которой
- 108. Межмолекулярные взаимодейсвияВан-дер-ваальсовы силы. Емм = Еор +
- 109. Индукционное взаимодействие Е инд. = -2αμ2/r6. Индукционное
- 110. Дисперсионное взаимодействие hν0/2–энергия колебаний атомов при 0К
- 111. Слайд 111
- 112. Ван-дер-ваальсовы силы действуют между молекулами лишь при
- 113. Донорно-акцепторное взаимодействие Если одна из молекул имеет
- 114. Водородная связь Химическая связь, образованная положительно поляризованным
- 115. Если водородная связь образуется между разными молекулами,
- 116. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Химическая связь - это различные виды взаимодействия, обуславливающие устойчивое существование
двух- и многоатомных соединений.
электронных оболочек атомов, вступивших в контакт друг с другом.Слайд 3Основные черты химической связи:
А) снижение общей энергии многоатомной системы по
сравнению с суммарной энергией изолированных частиц, из которых эта система
образована.Б) Перераспределение электронной плотности в области связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
Слайд 4Ковалентная связь.
Механизм образования ковалентной связи в молекуле Н2:
Н+ Н
= Н2; ΔН = - 436 кДж/моль
Энергия связи молекулы водорода
равна 436кДж/моль. Это количество энергии, которое нужно затратить на разрыв 1 моля молекул водорода.
Слайд 5По закону Гесса то же количество выделится при взаимодействии двух
атомов водорода.
Следовательно, система, состоящая из отдельных атомов водорода, неустойчива
по сравнению с системой из тех же атомов, но объединенных в молекулу.Слайд 6Взаимодействие атомов водорода происходит или на стенках сосуда или в
присутствии других молекул, иначе молекула не образуется, поскольку выделяющаяся энергия
связи остается на образовавшейся молекуле.Образуется возбужденная молекула, которая неустойчива и снова распадается на атомы:
Н(г) + Н(г) = Н2возб(г) = Н(г) + Н(г)
Слайд 7Поэтому добавление инертных газов ускоряет процесс:
Н(г)
+ Н(г) + М = Н2(г) + М*
Из уравнения
видно, что эта реакция - реакция третьего порядка:V=kС2(Н2)С(М);
М –молекула газа.
Следовательно, скорость этой реакции прямо пропорциональна концентрации посторонних молекул.
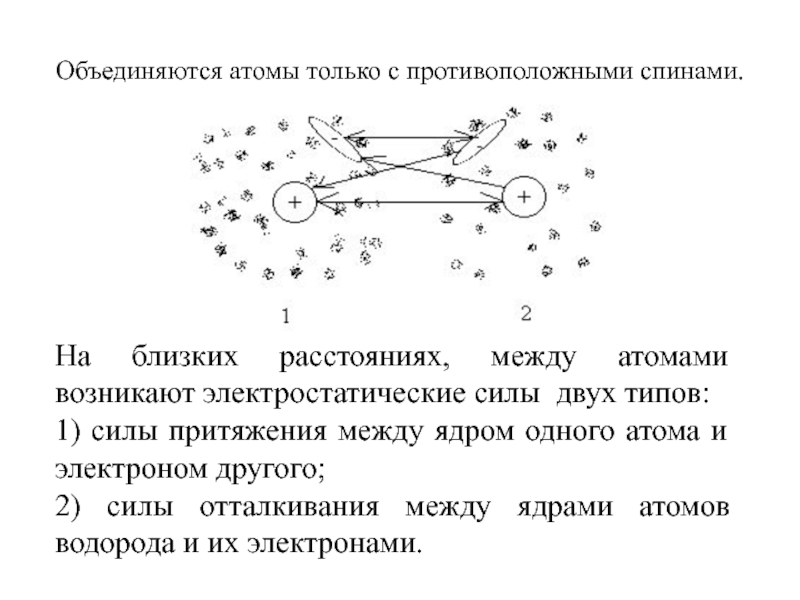
Слайд 8Объединяются атомы только с противоположными спинами.
На близких расстояниях, между
атомами возникают электростатические силы двух типов:
1) силы притяжения между ядром
одного атома и электроном другого;2) силы отталкивания между ядрами атомов водорода и их электронами.
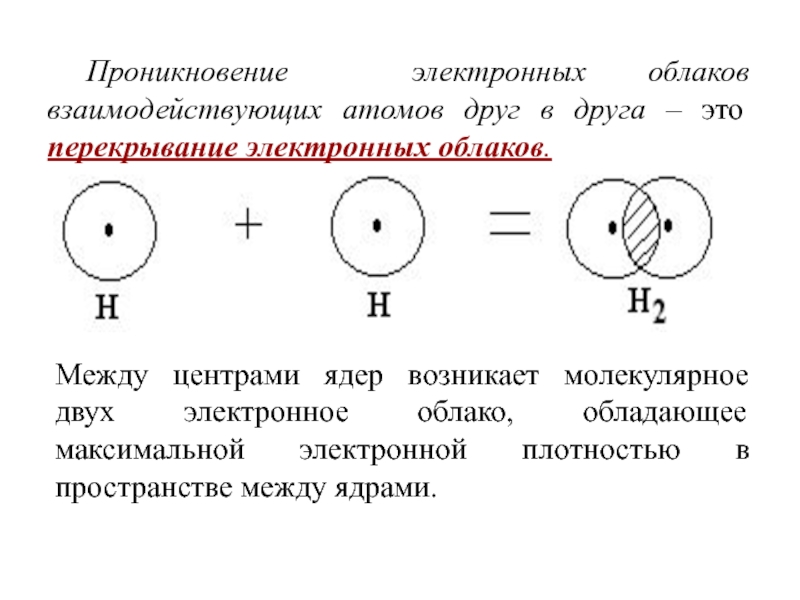
Слайд 9Проникновение электронных облаков взаимодействующих атомов друг в друга – это
перекрывание электронных облаков.
Между центрами ядер возникает молекулярное двух электронное облако,
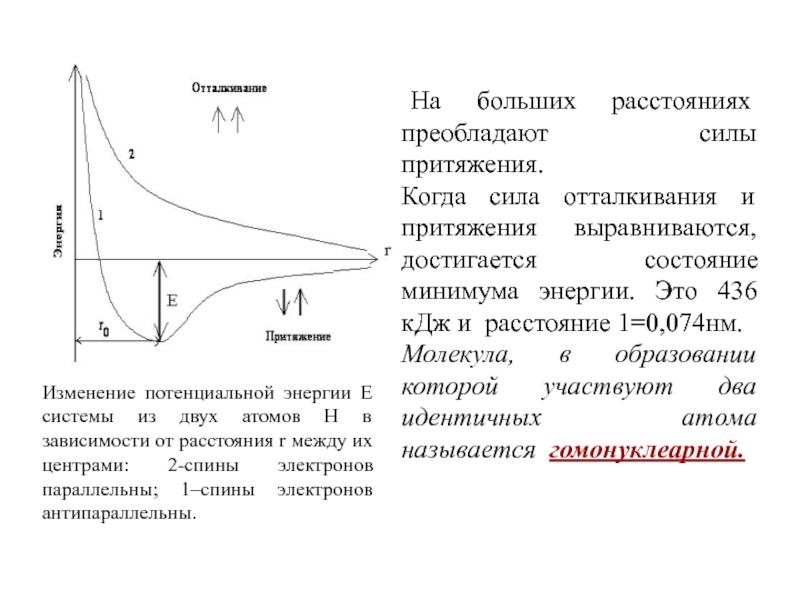
обладающее максимальной электронной плотностью в пространстве между ядрами.Слайд 10Изменение потенциальной энергии Е системы из двух атомов Н в
зависимости от расстояния r между их центрами: 2-спины электронов параллельны;
1–спины электронов антипараллельны. На больших расстояниях преобладают силы притяжения.
Когда сила отталкивания и притяжения выравниваются, достигается состояние минимума энергии. Это 436 кДж и расстояние 1=0,074нм.
Молекула, в образовании которой участвуют два идентичных атома называется гомонуклеарной.
Слайд 11Льюис предположил: устойчивые внешние электронные конфигурации у молекул могут возникнуть
в результате обобществления электронов.
Связь, образованная за счёт обобществлённой пары электронов,
поставляемых по одному от каждого атома называется ковалентной связью.Слайд 12
Правило октета: стремление к созданию устойчивой электронной конфигурации благородного газа
(2-х или 8-и электронной) при образовании химической связи.
Слайд 13Энергия и длина связи
Энергия выделяющаяся при образовании молекулы из
атомов - это энергия связи (Е, кДж/моль).
Чем больше энергия
химической связи, тем устойчивее молекула. Оптимальное расстояние между ядрами, при котором система имеет минимальную энергию - это длина связи (lсв, нм), (минимум на кривой энергии).
Длина связи зависит от размеров электронных оболочек и степени их перекрывания.
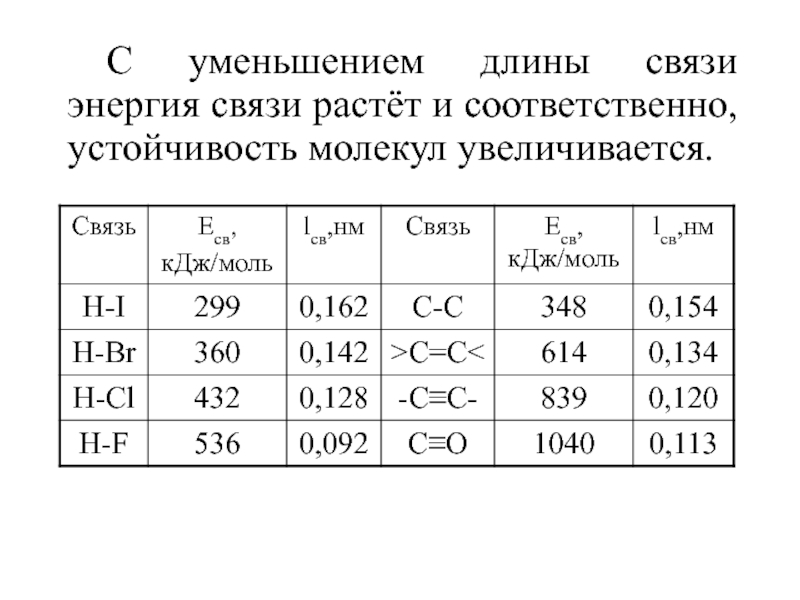
Слайд 14С уменьшением длины связи энергия связи растёт и соответственно, устойчивость
молекул увеличивается.
Слайд 15Метод валентных связей (ВС)
1) Химическая связь между двумя атомами возникает
при перекрывании атомных орбиталей с образованием электронных пар.
2) Атомы, вступающие
в реакцию, обмениваются между собой электронами, образуя связывающие пары.Слайд 163) В соответствии с принципом Паули химическая связь образуется лишь
при взаимодействии электронов с антипараллельными спинами
4) Характеристики химической связи (энергия,
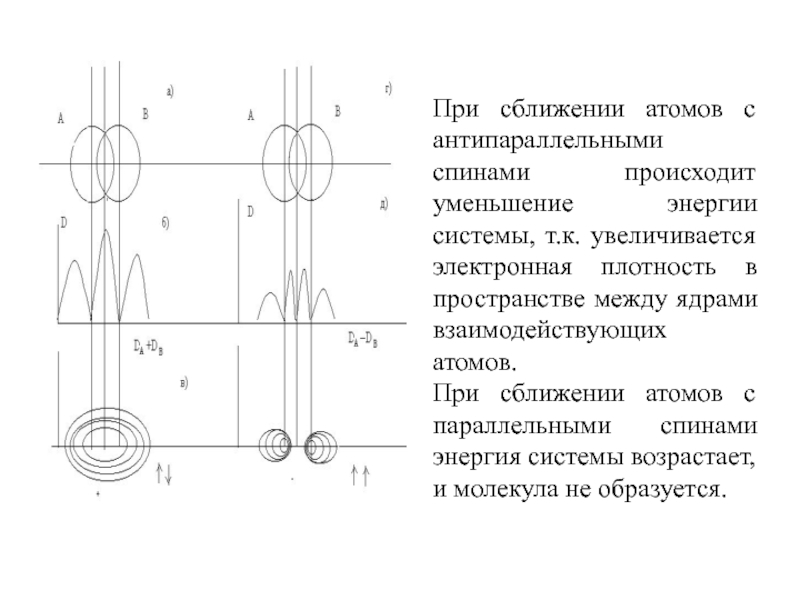
длина, полярность и др.) определяются типом перекрывания атомных орбиталей.Слайд 17При сближении атомов с антипараллельными спинами происходит уменьшение энергии системы,
т.к. увеличивается электронная плотность в пространстве между ядрами взаимодействующих атомов.
При
сближении атомов с параллельными спинами энергия системы возрастает, и молекула не образуется.Слайд 18В образовании химической связи участвуют электроны внешней оболочки.
Изображение молекул и
связей
Молекула HI
C2H2 N2Связь H - I H2C = CH2 N ≡ N
Название Простая Двойная Тройная
связи
Слайд 19В рассмотренных соединениях используется правило октета.
Ковалентная связь двух электронная, двуцентровая.
Присутствует в простых веществах (H2, O2, Cl2), в сложных веществах
(H2O, NH3) и в части кристаллов (алмаз, SiC).Слайд 20При образовании связи изменения претерпевает электронная структура внешних оболочек и
подоболочек атомов.
Расчет молекулы Н2О по методу валентных связей:
Слайд 21Механизм образования ковалентной связи
Обменный механизм: каждый атом отдаёт
на образование общей электронной пары (ковалентной связи) по одному неспаренному
электрону.Механизм образования НС1
Связи образованные р-орбиталями, если не принимать во внимание побочных факторов, располагаются под углом 900 друг к другу.
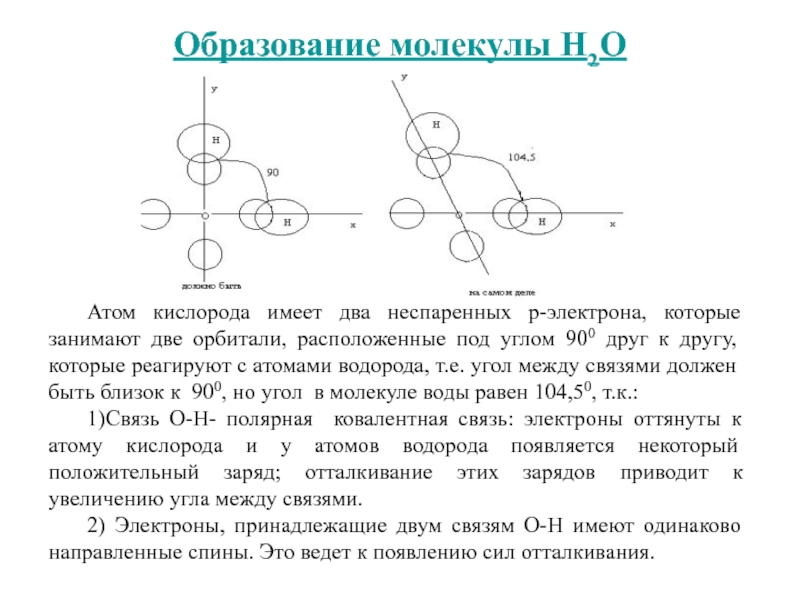
Слайд 22Образование молекулы Н2О
Атом кислорода имеет два неспаренных р-электрона, которые занимают
две орбитали, расположенные под углом 900 друг к другу, которые
реагируют с атомами водорода, т.е. угол между связями должен быть близок к 900, но угол в молекуле воды равен 104,50, т.к.:1)Связь О-Н- полярная ковалентная связь: электроны оттянуты к атому кислорода и у атомов водорода появляется некоторый положительный заряд; отталкивание этих зарядов приводит к увеличению угла между связями.
2) Электроны, принадлежащие двум связям О-Н имеют одинаково направленные спины. Это ведет к появлению сил отталкивания.
Слайд 232) Донорно-акцепторный механизм:
Механизм образования ковалентной связи за счет двух электронного
облака одного атома (донора) и свободной орбитали другого атома (акцептора)
называется донорно-акцепторным.Атом, предоставляющий не поделенную электронную пару, называется донором.
Атом, предоставляющий свободную орбиталь, называется акцептором.
Слайд 24Характеристики ковалентной связи
Полярность.
Связь осуществляется двумя одинаковыми атомами, область перекрывания
электронных облаков притягивается обоими ядрами с равной силой, максимум электронной
плотности располагается точно посередине между ядрами –эта связь неполярная.При частичном смещении области перекрывания к одному из атомов образуется полярная связь. При полярной связи вероятность нахождения электронов у ядра одного атома выше, чем у другого.
Слайд 25Способность атома перетягивать на себя область перекрывания электронных облаков зависит
от способности одного атома принимать электроны (от сродства к электрону)
и от способности другого атома отдавать электроны(от энергии ионизации).Слайд 26Два атома А и В образуют молекулу АВ. Т.к. атомы
разные, то связь полярная.
Может быть два варианта реакции, зависящие от
способности атомов перетягивать электронную плотность:1) А + В = А+В- 2) А + В = В+А-
Слайд 27Образование молекулы А+В- можно разбить на две стадии:
Атом А отдает
электрон и затрачивается энергия ионизации:
А=А++е; ΔНиониз.А
2) Электрон принимается атомом
В, выделяется (или поглощается) энергия, равная сродству к электрону: В + е= В -; -ΔНсрод.В
Слайд 28В сумме энергетические изменения составляет:
ΔНиониз.А -ΔНсрод.В
Для второго варианта:
ΔНиониз.В
-ΔНсрод.А
При
ΔНиониз.В-ΔНсрод.А>ΔНиониз.А-ΔНсрод.В
образуются ионы А+ и В-, а
не А- и В+ Слайд 29Неравенство можно переписать в виде:
ΔНиониз.В +ΔНсрод.В> ΔНиониз.А +ΔНсрод. А
ΔНиониз+ΔНсрод-электроотрицательность
Слайд 30Электроотрицательность позволяет сравнивать атомы по их способности оттягивать электронную плотность
при образовании химической связи.
Электроотрицательность фтора:
ЭОF=ΔНиониз.F+ΔНсрод.F=1680,6+322,3=2000 кДж/моль
Электроотрицательность лития:
ЭОLi=ΔНиониз.Li+ΔНсрод.Li=520,1+59,8 = 580 кДж/моль
Поэтому
способность оттягивать на себя электронную плотность у фтора выше и молекула LiF сильно полярна.Слайд 31Электрический момент диполя μм - равен векторной сумме электрических моментов
диполей связей, имеющихся в молекуле.
Если молекула состоит из одинаковых атомов,
или имеются равноценные заместители и при этом у неё симметричная структура, то молекула неполярная, в следствие, симметричного распределения электрических зарядов по отношению к связи. Слайд 32= ql
1-расстояние между центрами положительных и отрицательных зарядов.
Единица измерения
- D - дебай
Слайд 33Дипольный момент, приходящийся на связь, рассматривают как вектор. При этом
надо учитывать вклад в дипольный момент неподеленных пар электронов.
Например, молекула
СОС –акцептор, О-донор:
Слайд 34Дипольный момент многоатомной молекулы можно считать равным векторной сумме дипольных
моментов всех связей (пренебрегая их взаимным влиянием).
Рассмотрим молекулу аммиака:
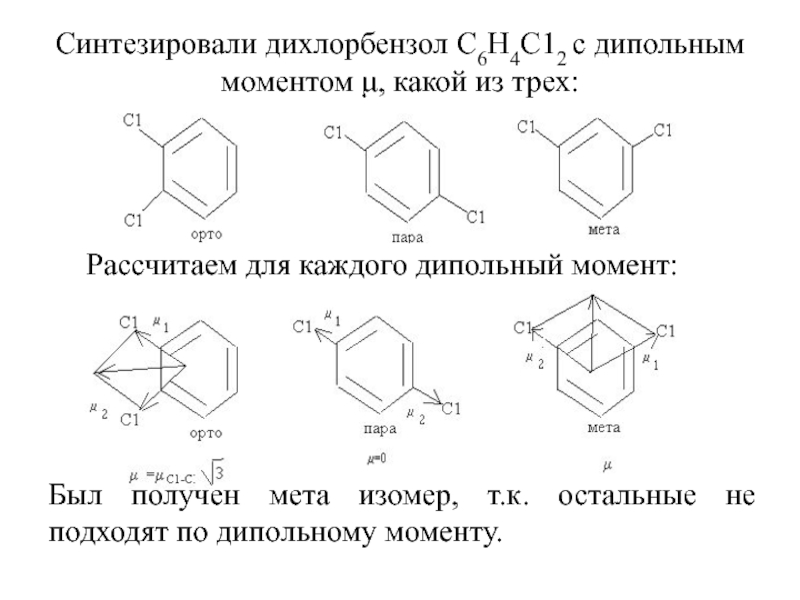
из двух вариантов строения молекулы выбираем второе, т.к. измерения показывают, что молекула полярна. Слайд 35Синтезировали дихлорбензол С6Н4С12 с дипольным моментом μ, какой из трех:
Рассчитаем
для каждого дипольный момент:
Был получен мета изомер, т.к. остальные
не подходят по дипольному моменту.Слайд 36Необходимо учитывать природу многоатомных заместителей в молекуле.
Например, нитробензол и
толуол.
NО2- электронакцепторный заместитель: в связи С-N электронная плотность сдвигается к
азоту.В толуоле СН3 – электрондонорный заместитель: в связи С-С электронная плотность смещается к углероду бензольного кольца.
Слайд 37Эффективные заряды.
Эффективные заряды (δ) - (в единицах электрона), выражают ассиметрию
электронного облака, они условны, т.к. электронное облако делокализовано и его
нельзя разделить между ядрами.Под влиянием внешнего поля эффективные заряды увеличиваются вплоть до значения, отвечающего ионной связи.
Эффективный заряд тем больше, чем больше поляризуемость, которая увеличивается с увеличением электроотрицательности.
Слайд 38Значения эффективных зарядов в подгруппе уменьшаются, например:
δF = 0,45,
δС1=0,2, δВr=0,12, δI=0,05.
В соединениях одного и того же элемента эффективный
заряд падает с увеличением степени окисления Сr+2С12(δСr=1,9); Сr+3С13(δСr=1,3); К2Сr+6О4(δСr=0,2)
Чем выше формальная валентность, тем больше доля ковалентной связи. Это обусловлено уменьшением полярности связей по мере увеличения числа связей.
Слайд 39Поляризуемость, (α) - способность молекулы становиться полярной (или более полярной)
под действием внешнего электрического поля.
В электрическом поле происходит смещение
электронных оболочек в сторону положительно зараженной пластины, а ядер в сторону отрицательно заряженной пластины. В результате поляризации может произойти полный разрыв связи.катализатор НОН
Н* + Cl* ← НСl → H+ + Cl-
гомолитический гетеролитический
разрыв разрыв
Слайд 40Насыщаемость.
Насыщаемость-невозможность присоединения других атомов к атому, у которого использованы все
валентные электроны для образования электронных пар.
В химическом взаимодействии участвуют электроны
только внешних энергетических уровней, число которых ограниченно. Насыщаемость атома определяет его валентность.
Слайд 41Валентность - число связей, которые данный атом может образовать с
другими атомами.
Определяется числом неспаренных электронов, принимающих участие в образовании
химической связи.Слайд 43При возбуждении атома – происходит разъединение 2s электронов и переход
одного из них на 2р орбиталь.
Распаривание требует затрат энергии,
которая компенсируется энергией выделяющейся при образовании общих электронных пар. Если затраты энергии на распаривание превышают энергию связи, то такие системы не существуют.
Слайд 44Суммарная валентность равна числу неспаренных электронов (обменный механизм) плюс число
связей, образованных по донорно-акцепторному механизму.
Слайд 45Направленность.
Атомные орбитали пространственно ориентированы, и перекрывание электронных облаков происходит по
определенным направлениям .
Связь, образованная перекрыванием АО по линии, соединяющей ядра
взаимодействующих атомов, называется σ - связью. Особенность σ - связи – возможность свободного вращения фрагментов молекулы вокруг неё.
σ - связь обычно охватывает два атома и не простирается за их пределы. Она локализованная двух центровая связь. Обозначается Н - F, Cl – Cl.
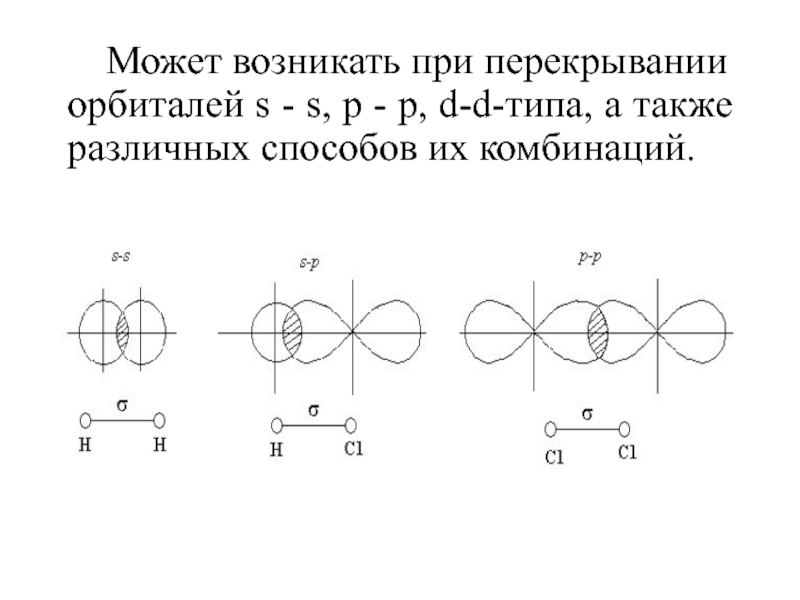
Слайд 46Может возникать при перекрывании орбиталей s - s, р -
р, d-d-типа, а также различных способов их комбинаций.
Слайд 47Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра
– боковое перекрывание – называется π - связью.
Связь, образованная
перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ - связью. π- и δ - связи разрываются при вращении фрагментов молекулы вокруг этих связей. π- и δ- связи не имеют самостоятельного значения
Слайд 48Число связей между атомами называется кратностью связи.
π – связи
в молекулах (ионах), у которых возможно несколько способов локализации связей
между атомами, называются делокализованными связями.Например, структура 1,3 бутадиена может быть записана в двух формах:
СН2=СН-СН=СН2 или СН2-СН=СН-СН2
| |
В действительности нет ни той ни другой структуры, а гибридная структура:
СН2…….СН2…….СН2……..СН2
Слайд 49Строение бензола является промежуточным между:
Правильно записывать структурную формулу бензола
Структурам (1) и (2) соответствуют волновые функции ψ1 и ψ2.
Волновая функция для бензола: ψ=с1ψ1+с2ψ2 предполагает равенство всех связей. Структуры (1) и (2) отличаются перестановкой одинарных и двойных связей, и функции ψ соответствует меньшее значение энергии.
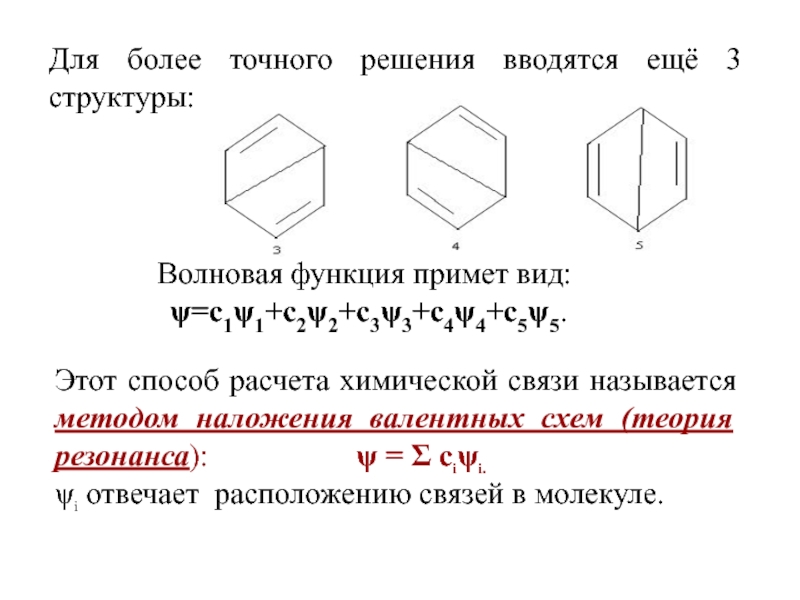
Слайд 50Для более точного решения вводятся ещё 3 структуры:
Волновая функция примет
вид:
ψ=с1ψ1+с2ψ2+с3ψ3+с4ψ4+с5ψ5.
Этот способ расчета химической связи называется методом наложения валентных
схем (теория резонанса): ψ = Σ сiψi.ψi отвечает расположению связей в молекуле.
Слайд 51Гибридизация атомных орбиталей
Рассмотрим атом углерода 1s22s22p2.
В возбуждённом состоянии у него
4 неспаренных электрона 2s12p3
Атом углерода должен образовывать четыре неравноценные
связи: три связи направленные под углом 900 друг к другу (р – электроны), и одну связь, образованную s-электроном с произвольным направлением (s-электроны).Однако все связи углеродного атома равноценны и направлены к вершинам тетраэдра (угол 109,50).
Слайд 52Гибридизация – это изменение формы атомной орбитали за счет комбинации
с другими атомными орбиталями иной симметрии этого же атома, в
результате возникают новые гибридные атомные орбитали промежуточной формы.Гибридная орбиталь вытянута в одну сторону от ядра, что обуславливает более сильное перекрывание таких орбиталей, чем негибридных, с орбиталями электронов других атомов.
Слайд 53Волновая функция гибридной орбитали:
ψгибрид =аψs +bψр(х)+сψр(у) +dψр(z) , а,
b, с, d- коэффициенты.
Гибридизация одной s и одной р-орбиталей.
ψ1=а1ψs+b1ψр
ψ2=а2ψs+b2ψр
Для
нахождения а1, а2, b1, b2 составим 4 уравнения :1)Т.к. s и р волновые функции нормированы, то:
а12 + b12=1
а22 + b22 =1
2) Т.к. гибридные орбитали ортагональны, то: ⌡ψ1ψ2dυ=0
3) Т.к. связи одинаковы /а1/ = /а2/; /b1/ = /b2/.
Этим уравнениям отвечают значения коэффициентов
а1=а2=b1=-b2=1/√2.
Волновые гибридные функции определяются уравнениями :
ψ1= (1/√2)(ψs+ψр) ψ2= (1/√2)(ψs -ψр).
Слайд 54Условия устойчивости гибридизации:
1) По сравнению с исходными атомными орбиталями гибридная
должна более полно перекрываться с орбиталью соседнего атома при образовании
связи.2) В гибридизации могут участвовать атомные орбитали, которым соответствуют близкие энергетические уровни.
3) В гибридизации могут участвовать атомные орбитали с достаточно высокой электронной плотностью, с тем, чтобы при перекрывании гибридных атомных орбиталей был заметен выигрыш энергии по сравнению с перекрыванием исходных атомных орбиталей.
Слайд 55Виды гибридизации
sр – составлены из одной s– и одной
р - орбитали, всего их 2.
Две sр - гибридные орбитали
расположены на прямой линии, угол между ними 1800.Пример: Молекула ВеН2 имеет две равноценные связи Ве-Н, расположенные под углом 1800. Связь Ве-Н полярная, из-за разной ЭО бериллия и водорода, но молекула в целом неполярна (μ=0),т.к. связи имеют противоположные направления. Из-за взаимного перекрывания всех неспаренных электронов молекула диамагнитна.
Слайд 56sр2- составлены из одной s и двух р - орбиталей,
всего их 3.
Три sр2–гибридные связи образуют правильный треугольник, атом
в центре, угол между связями 1200. Пример: Молекула ВF3 имеет три равноценные связи, расположенные под углом 1200 . Связи полярные, т.к. бор и фтор имеют разные ЭО, но молекула в целом неполярна (μ=0), т.к. она симметричная с одинаковыми заместителями. Из-за взаимного перекрывания всех неспаренных электронов молекула диамагнитна.
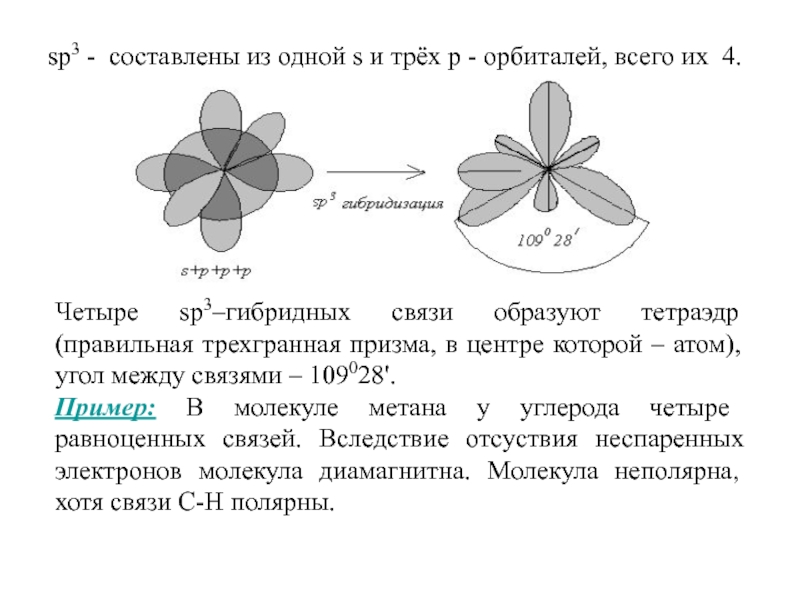
Слайд 57sp3 - составлены из одной s и трёх р -
орбиталей, всего их 4.
Четыре sp3–гибридных связи образуют тетраэдр (правильная
трехгранная призма, в центре которой – атом), угол между связями – 109028'.Пример: В молекуле метана у углерода четыре равноценных связей. Вследствие отсуствия неспаренных электронов молекула диамагнитна. Молекула неполярна, хотя связи С-Н полярны.
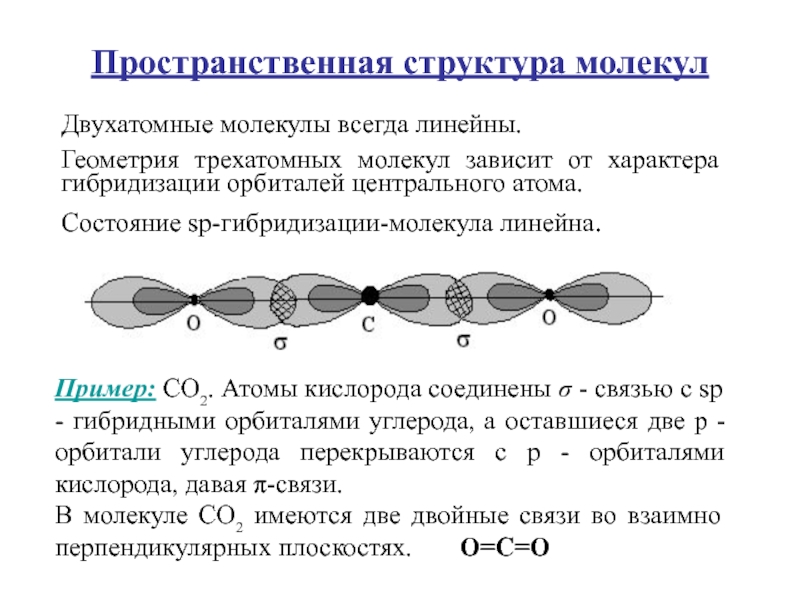
Слайд 58Пространственная структура молекул
Двухатомные молекулы всегда линейны.
Геометрия трехатомных молекул зависит
от характера гибридизации орбиталей центрального атома.
Состояние sp-гибридизации-молекула линейна.
Пример: СО2.
Атомы кислорода соединены σ - связью с sp - гибридными орбиталями углерода, а оставшиеся две р - орбитали углерода перекрываются с р - орбиталями кислорода, давая π-связи. В молекуле СО2 имеются две двойные связи во взаимно перпендикулярных плоскостях. О=С=О
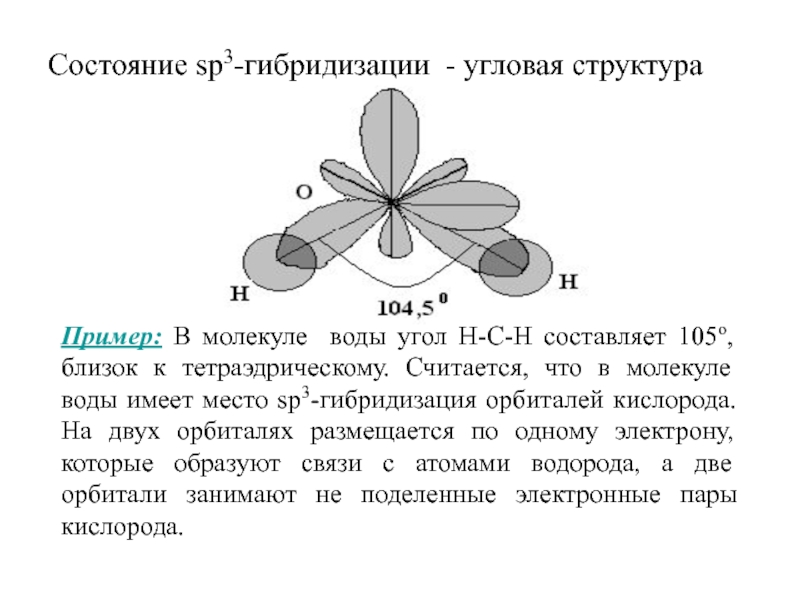
Слайд 59Состояние sp3-гибридизации - угловая структура
Пример: В молекуле воды угол
Н-С-Н составляет 105о, близок к тетраэдрическому. Считается, что в молекуле
воды имеет место sp3-гибридизация орбиталей кислорода. На двух орбиталях размещается по одному электрону, которые образуют связи с атомами водорода, а две орбитали занимают не поделенные электронные пары кислорода.Слайд 60Четырехатомные молекулы имеют два типа структур
Плоская структура.
Три заместителя
располагаются вокруг центрального атома с углом 120о между ними. Центральный
атом находится в состоянии sp2-гибридизации.Пример : BС13
Трехгранная пирамида.
В каждом углу которой находится атом.
Пример: NH3.
Углы между связями HNH составляют 1080. Атом азота находится в состоянии sp3-гибридизации и пирамида постоянно выворачивается через плоскость ННН
Слайд 61Тяжелые элементы, из-за рыхлой структуры электронных оболочек связи чаще образуются
чистыми p- и f-орбиталями.
Элементы одной и той же подгруппы
могут образовывать аналогичные соединения, но с разной пространственной структурой. Например, элементы V группы г/п образуют гидриды ЭН3 двух разных структур. NH3 имеет валентный угол между связями 1070, т.к. азот имеет sp3-тип гибридизацию, а в молекулах РН3, АsН3, SbН3 углы между связями точно равны 900, что свидетельствует об отсутствии гибридизации. Сверху вниз в п/г угол между связями у гидридов уменьшается, достигая 900, что говорит об изменении механизма образования молекул.
Это связано с ослаблением способности наружных электронных орбиталей гибридизоваться с увеличением числа электронных уровней.
Слайд 62 В молекулах СН4, NН3, Н2О углерод, азот и кислород
имеют sp3 тип гибридизации, а угол связи изменяется 109028` у
СН4, 10703` у NH3, 1050 у Н2О.Это обусловлено различием сил взаимного отталкивания орбиталей, заполненных только парой электронов, и орбиталей, перекрывающихся с атомом водорода.
В молекуле СН4 гибридных орбиталей, заполненных не поделенной электронной парой нет. В молекуле NН3 одна гибридная орбиталь, заполненна парой электронов, и она отталкивает в направлении от себя 3 остальных орбитали связи N-Н, уменьшая угол 1070,3`. В молекуле воды две отбитали с парами электронов. Их влияние на связи ещё сильнее, и угол НОН равен 1050.
Слайд 63Гибридизация с участием d – орбиталей
Конфигурации молекул: sp3d2,d2sp3 и
др.
6 гибридные орбитали, направленны от ядра к вершинам восьмиугольника (октаэдр)
под углом 900 относительно друг друга. Заполнение гибридных орбиталей не поделенной электронной парой происходит по донорно-акцепторному механизму.
Такой механизм имеется в комплексных соединениях, например, ион [Fe(CN)6]3-
Слайд 64Недостатки метода валентных связей
Постулируется участие в образовании связей пары электронов,
но существуют свободные радикалы, молекулярные ионы, такие как Н2+, в
которых связь образуется за счет одного электрона.Свободные радикалы – это частицы, обладающие высокой реакционной способностью и содержащие неспаренные электроны.
2) Не объясняет магнитных свойств веществ.
Неспаренные электроны обуславливают магнитные свойства веществ.
Вещества, имеющие неспаренные электроны, парамагнитны, т.е. втягиваются в магнитное поле.
Вещества, не имеющие неспаренных электронов, диамагнитны, т.е. выталкиваются из магнитного поля.
Слайд 65Атом кислорода имеет два неспаренных электрона.
На основании метода валентных связей
- при соединении двух атомов кислорода образуются две неподеленные пары
и неспаренных электронов в молекуле кислорода нет.Но кислород имеет магнитные свойства, что доказывает наличие в молекуле кислорода неспаренных электрона, т.е. он парамагнитен.
Слайд 66Метод молекулярных орбиталей (МО)
В многоатомных системах (молекулах, кристаллах) валентные электроны
одновременно принадлежат всем связываемым атомам.
При образовании многоатомной частицы электроны попадают
в зону притяжения нескольких атомных ядер, т.е. становятся общими для всей частицы. Слайд 673) В результате атомные орбитали трансформируются в молекулярные.
4) Молекула рассматривается
как единая система.
5) Образование МО энергетически выгодно, т.к. делокализация электронов
ведёт к уменьшению энергии системы.6)Число электронов на молекулярных орбиталях равно сумме электронов на атомных орбиталях.
Слайд 68Молекулярная орбиталь (МО) – волновая функция, которая описывает состояние электрона
в поле двух или нескольких атомов.
МО не принимающие участие в
химической связи называются несвязывающими.Электроны на них обладают тем же запасом энергии, что в исходных атомных орбиталях.
МО охватывают всю молекулу, т.е. являются двух- или многоцентровыми.
Слайд 69Метод ЛКАО
Волновая функция электрона в молекуле по методу МО
ЛКАО:
ϕМО=с1ϕАО1 + с2ϕАО2 +…+ сn ϕАОn
ϕАО1, ϕАО2,… ϕАОn –
волновые функции (атомные орбитали) электронов атомов, из которых образована данная молекула. а с1, с2,….-коэффициенты.
Слайд 70Перекрывание атомных орбиталей ψа и ψв соответствует сложению электронных плотностей,
и возникает молекулярная орбитальψ+:
ψ+=k1ψа+k2ψв
k-коэффициенты, учитывающие долю участия атомных
орбиталей в молекулярных. Сложение осуществляется только с атомными орбиталями, имеющими антипараллельные спины.
Слайд 71Если спины электронов атомных орбиталей параллельны, то эти электроны отталкиваются,
и электронные плотности вычитаются :
ψ-=k1ψа-k2ψв.
Для описания электронного состояния
необходимо учитывать оба взаимодействия (сложение и вычитание атомных орбиталей). Энергетическое состояние молекулы зависит от числа комбинаций операций сложения и вычитания.
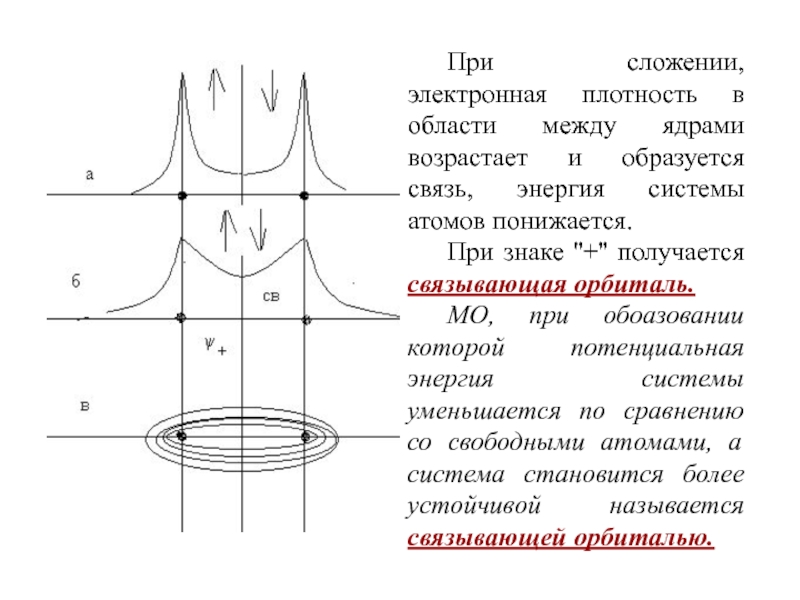
Слайд 72При сложении, электронная плотность в области между ядрами возрастает и
образуется связь, энергия системы атомов понижается.
При знаке ''+'' получается связывающая
орбиталь. МО, при обоазовании которой потенциальная энергия системы уменьшается по сравнению со свободными атомами, а система становится более устойчивой называется связывающей орбиталью.
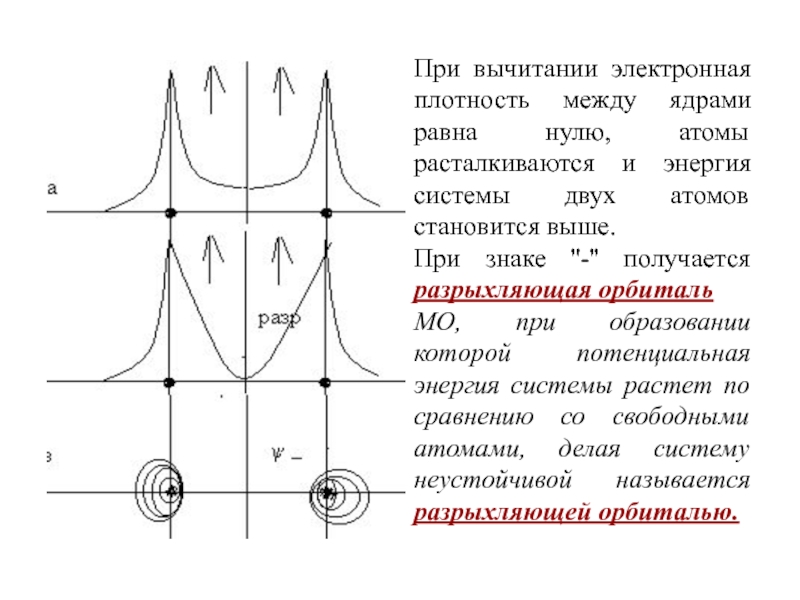
Слайд 73При вычитании электронная плотность между ядрами равна нулю, атомы расталкиваются
и энергия системы двух атомов становится выше.
При знаке ''-'' получается
разрыхляющая орбитальМО, при образовании которой потенциальная энергия системы растет по сравнению со свободными атомами, делая систему неустойчивой называется разрыхляющей орбиталью.
Слайд 75Две атомные s – орбитали дают две молекулярные орбитали: σсвs
и σразрs, на которых может быть размещено всего четыре электрона.
Энергетический уровень σ связывающей орбитали ниже, чем σ разрыхляющей.
МО, получающиеся при комбинации s атомных орбиталей называются σs МО.
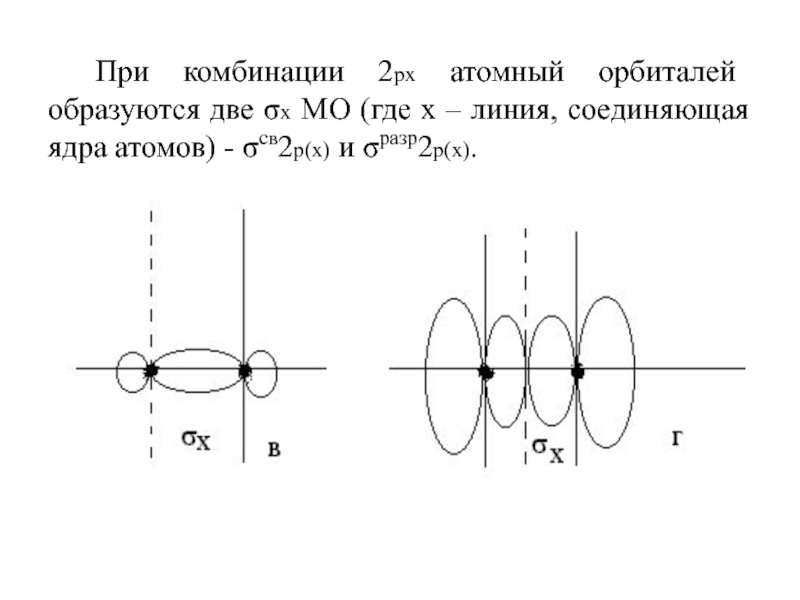
Слайд 76При комбинации 2рх атомный орбиталей образуются две σх МО (где
х – линия, соединяющая ядра атомов) - σсв2р(х) и σразр2р(х).
Слайд 77При комбинации двух ру и двух рz атомных орбиталей образуются
две πу и две πz МО - πсв2р(у) и πразр2р(у)
из ру- орбиталей, πсв2р(z) и πразр2р(z) из рz орбиталей, т.к. ру и рz орбитали перекрываются боковыми поверхностями, поэтому образуются π-связи.Слайд 78У связывающих МО электронная плотность сосредоточена между ядрами, это снижает
запас энергии и упрочняет молекулу.
Разрыхляющие МО имеют пониженную электронную
плотность между ядрами, поэтому они не связывают атомы в молекулу.π МО образуются при комбинации p- и d –АО, и некоторых d-АО. Кроме того при комбинации d-АО образуются δ-МО.
Электрон, в пределах одного подуровня, в первую очередь занимает в вакантную связывающую-МО.
Слайд 79σр(х) связывание сильнее πр(у) и πр(z) связывания, поэтому энергетический уровень
молекулярной орбитали σсв2р(х) должен быть расположен ниже уровня орбиталей πсвр(у)
и πсвр(z).Расталкивание рх –орбиталей сильнее, чем ру и рz и уровень молекулярной σразр2р(х) должен лежать выше πразрр(у) и πразрр(z).
Слайд 80Поэтому уровень σсв2р(х) перемещен несколько выше уровней πсвр(у) и πсвр(z),
т.к. при образовании двухатомной молекулы на линии, соединяющей два ядра,
происходит одновременное перекрывание атомных s и рх орбиталей, что приводит к взаимному отталкиванию областей перекрывания и повышению энергии молекулярной σсв2р(х) – орбитали.Слайд 81Порядок заполнения МО
σsсв(1s)
молекулярных σсв и σразр – орбиталей первого уровня можно записать
так:ψ (σсв) = Νсв(1s(а) + 1s(в))
ψ (σразр) = Νразр(1s(а) – 1s(в))
Слайд 82Значения констант Nсв и Nразр определяют из условия нормировки
⎭⎜ψ⎜2dτ=1.
Вычислим
Nсв:⎭[ψ(σсв)]2dτ=1=(Νсв)2[⎭(1sа)2dτ+⎭(1sв)2dτ+2⎭(1sа)(1sв)dτ.
Если атомные орбитали 1sа и 1sв уже нормированы, то:
⎭(1sа)2dτ=⎭(1sв)2dτ=1.
Выражение ⎭(1sа)(1sв)dτ - интеграл перекрывания (S)
тогда: (Nсв)2[2+2S]=1, откуда:
Nсв = ±√1/2(1+S).
Величиной S можно пренебречь: Nсв =√1/2.
Аналогично вычисляют Nразр=√1/2.
Слайд 83Приближенные молекулярные орбитали для Н2+ имеют вид:
ψ (σсв) =
1/2(1s(а) + 1s(в))
ψ (σразр) = 1/2(1s(а) – 1s(в))
Рассчитаем
энергию молекулярных орбиталей:Е[ψ(σсв)]=1/2⎭(1sа)Η(1sа)dτ+1/2⎭(1sв)Η(1sв)dτ+ 1/2⎭(1sа)Η(1sв)dτ+1/2⎭(1sв)τ(1sа)dτ
qа=1/2⎭(1sа)Η(1sа)dτ
qв=1/2⎭(1sв)Η(1sв)dτ
β=1/2⎭(1sа)Η(1sв)dτ=1/2⎭(1sв)τ(1sа)dτ.
qа=qв=q
qа и qв – кулоновские интегралы
β - обменный или резонансный или ковалентный интеграл.
Слайд 84Кулоновские интегралы – это энергия, необходимая для отрыва электрона с
данной атомной орбитали в поле действия ядер и остальных электронов
молекул. Иногда его называют валентным потенциалом ионизации.Обменный интеграл - величина дополнительной стабилизации при образовании ковалентной связи.
Энергия связи:
Е/ψ(σсв)/ =q+β для связывающей орбитали.
Е=/ψ(σразр)/ = q-β - для разрыхляющей орбитали.
Разрыхляющая орбиталь менее устойчива, чем связывающая.
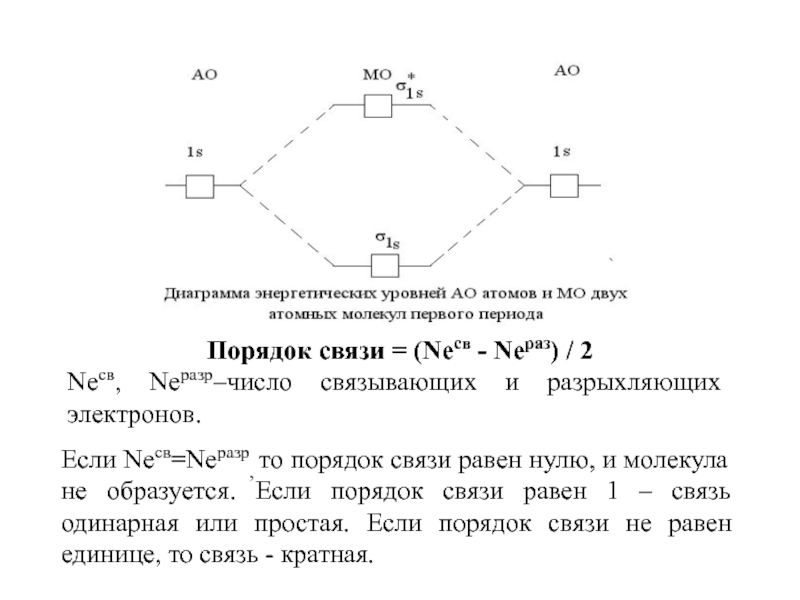
Слайд 85Порядок связи = (Nесв - Nераз) / 2
Nесв, Nеразр–число связывающих
и разрыхляющих электронов.
Если Nесв=Nеразр, то порядок связи равен нулю, и
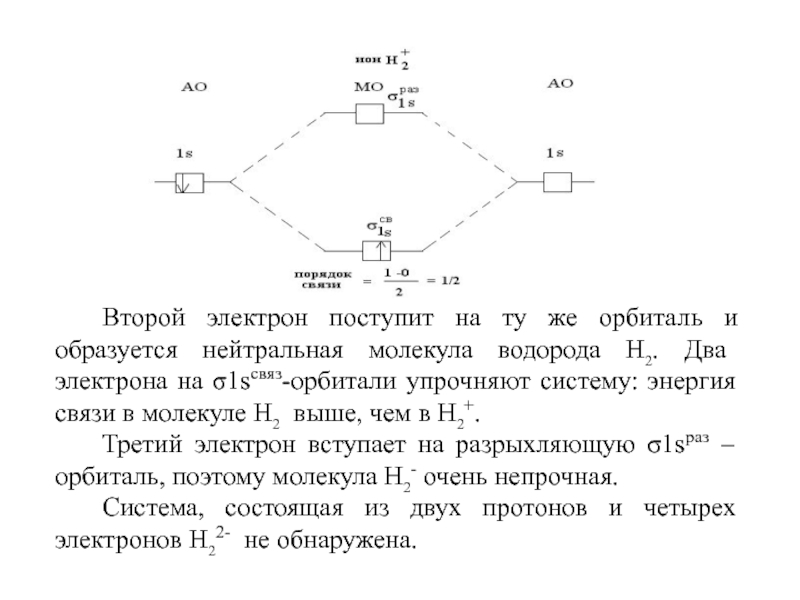
молекула не образуется. Если порядок связи равен 1 – связь одинарная или простая. Если порядок связи не равен единице, то связь - кратная. Слайд 86Второй электрон поступит на ту же орбиталь и образуется нейтральная
молекула водорода Н2. Два электрона на σ1sсвяз-орбитали упрочняют систему: энергия
связи в молекуле Н2 выше, чем в Н2+.Третий электрон вступает на разрыхляющую σ1sраз – орбиталь, поэтому молекула Н2- очень непрочная.
Система, состоящая из двух протонов и четырех электронов Н22- не обнаружена.
Слайд 87Молекула Не2 должна была бы содержать 4 электрона – два
связывающих и два разрыхляющих, и в невозбужденном состоянии она неизвестна.
Но молекула с двумя связывающим и одним разрыхляющим электроном (Не2+) устойчива и существует.
Слайд 89По мере заполнения связывающих МО прочность связи повышается: увеличивается её
порядок, уменьшается длина и возрастает энергия.
По мере заполнения разрыхляющих
МО прочность связи уменьшается: уменьшается порядок и энергия, возрастает длина связи.Удаление электрона с разрыхляющих орбиталей приводит к уменьшению межъядерного расстояния и увеличению энергии диссоциации. Удаление электрона с связующих МО приводит к уменьшению энергии диссоциации и возрастанию межъядерного расстояния.
Слайд 90Если два электрона находятся на одной орбитали, то их магнитные
поля замыкаются.
Если в веществе магнитные моменты всех электронов скомпенсированы,
т.е. все электроны спаренные, то это диамагнитное вещество. Если в орбиталях имеются одиночные электроны, то вещество проявляет парамагнетизм. В молекуле О2 имеется 2 неспаренных электрона, поэтому молекула кислорода парамагнитна, молекула фтора неспаренных электронов не имеет, следовательно она диамагнитна
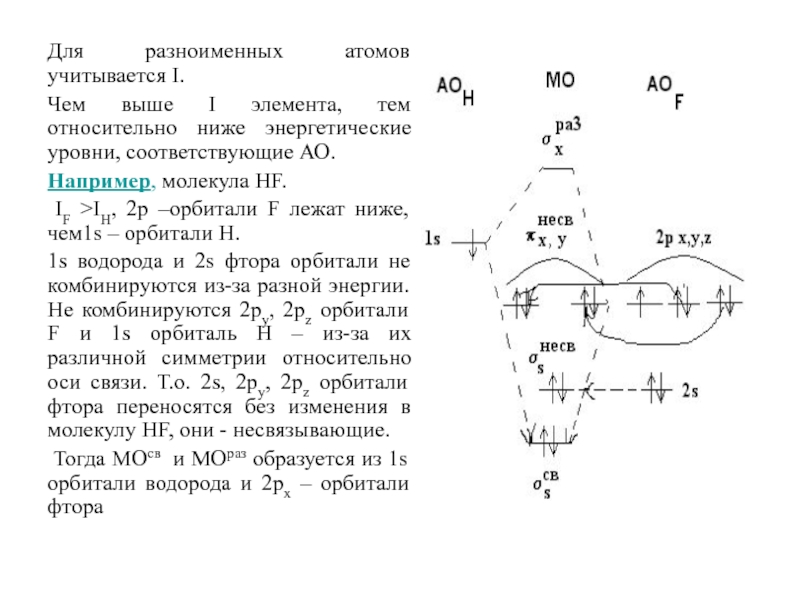
Слайд 91Для разноименных атомов учитывается I.
Чем выше I элемента, тем относительно
ниже энергетические уровни, соответствующие АО.
Например, молекула НF.
IF >IH,
2р –орбитали F лежат ниже, чем1s – орбитали Н. 1s водорода и 2s фтора орбитали не комбинируются из-за разной энергии. Не комбинируются 2ру, 2рz орбитали F и 1s орбиталь H – из-за их различной симметрии относительно оси связи. Т.о. 2s, 2ру, 2рz орбитали фтора переносятся без изменения в молекулу НF, они - несвязывающие.
Тогда МОсв и МОраз образуется из 1s орбитали водорода и 2рх – орбитали фтора
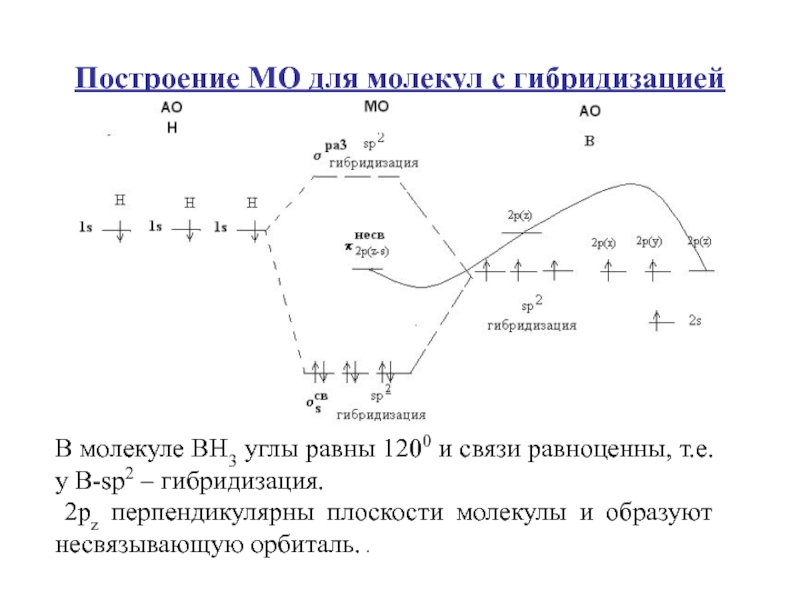
Слайд 92Построение МО для молекул с гибридизацией
В молекуле ВН3 углы равны
1200 и связи равноценны, т.е. у В-sр2 – гибридизация.
2рz
перпендикулярны плоскости молекулы и образуют несвязывающую орбиталь. .Слайд 93Достоинства метода МО:
более универсален, позволяет объяснить возникновение, и характер
связей у более широкого круга соединений;
2) с его помощью
удается рассчитать параметры связей и соединений. Недостатки метода МО:
более сложен;
2) менее нагляден;
3) не дает характеристику отдельных атомов в молекулах и фрагментах молекул.
Слайд 94Общие черты ММО и МВС
1) они дают одинаковое распределение электронной
плотности в соединениях, которое можно объяснить по тому и другому
методу.2) Условием образования химической связи является перекрывание АО, причем прочность связи растет с увеличением электронной плотности между ядрами.
3) В зависимости от типа АО образуются σ-, π-, δ- связи.
Метод МО применяется для описания поведения делокализованных электронов.
Метод ВС лучше описывает поведение локализованных связей
Слайд 95Ионная связь
Теория ионной связи:
самой устойчивой электронной конфигурацией атома является,
когда на внешнем электронном уровне находятся 8 или 2 электрона.
Довольно устойчивы также атомы, внешний слой которых содержит 18 электронов. Во время химической реакции атомы стремятся приобрести наиболее устойчивую конфигурацию.
Это достигается в результате присоединения электронов атомов других элементов или отдачи электронов из внешнего слоя атомам.
Разноименные ионы удерживаются друг около друга силами электростатического притяжения.
Слайд 96Атомы, отдавшие часть электронов, приобретают положительный заряд и становятся положительно
заряженными ионами – катионами.
Атомы, присоединившие электрон, превращаются в отрицательно
заряженные ионы – анионы.Катионообразующие атомы: водород и металлы. Легче всего образуются одно- и двух зарядные катионы. Трех-, четырех- и более зарядные катионы фактически не существуют.
Анионы из простых веществ существуют только однозарядные, т.к. уже 2 дополнительных электрона ядро удержать в форме иона не в силах. Поэтому есть C1-, Br-, но О2-, S2- не существуют, в растворах всегда ОН-, SН-.
Слайд 97Схема образования NaC1
Электронная конфигурация натрия 1S22S22Р63S1.
Легко отдает 3S электрон, приобретая
устойчивую конфигурацию из 8 электронов на внешнем уровне 2S22Р6
Na
- е = Nа+, Еиониз.= 493 кДж/моль2) Электронной конфигурации хлора 1S22S22Р63S23Р5. Легко присоединяет один электрон при этом возникает устойчивая конфигурация 3S23Р6.
С1 + е = С1-, Еср=365 кДж/моль
3) Образовавшиеся ионы натрия и хлора, притягиваются.
Na+ + С1- = Na+С1-.
Слайд 98Связь, которая образуется за счёт электростатического взаимодействия разнополярных ионов называется
ионной.
Ионная связь является крайним случаем ковалентной связи.
Стопроцентной ионной связи не
бывает, т.к. невозможно полное разделение зарядов, вследствие волновой природы электронов. Слайд 99Энергия ионной связи
Сила притяжения между недеформированными заряженными шарами с
зарядами е:
fпр = е/r2
r-расстояние между центрами ионов.
Энергия притяжения:
Uпр = -(е2/r). При увеличении радиуса, энергия притяжения уменьшается.
Энергия отталкивания: Uотт=В/rn.
N – коэффициент борновского отталкивания.
При увеличении радиуса энергия отталкивания уменьшается.
На равновесном расстоянии r0:Uотт=Uпр.
Слайд 100Ионная связь, характеризуется:
ненаправленностью, т.к. ионы можно представить, как заряженные шары,
силовые поля которых равномерно распределяются во всех направлениях в пространстве.
ненасыщаемостью, т.к. при взаимодействии ионов противоположного знака не может привести к полной нейтрализации зарядов.
Вокруг положительного иона всегда группируются не 1, а несколько отрицательных зарядов, точное число которых меняется.
Слайд 101Поляризация иона - это относительное смещение ядра и окружающих его
электронов внешней электронной оболочки под действием электрического поля соседнего иона.
Электроны смещаются в сторону катионов.
При сближении ионов происходит смещение электронов по отношению к ядру и возникает индуцированный дипольный момент μиндуц.
Слайд 102Различают поляризуемость и поляризующую силу.
Поляризуемость ионов - это их способность
деформироваться под действием внешнего электрического поля.
Коэффициент поляризуемости α равен:
α≈r3.Особенности поляризуемости:
1. Возрастает с ростом первого квантового числа n (число электронных слоев).
2. Поляризуемость анионов больше поляризуемости катионов того же электронного слоя.
3. Поляризуемость ионов возрастает с уменьшением силового поля (с уменьшением заряда и увеличением радиуса атома).
Рост заряда приводит к уменьшению радиуса иона и упрочнению связи электронов с ядром.
Слайд 103Поляризующая сила иона – это способность деформировать, поляризовать другой ион.
Особенности поляризующей силы:
1. Уменьшается с возрастанием радиуса иона и уменьшением
заряда иона.2. Поляризующая сила катионов больше, чем у анионов.
3. Катионы со структурой благородного газа обладают меньшей поляризующей силой, чем катионы с 18-электронной оболочкой (получены из d-элементов).
Слайд 104Поляризационные свойства катионов одинакового заряда и радиуса увеличиваются в ряду:
Для
анионов поляризационные свойства ухудшаются в ряду: I-, Br-, C1-, CN-,
OH-, NO3-, F-, C1O4-.Слайд 105Поляризация ионов влияет на свойства соединений:
понижает температуры кипения и плавления,
уменьшает электролитическую диссоциацию в растворах и расплавах.
увеличивает прочность
связи.4) Увеличение поляризации и поляризующего действия ионов усиливает окраску вещества. Например, РbI2 окрашен, СаI2 бесцветен, т.к. у Рb2+ больше поляризующее действие, чем у Са2+.
Слайд 106Металлическая связь
Отличие свойств металлов от других веществ:
1) высокая электрическая
проводимость и теплопроводность, следовательно часть электронов может передвигаться по всему
объёму куска металла.2) в обычных условиях они кристаллические вещества (исключение ртуть) с высокими координационными числами атомов, следовательно их атомы не связаны друг с другом локализованными двухэлектронными связями .
3) невысокая энергия ионизации, т.к. валентные электроны легко перемещаются по всему кристаллу.
Слайд 107Металлическая связь – это связь, в которой электрон каждого отдельного
атома принадлежит всем атомам находящимся в контакте.
В металле небольшое число
электронов одновременно связывает большое число атомных ядер, а сами электроны могут перемещаться в металле, т.е. существует сильно делокализованная химическая связь.Например: Для образования кристалла лития каждый атом предоставляет на связь 4 валентных орбитали и всего лишь 1 валентный электрон. Число электронов значительно меньше числа орбиталей, поэтому электроны принимают участие в образовании связи между всеми атомами кристалла металла.
Слайд 108Межмолекулярные взаимодейсвия
Ван-дер-ваальсовы силы.
Емм = Еор + Еинд + Едисп
Диполь-дипольное
взаимодействие (ориентационное Еор)
μ – постоянный электрический момент диполя молекулы,
r
– расстояние между центрами диполей. Еор возрастает с увеличением электрического момента диполя молекул и уменьшается с ростом температуры, так как тепловое движение нарушает ориентацию молекул.
Слайд 109Индукционное взаимодействие
Е инд. = -2αμ2/r6.
Индукционное взаимодействие увеличивается с
увеличением момента диполя, поляризуемости и размера молекулы.
Еинд.< Еор.
Слайд 110Дисперсионное взаимодействие
hν0/2–энергия колебаний атомов при 0К
Полная энергия межмолекулярного
взаимодействия
а и b постоянные, lв – расстояние между молекулами
Слайд 112Ван-дер-ваальсовы силы действуют между молекулами лишь при близком расположении.
Ориентационное взаимодействие
вносит значительный вклад в ван-дер-ваальсовы силы, если молекула обладает энергетическим
моментом диполя.Ван-дер-ваальсовы силы по сравнению с ковалентной связью очень слабы.
Например: энергия диссоциации молекулы С12 на атомы - 243 кДж/моль, а энергия сублимации кристаллов С12 составляет 25 кДж/моль.
Слайд 113Донорно-акцепторное взаимодействие
Если одна из молекул имеет электронные пары, а
другая свободные орбитали, то между ними возможно донорно-акцепторное взаимодействие.
Н3N:
+ □ ВF3 = Н3N:ВF3Энергия донорно - акцепторного межмолекулярного взаимодействия сопоставима как с ван-дер-ваальсовыми силами, так и с обычной межатомной ковалентной связью.
Слайд 114Водородная связь
Химическая связь, образованная положительно поляризованным водородом молекулы А-Н
(или полярной группы А-Н) и электроотрицательным атомом В другой или
той же молекулы, называется водородной связью. RА - Нδ+ …Вδ-R1Водородная связь имеет промежуточный характер между межмолекулярным взаимодействием и ковалентной связью.
С увеличением электроотрицательности и уменьшением размера атома В энергия водородной связи увеличивается.
В ряду
-Н…F-(25-42)>-Н…О═(13-19)>-Н…N≡(18-21). Хлор водородную связь -Н…С1- из-за большого размера атома не образует.
Слайд 115Если водородная связь образуется между разными молекулами, то она называется
межмолекулярной.
Межмолекулярные водородные связи повышают диэлектрическую постоянную, температуру кипения и
плавления, теплоты плавления и парообразования. Если водородная связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной.
Молекулы с внутримолекулярной связью не образуют межмолекулярные водородные связи. Эти вещества более летучи, имеют более низкие вязкости, температуры кипения и плавления, чем их изомеры с межмолекулярной связью.