Слайд 1Гидролиз солей
Kк - константа кислотности - количественная характеристика
состояния протолитического равновесия обратимой реакции между кислотой HA и основанием
HL.
Чем больше значение Kк, тем более сильной кислотой считается протолит HA в данном растворителе HL.
Например, в этанольных растворах HNO3 и CH3COOH значения Kк при 250С:
HNO3(s)+C2H5OH=NO3-(s)+C2H5OH2+(s); Kк1=2,7*10-4
CH3COOH(s)+C2H5OH=CH3COO-(s)+C2H5OH2+(s);
Kк2 = 4,8*10-11
Kк1> Kк2, поэтому в среде этанола кислотные свойства HNO3 сильнее кислотных свойств CH3COOH.
Слайд 2Для слабых кислот HClO и H2CO3 в водном растворе при
250С:
HClO+H2O=ClO-+H3O+; Kк1 = 2,82*10-8
H2CO3+H2O=HCO3-+H3O+; Kк2=4,27*10-7
Kк1
кислота HClO слабее кислоты H2CO3.
Кислотами в водном растворе являются: катион аммония:
NH4+ +H2O=NH3+H3O+ ; Kк1 = 5,75*10-10,
а также гидратированные катионы металлов:
Al3+* H2O+H2O=AlOH2++H3O+ ; Kк2=9,55*10-6.
Слайд 3 Кислотные свойства ионы NH4+ и Al3+*H2O проявляют после
растворения их солей.
Например, NH4Cl и Al2(SO4)3.
1-я стадия -электролитическая
диссоциация:
NH4Cl=NH4++Cl-
(NH4+-протолит, Cl-- непротолит)
Al2(SO4)3=2Al3++3SO42-
(Al3+-протолит, SO42- - непротолит).
2-я стадия –взаимодействие ионов протолитов с водой (гидролизуются).
Слайд 4 Гидролиз солей - это реакция обмена между водой
и растворяемой в ней соли, в результате в растворе появляется
некоторое избыточное количество ионов Н+ или ОН-, сообщающее раствору кислотные или щелочные свойства.
Условие гидролиза: наличие хотя бы одного иона слабого электролита (кислоты или основания).
Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, КС1.
рН = 7 , нейтральная среда.
Слайд 5Гидролиз соли, образованной сильной кислотой и слабым основанием (гидролиз по
катиону)
Причина гидролиза - образование слабого основания или
гироксокатионов.
В общем виде: Хz++НОН↔ХОН(z-1)++Н+
Например, NН4С1, А12(SО4)3
NН4С1+НОН ↔ NН4ОН+НС1
NН4++НОН↔NН4ОН+Н+
Избыток Н+ создает кислую среду раствора рН<7.
Многозарядный катион А13+ в соли А12(SО4)3 гидролизуется по 3-м ступеням, но 2-я и 3-я ступень в обычных условиях не протекают.
А13+ + НОН ↔ А1ОН2+ + Н+
А12(SО4)3 +2НОН↔А1ОНSО4 + Н2SО4
Слайд 6Kо - константа основности - количественная характеристика состояния протолитического равновесия
в реакции между основанием B и кислотой HL.
Чем больше
значение Kо, тем более сильным основанием считается протолит B в данном растворителе HL.
Например, в водном растворе гидрата аммиака (250C)
NH3+H2O=NH4++OH-; Kо=Kв/Kк=1,74*10-5
а также многих анионов:
ClO-+H2O=HClO+OH-; Kо1=Kв/Kк=3,55*10-7,
CO32-+H2O=HCO3-+OH-; Kо2=Kв/Kк=2,14*10-4.
Kо1
Слайд 7Основные свойства ионов ClO- и CO32- проявляются после растворения в
воде их солей.
Например, NaClO, K2CO3
1-я стадия электролитическая диссоциация:
NaClO=Na++ClO-
(ClO--протолит, Na+-непротолит).
K2CO3=2K++CO32-
(CO32- - протолит, а K+ - непротолит)
Ионы-протолиты вступают в реакцию с водой (гидролизуются).
Слайд 8Гидролиз соли, образованной слабой кислотой и сильным основанием (гидролиз по
аниону).
Причиной гидролиза является образование слабой кислоты или гидроанионов.
В общем виде:Yz-+НОН↔НY(z-1)+ОН-
Например,
КСN, К2СО3:
КСN +НОН ↔ НСN +КОН
СN- + НОН↔НСN + ОН-
Появление избытка ионов ОН- создает щелочную среду, рН>7.
Многозарядный ион СО32- соли К2СО3 гидролизуются по 2-м ступеням, но 2-я в обычных условиях не протекают.
СО32-+НОН↔НСО3-+ОН-
К2СО3 + НОН ↔ КНСО3 + КОН.
Слайд 9Гидролиз соли, образованной слабой кислотой и слабым основанием
(гидролиз и
по катиону и по аниону)
В общем виде: Хz++Yz-+НОН=ХОН(z-1)+ +НY(z-1)-
Такие соли
гидролизуются сильнее остальных, т.к. среди продуктов появляются два слабых электролита, смещающие равновесие в сторону их образования:
NН4СN + НОН ↔ NН4ОН + НСN
NН4++СN-+НОН↔NН4ОН+НСN
Характер среды раствора предсказать невозможно, обязательно нужны расчеты.
Солей этой группы полностью разлагается водой (необратимый гидролиз):
А12S3+6НОН=2А1(ОН)3↓+3Н2S↑
Слайд 10Многие гидроанионы, в водном растворе являются амфолитами.
Например HCO3- :
HCO3-+H2O=CO32-+H3O+; Kк = 4,68*10-11
HCO3-+H2O=H2CO3+OH-; Kо=Kв/Kк=2,34*10-8
Kо>>Kк, ион HCO3- в водном
растворе проявляет больше основные свойства.
HSO3-:
HSO3-+H2O=SO32-+H3O+; Kк= 6,31*10-8
HSO3-+H2O=SO2*H2O+OH-; Kо=Kв/Kк=6,02*10-13
Kо<
Слайд 11 Амфолитами являются амфотерные гидроксиды, типа Zn(OH)2, Be(OH)2, Al(OH)3,
Cr(OH)3 и другие.
В водном растворе они:
1) Гидратируются - образуют
комплексы:
Al(OH)3+Н2О=[Al(OH)3*(H2O)].
2)гидратированные частицы взаимодействуют с водой:
Al(OH)3*H2O+H2O=[Al(OH)4]-+H3O+; Kк= 3,16* 10-8
Здесь Al(OH)3* H2O – кислота.
Al(OH)3*H2O+H2O=Al(OH)2+*H2O+OH-;Kо=7,41*10-9
Здесь Al(OH)3*H2O – основание.
Слайд 12Na2HPO4= 2Na++HPO42-
HPO42-+H2O=PO43-+H3O+; Kк = 4,57*10-13
HPO42-+H2O=H2PO4-+OH-; Kо = 1,62*10-7
NaH2PO4 = 2Na+ + H2PO4-
H2PO4-+H2O=HPO42-+H3O+; Kк=6,17*10-8
H2PO4- +H2O=H3PO4+OH-; Kо=1,38*10-12
В растворе гидроортофосфата натрия среда щелочная, а в растворе дигидроортофосфата натрия - кислотная.
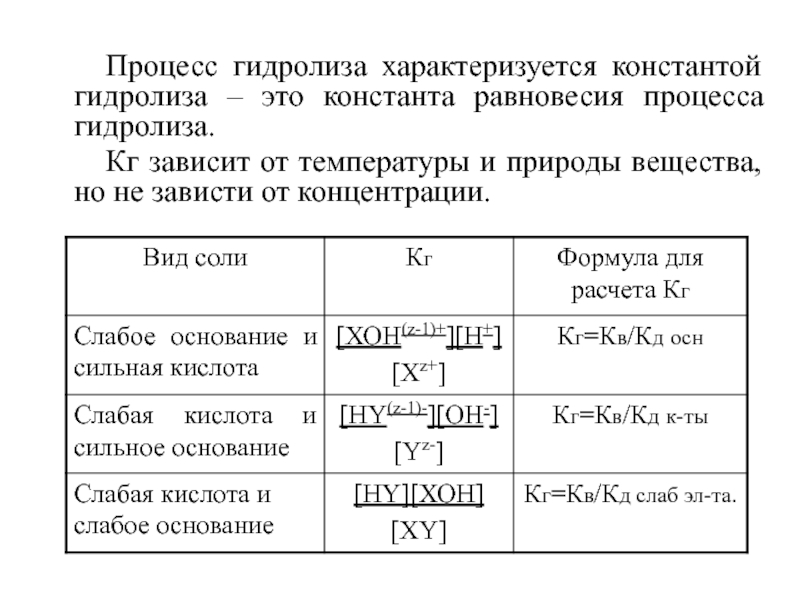
Слайд 13Процесс гидролиза характеризуется константой гидролиза – это константа равновесия процесса
гидролиза.
Кг зависит от температуры и природы вещества, но не
зависти от концентрации.
Слайд 14Глубина протекания гидролиза - степень гидролиза β, представляющая собой отношения
концентрации гидролизованных молекул Сгидр. К исходной концентрации растворенных молекул электролита
β = Сгидр/С.
Степень гидролиза увеличивается с увеличением температуры, т.к. процесс гидролиза процесс эндотермический.
При разбавлении раствора степень гидролиза увеличивается
β ≈ √Кгидр/Ссоли
Слайд 15 Для подавления гидролиза соли надо добавлять в
них при рН7 – сильное
основание.
Например, вводя добавку серной кислоты в раствор соли железа(III), снижают степень гидролиза соли.
Соли гидролизующиеся по разному типу, при смешивании в растворе взаимно усиливают гидролиз друг друга, т.к. их растворы имеют противоположные кислотно-основные характеры и нейтрализуются.
Например, в растворе А1С13 рН<7, а в растворе К2СО3>7. При их смешивании происходит связывание иона Н+ из первого раствора с ионами ОН- из второго раствора с образованием воды, и равновесие смещается в сторону полного разложения солей:
2А1С13 +3К2СО3 + 3НОН = 2А1(ОН)3 + 3СО2 +6КС1
2А13+ + 3СО32- + 3НОН = 2А1(ОН)3 + 3СО2
Этот процесс называется совместным гидролизом.
Слайд 16Расчет формул для определения рН раствора.
1) Для соли слабой кислоты
и сильного основания:
рН = 7 + ½ (lgСсоли +
рКк-ты).
2) Для соли слабого основания и сильной кислоты:
рН = 7 – 1/2 (lgСсоли – рКосн)
3) Для соли слабой кислоты и слабого основания
рН = 7 + ½ (рКк-ты –рКосн).
Слайд 17Пример
Рассчитать рН 0,1М раствора Nа2СО3.
Решение
СО32- +НОН ↔ НСО3-
+ ОН-
1) Найдем Кг=Кв/КдН2СО3=10-14/4,8*10-11=2*10-4.
2)Определим β= √Кг/См= √2*10-4/0,1=0,54
3) [ОН-] = β*См=0,54*0,1=0,054.
4)
рОН=-lg[OH-]=-lg0,054=1,62
5) рН = 14 – рОН = 14 –1,6 = 12,4.