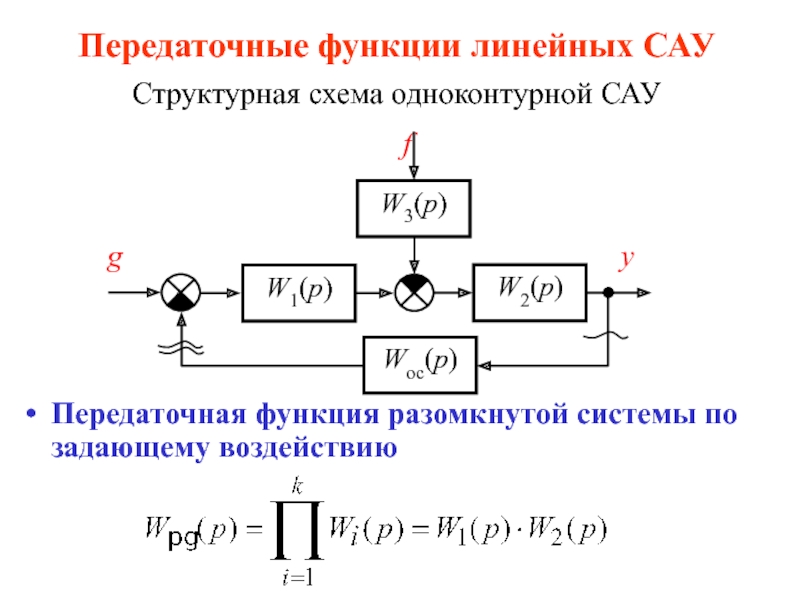
Слайд 1КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Неизменные группировки атомов могут взаимодействовать в растворе с ионами
металлов или нейтральными молекулами с образованием более сложных частиц.
Образовавшиеся
соединения имеют новые свойства.
Так, иодид ртути (II) взаимодействует в растворе с нитратом серебра: HgI2+2AgNO3=2AgI+Hg(NO3)2
После образования сложного соединения с иодидом калия:
HgI2 + 2KI = K2[HgI4], свойства иодида ртути(II) как индивидуального вещества исчезают.
Продукт состава K2[HgI4] обладает другими химическими свойствами, т.к. анион [HgI4]2- ведет себя в обменных реакциях как неразрывное целое:
K2[HgI4] + 2AgNO3 = Ag2[HgI4] + 2KNO3
Слайд 2Сложные вещества, полученные взаимодействием соединений первого порядка, но не путем
простого замещения в них одних компонентов на другие, называют соединениями
высшего порядка.
Сложные соединения, имеющие в своем составе устойчивые, не укладывающиеся в рамки формальной валентности комплексные группы с ковалентными связями, образованными по донорно-акцепторному механизму называются комплексными соединениями (координационными соединениями).
Слайд 3Координационная теория Вернера
Комплексное соединение состоит из двух
сфер – внешней и внутренней.
Внутреннюю сферу называют
комплексом.
Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют внешнюю сферу комплексного соединения.
Между комплексным ионом и внешней сферой – ионная связь. Внутри комплексного иона связи ковалентные донорно-акцепторные связи.
Внешнюю сферу составляют простые одноатомные или многоатомные ионы.
Комплексное соединение может состоят из нескольких внутренних сфер [Cu(NH3)4][PtCl6].
Слайд 4Виды комплексов
Катионный - результат координации вокруг положительно заряженного иона нейтральных
молекул (Н2О, NН3 и др.), например: [Сu(NН3)4]SО4.
Анионный – результат координации
вокруг положительно заряженного иона отрицательно заряженныхчастиц, например: К4[Fе(СN)6].
Нейтральный - результат координации вокруг атома молекул, а также при одновременной координации вокруг положительного иона отрицательных, например [Ni(СО)4]; [CoC13(NH3)3].
Заряд комплексной частицы численно равен заряду внешней сферы, но противоположен по знаку.
Например:
[Сu(NН3)4]SО4, заряд внешней сферы 2-, тогда заряд комплексной частицы равен 2+.
К4[Fе(СN)6], заряд внешней сферы равен (+1)*4 = +4, тогда заряд комплексной частицы равен 4-.
Слайд 5
Внутренняя сфера состоит из центрального атома (комплексообразователя), а вокруг
него находятся (координируются) лиганды.
M + n L =[MLn]
Комплексообразователями могут быть
нейтральные и заряженные частицы.
Нейтральный комплексообразователь:
[Cr(CO)6], [Fe(CO)4], [Ni(CO)4].
Положительный комплексообразователь:
[Ag(NH3)2]+, [SiF6]2-
Отрицательный комплексообоазователь:
[NH4]+
Слайд 6Характеристики центрального атома:
1)степень окисления (заряд атома)
Степень окисления
центрального атома - разность между зарядом комплекса и суммой зарядов
лигандов.
Например: [Сu(NН3)4]2+
Лиганды - нейтральные молекулы воды. Заряд комплексу придает центральный атом, т.е. степень окисления меди равна +2.
[Fе(СN)6]4-
СОFе = заряд иона – Σзарядов лигандов = -4–6*(-1) =+2.
Слайд 72) Координационное число (КЧ) - количество химических связей, которые комплексообразователь
образует с лигандами.
Определяется строением электронной оболочки и обусловливается валентными возможностями
центрального атома.
Если комплексообразователь координирует монодентатные (односвязевые) лиганды, то координационное число равно числу присоединяемых лигандов.
Если комплексообразователь координирует полидентатные (многосвязевые) лиганды, то число лигандов меньше значения координационного числа.
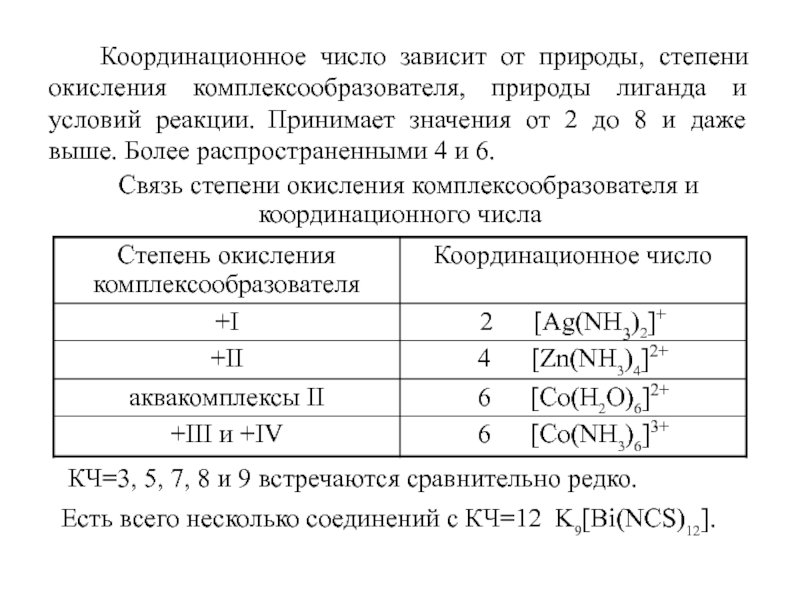
Слайд 8 Координационное число зависит от природы, степени окисления комплексообразователя,
природы лиганда и условий реакции. Принимает значения от 2 до
8 и даже выше. Более распространенными 4 и 6.
Связь степени окисления комплексообразователя и координационного числа
КЧ=3, 5, 7, 8 и 9 встречаются сравнительно редко.
Есть всего несколько соединений с КЧ=12 K9[Bi(NCS)12].
Слайд 9 Лиганды не связаны друг с другом, и
между ними действуют силы отталкивания.
Лиганды различаются:
1) По заряду.
Лигандами
могут быть нейтральные молекулы и отрицательно заряженные ионы (NH3, H2O, СО, NO, ОН-, Cl-, NO2-, CN-, SO42- и др.). Все лиганды обязательно обладают неподеленными электронными парами.
2) По активности.
По силе лиганды можно расположить в ряд:
CN-> NO2-> NH3>SCN-> H2O> F-> ОН-> Cl-
Более сильный лиганд способен вытеснять слабый из комплекса.
Слайд 103) По координационной емкости
Координационная емкость лиганда – число
мест, занимаемых каждым лигандом во внутренней сфере комплекса.
Лиганды, занимающие одно координационное место у центрального атома, называют мондентантными.
Он связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
Каждая молекула бидентатногобидентатного лиганда образуетс комплексообразователем
две химические связи.
Например, оксалат-ион С2O42-
Слайд 11
В комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32- образует
две связи с комплексообразователем – условным ионом Co(III), а каждая
молекула лиганда NH3 – только одну связь.
Слайд 12 Лиганды, способные образовывать две и более связи называются
полидентантными.
Пример гексадентатного лиганда - анион этилендиаминтетрауксусной кислоты:
Этот тип
лигандов способен несколькими связями, пространственно отдаленными друг от друга, вцепляться в центральный атом и называются хелатными, ''клешнеобразными''.
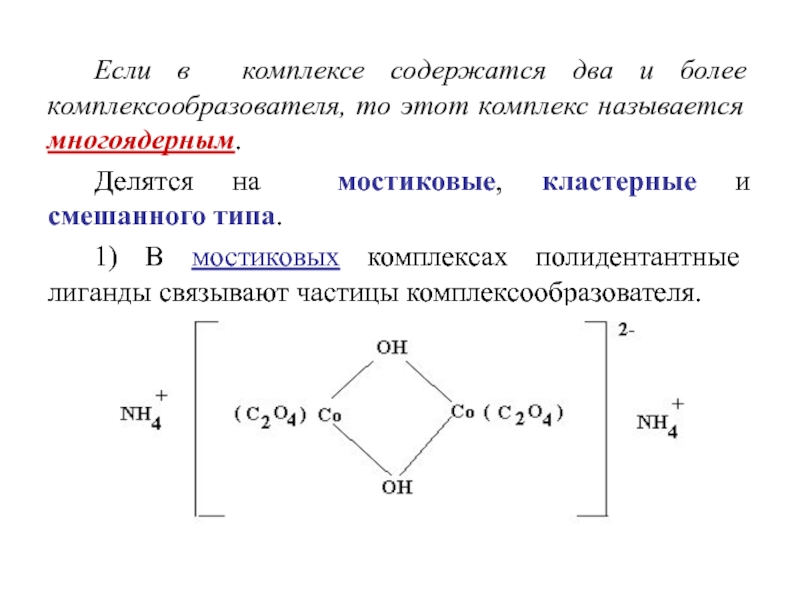
Слайд 13Если в комплексе содержатся два и более комплексообразователя, то этот
комплекс называется многоядерным.
Делятся на мостиковые, кластерные и смешанного типа.
1)
В мостиковых комплексах полидентантные лиганды связывают частицы комплексообразователя.
Слайд 14 2) Если атомы комплексообразователя связаны между собой непосредственно, то
комплекс относят к кластерному типу.
Например, [Re2Cl8]2-:
3)
Многоядерные комплексы смешанного типа содержат как связь комплексообразователь–комплексообразователь, так и мостиковые лиганды.
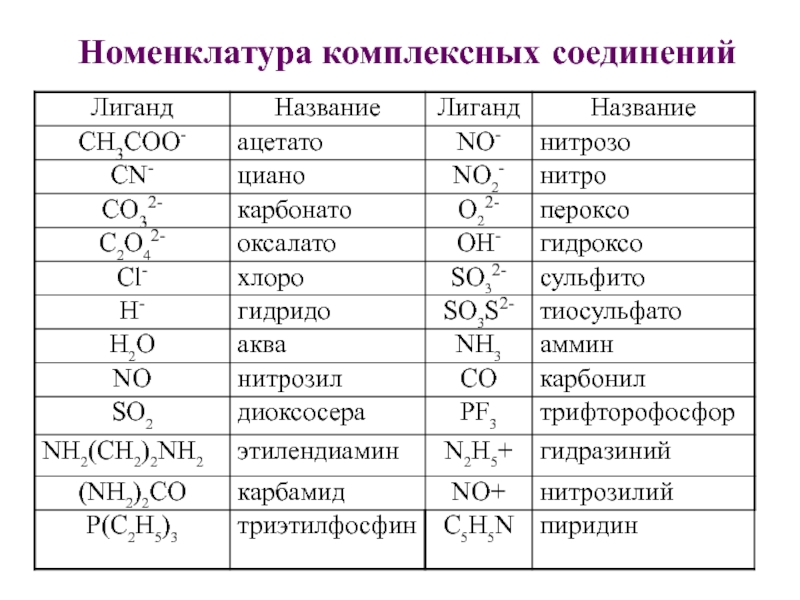
Слайд 15Номенклатура комплексных соединений
Слайд 16Комплексные соединения с комплексным анионом.
Указывается число и название лиганда, комплексообразователь
по латински с окончанием -ат (феррат, никелат, хромат, купрат). Число
лигандов в комплексе обозначают греческими приставками ди, три, тетра, пента, гекса и т.д. Степень окисления металла в комплексе указывается в скобках после названия комплекса:
Na[Al(OH)4] – Тетрагидроксоалюминат натрия
K2[PtCl6] – Гексахлороплатинат (IV) калия
Ag - аргент- ; Au - аур- ; Cu - купр- ; Fe - ферр- ; Hg - меркур- ; Mn - манган- ; Ni - никкол- ; Pb - плюмб- ; Sb - стиб- ; Sn - станн-.
Слайд 17Комплексные соединения с комплексным катионом.
Сначала указывается название аниона,
затем число и названия лиганда и комплексообразователя по-русски в родительном
падеже (для многоядерных комплексов – с указанием их числа). Обозначение степени окисления комплексообразователя дают римскими цифрами в скобках после названия:
[Zn(NH3)4]Cl2 – хлорид тетраамминоцинка.
[Сu(H2O)6]SO4– сульфат гексааквомеди(II)
Слайд 18Нейтральные комплексы
Названия состоят из одного слова.
Указывается число и названия
лигандов (для лигандов каждого вида отдельно), затем название центрального атома
в именительном падеже (в случае многоядерных комплексов – с указанием числа центральных атомов).
Например:
[СоС13(Н2О)3] – триакватрихлорокобальт (III)
[Cr2(CO)8] – октакарбонилдихром
Слайд 19Многоядерные комплексы
Названию мостиковых групп предшествует греческая буква
μ, которая повторяется перед названием мостикового лиганда каждого вида.
Сначала
называют мостиковые в порядке их усложнения, затем не мостиковые, а после этого – комплексообразователи с указанием их числа.
Например:
[(NH3)5Co – NH – Co(NH3)5]Cl5
хлорид (μ-амидо)-декаамминодикобальта(III)
или
хлорид (μ-амидо)-бис{пентаамминокобальта(III)}
Слайд 20Геометрические изомеры
Приставка цис-, если одинаковые по составу лиганды занимают соседнее
положение по отношению к комплексообразователю.
Транс-, когда лиганды находятся в противоположных
положениях.
Например, дихлородиамминоплатина(II)
[Pt(NH3)2Cl2]0 имеет два геометрических изомера:
В случае оптических изомеров к названию добавляется латинская буква L в случае левовращающих изомеров или D – для правовращающих
Слайд 22Изомерия комплексных соединений
Изомерия - способность веществ образовывать
несколько соединений одинакового состава, отличающихся взаимным расположением атомов в молекуле,
а следовательно, различных по свойствам.
Изомерия лигандов
а)связевая - определяется разным типом координации одного и того же лиганда
Например, [Ag(CN)2]- через С и [Ag(CN)2]- через N
б) изомерия лиганда
Например, [Ag(CN)2]- и [Ag(NC)2]-
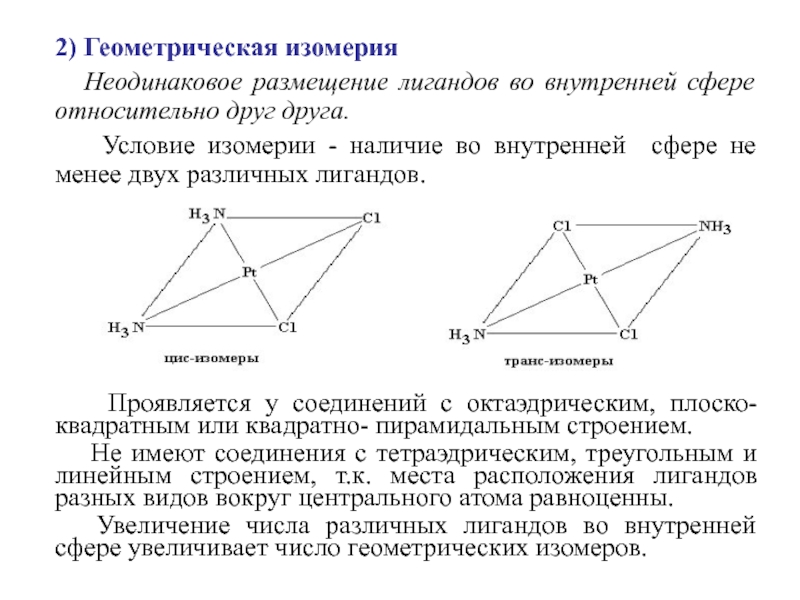
Слайд 232) Геометрическая изомерия
Неодинаковое размещение лигандов во внутренней сфере
относительно друг друга.
Условие изомерии - наличие во
внутренней сфере не менее двух различных лигандов.
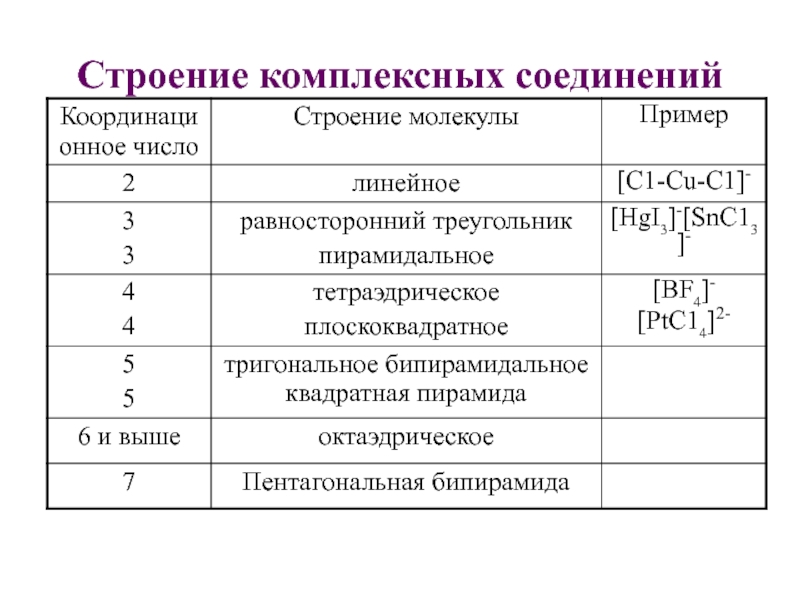
Проявляется у соединений с октаэдрическим, плоско-квадратным или квадратно- пирамидальным строением.
Не имеют соединения с тетраэдрическим, треугольным и линейным строением, т.к. места расположения лигандов разных видов вокруг центрального атома равноценны.
Увеличение числа различных лигандов во внутренней сфере увеличивает число геометрических изомеров.
Слайд 243) Оптическая изомерия (зеркальная изомерия).
Способность комплексных соединений существовать
в виде двух форм, не совмещаемых в трехмерном пространстве и
являющихся зеркальным отображением друг друга.
Их растворы способны вращать плоскость поляризации светового луча: один изомер вращает плоскость поляризации влево (L-изомер), другой – вправо (D-изомер).
По физико-химическим свойствам оптические изомеры не отличаются друг от друга. Оптическая изомерия чаще всего встречается у комплексных соединений с координационным числом 6.
Слайд 254) Сольватная (гидратная) изомерия
Различное распределение молекул растворителя между внутренней и
внешней сферами комплексного соединения.
Например, CrCl3* 6H2O.
Первый изомер, [Cr(H2O)6]Cl3 при растворении
в воде образуют фиолетовый раствор. Из раствора под действием ионов Ag+ осаждаются все три хлорид-аниона:
[Cr(H2O)6]Cl3 + 3AgNO3 = [Cr(H2O)6](NO3)3 + 3AgCl
Второй изомер, [Cr(H2O)5Cl]Cl2*H2O придает раствору голубовато-зеленый цвет, а ионы Ag+ осаждают два С1-:
[Cr(H2O)5Cl]Cl2 + 2AgNO3=[Cr(H2O)5Cl](NO3)2+2 AgCl
Третий изомер, [Cr(H2O)4Cl2]Cl*2H2O окрашивает раствор в темно-зеленый цвет, а ионы Ag+ осаждают один С1-: [Cr(H2O)4Cl2]Cl+AgNO3=[Cr(H2O)4Cl2]NO3+AgCl
Изменяя pH либо температуру раствора можно добиться постепенного взаимного перехода изомеров.
Слайд 265) Ионная изомерия
Различное распределение заряженных лигандов между внешней и
внутренней сферами комплексного соединения.
Ионные изомеры по-разному диссоциируют в водном растворе.
Например, [Co(NH3)4Cl2]NO3 при растворении диссоциирует на ионы:
[Co(NH3)4Cl2]NO3 = [Co(NH3)4Cl2]+ + NO3-
При добавлении к такому раствору AgNO3 осадка хлорида серебра не образуется.
Его ионный изомер [Co(NH3)4Cl(NO3)]Cl при растворении в воде диссоциирует иначе:
[Co(NH3)4Cl(NO3)]Cl = [Co(NH3)4Cl(NO3)]+ + Cl-
Из этого раствора при добавлении AgNO3 выделяется осадок AgCl.
Слайд 27Устойчивость комплексных соединений
Делятся на электролиты и
неэлектролиты.
К неэлектролитам относят прежде всего внутрикомплексные соединения
(хелаты), карбонилы металлов и p-комплексы и др.
Растворимые комплексные соединения, не имеющие внешней сферы, ведут себя в растворах как слабые электролиты.
Комплексные соединения, имеющие ионную внешнюю сферу, в растворе подвергаются диссоциации.
Слайд 28Диссоциация имеет два этапа:
1) ведут себя
как сильные электролиты, т.е. полностью диссоциируют на внутреннюю и внешнюю
сферы.
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
Комплексные основания и кислоты являются сильными электролитами.
2) комплексные ионы диссоциируют как слабые электролиты в незначительной степени, обратимо и ступенчато.
На каждой ступени комплекс отщепляет одну частицу –лиганд. Новый уменьшенный комплекс на следующей стадии снова отщепляет один лиганд и т. д.
[Fe(CN)6]3-↔[Fe(CN)5]2-+СΝ-
........................................................................................................
[FeCN]2+ ↔ Fe3+ + СΝ-
Слайд 29 Процесс комплексообразования завершается, когда у комплексообразователя исчерпаны все
валентные возможности.
Присоединения лигандов происходит ступенчато.
Полная константа
образования комплекса Кn(обр) характеризует устойчивость комплексного соединения: чем она больше, тем более устойчив комплекс данного состава.
Например,
Ag+ + 2NH3 =[Ag(NH3)2]+; К1(обр) = 2,5*106
Ag+ + 2CN- =[Ag(CN)2]-; К2(обр) = 1,2*1021
К2(обр) > К1(обр) более прочен второй комплекс.
Кn(обр) = K1(обр) * K2(обр) * K3(обр) * … * Kn(обр)
Слайд 30 Процесс диссоциации характеризуется величиной константой нестойкости.
Kn(обр)=1/Kn(нест)
Константа нестойкости характеризует устойчивость комплексного иона
в водной среде.
[Fe(CN)6]3-↔Fe3++6СΝ- Кнест=[Fe3+]*[СΝ-]6/[[Fe(CN)6]3-]
Чем ниже константа нестойкости, тем стабильнее комплекс.
Прочность комплексных ионов возрастает с увеличением степени окисления металла.
Металлы побочных подгрупп дают более прочные комплексы, чем металлы главных подгрупп. Прочность комплекса возрастает с увеличением силы лиганда.
Слайд 31Примеры образования и разрушения комплексов
1) Желтый раствор FeCl3 обесцвечивается при
добавлении КF из-за реакции:
[Fe(H2O)6]3+ + 6F- =[FeF6]3- + 6H2O
Кнест[Fe(H2O)6]3+> Кнест
[FeF6]3-
2) Осадок гидроксида меди(II) растворяется в гидроксиде аммиака из-за реакции:
Cu(OH)2+4NH3*H2O= [Cu(NH3)4]2++2OH-+4H2O
ПРСu(OH)2>Кнест [Cu(NH3)4]2+
А при добавлении сульфида аммония выпадает черный осадок СuS из-за реакции:
[Cu(NH3)4](OH)2+(NH4)2S+4H2O=CuS(т)+6NH3*H2O
Кнест [Cu(NH3)4]2+ > ПРСuS
Слайд 323) Реакция:
[Ag(NH3)2]Cl+2KCN+2H2O=K[Ag(CN)2]+KCl+2NH3*H2O
необратима,
т.к. Кнест[Ag(NH3)2]Cl>КнестK[Ag(CN)2]
значит, что комплексный ион [Ag(CN)2]- прочнее,
чем [Ag(NH3)2]+.
Устойчивость комплексных соединений зависит от прочности
химической связи между комплексообразователем и лигандами.
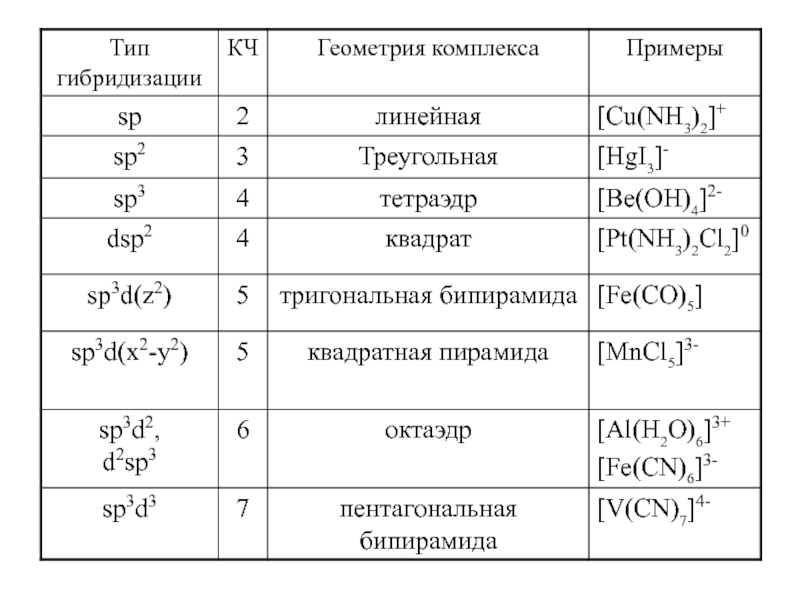
Слайд 33Теория валентных связей
1) Лиганд – донор электронов.
2)Комплексообразователь –акцептор электронов.
3)
Пустые орбитали внешнего энергетического уровня комплексообразователя подвергаются гибридизации.
4) Число гибридных
орбиталей комплексообразователя равно КЧ.
5) Валентные орбитали комплексообразователя близки по энергии: E(n-1)d » Ens » Enp » End.
6) Для высвобождения орбиталей для гибридизации неспаренные электроны могут спариваться.
7) Неподеленные пары электронов лигандов взаимодействуют с гибридными орбиталями комплексообразователя.
8) Электронные пары комплексообразователя взаимодействуют с вакантными атомными орбиталями лиганда (дативный механизм).
9) Электронные пары на гибридных орбиталях комплексообразователя, располагаются так, чтобы их взаимное отталкивание было минимально.
Слайд 34Например, [Zn(NH3)4]2+
Электронная конфигурация Zn2+ 3d104s04p0 :
Орбитали атомов азота, содержащие не
поделенные пары электронов, перекрываются с sp3-гибридными орбиталями цинка(II).
Слайд 35Образуется тетраэдрический комплексный ион тетрааммионцинка(II) [Zn(NH3)4]2+:
В
ионе [Zn(NH3)4]2+ нет не спаренных электронов, то он проявляет диамагнитные
свойства.
Слайд 36 Ион [MnCl4]2- содержит пять не спаренных электронов
на 3d-орбитали и вакантные 4s- и 4p-орбитали. Вакантные орбитали образуют
sp3-гибридные орбитали, которые перекрываются с p-атомными орбиталями хлорид-ионов:
Тетраэдрический ион [MnCl4]2- является парамагнитным, так как содержит пять не спаренных электронов.
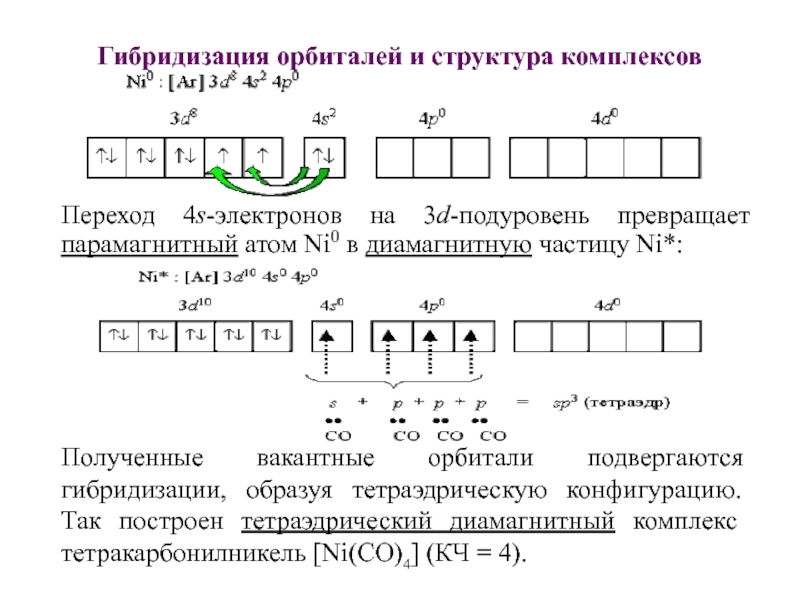
Слайд 37Гибридизация орбиталей и структура комплексов
Переход 4s-электронов на 3d-подуровень превращает парамагнитный
атом Ni0 в диамагнитную частицу Ni*:
Полученные вакантные орбитали подвергаются
гибридизации, образуя тетраэдрическую конфигурацию. Так построен тетраэдрический диамагнитный комплекс тетракарбонилникель [Ni(CO)4] (КЧ = 4).
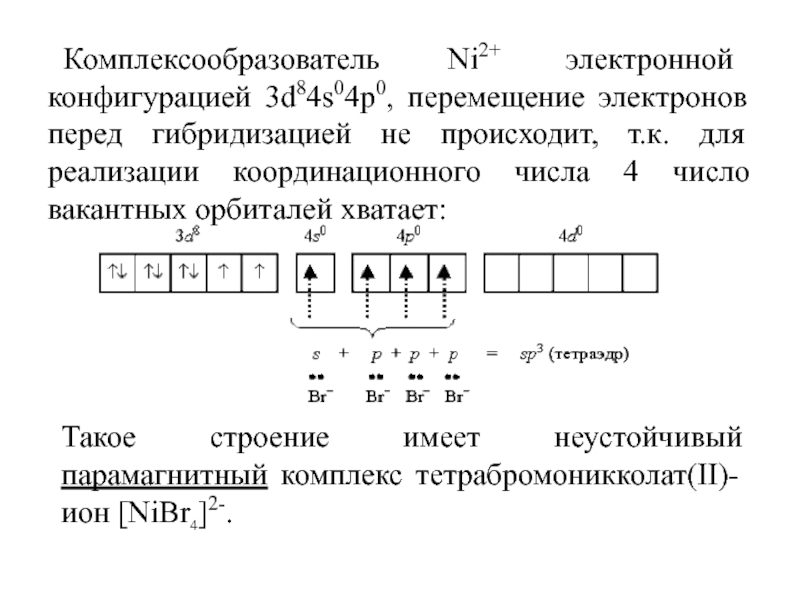
Слайд 38Комплексообразователь Ni2+ электронной конфигурацией 3d84s04p0, перемещение электронов перед гибридизацией не
происходит, т.к. для реализации координационного числа 4 число вакантных орбиталей
хватает:
Такое строение имеет неустойчивый парамагнитный комплекс тетрабромоникколат(II)-ион [NiBr4]2-.
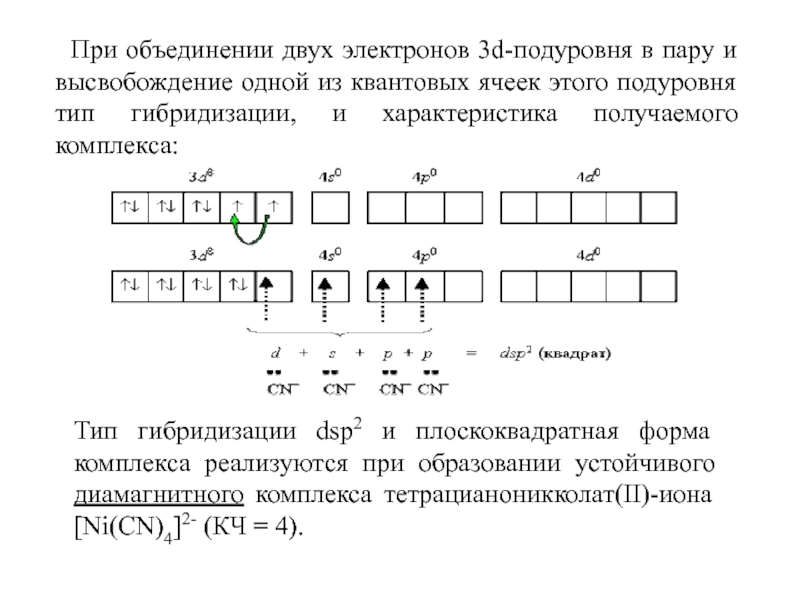
Слайд 39При объединении двух электронов 3d-подуровня в пару и высвобождение одной
из квантовых ячеек этого подуровня тип гибридизации, и характеристика получаемого
комплекса:
Тип гибридизации dsp2 и плоскоквадратная форма комплекса реализуются при образовании устойчивого диамагнитного комплекса тетрацианоникколат(II)-иона [Ni(CN)4]2- (КЧ = 4).
Слайд 41 Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, то
комплекс парамагнитен и называется внешнеорбитальным и высокоспиновым.
Это отвечает типу
гибридизации, например, sp3d2.
Если в гибридизации участвуют атомные орбитали предвнешнего d-подуровня, то комплекс внутриорбитальный и низкоспиновый.
Они диамагнитны или слабо парамагнитны Это отвечает типу гибридизации, например, d2sp3 или dsp2.
Слайд 42 Гексафтороферрат(II)-ион [FeF6]4- - парамагнитный высокоспиновый
Слайд 43 Гексацианоферрат(II)-ион [Fe(CN)6]4- - диамагнитный низкоспиновый .
Недостатки теории валентных связей:
Не
определяет вид комплекса в каждом случае;
Не учитывает влияния природы лиганда.
Слайд 44Теория кристаллического поля
1)Химическая связь комплексообразователь – лиганд считается электростатической.
2)Лиганды
располагаются вокруг комплексообразователя в вершинах правильных многогранников в виде точечных
зарядов.
3) Реальный объем лиганда не учитывается.
4) Лиганды создают вокруг комплексообразователя электростатическое поле.
5) Под действием поля энергетические уровни комплексообразователя, прежде всего d-подуровни, расщепляются, и их энергия изменяется.
Слайд 45Октаэдрическое расположение лигандов
В центре октаэдра атом-комплексообразователь с электронами на d-атомных
орбиталях.
В его вершинах – лиганды в виде точечных отрицательных
зарядов.
В условном ионе комплексообразователя, не связанном с лигандами, энергии всех пяти d-АО одинаковы.
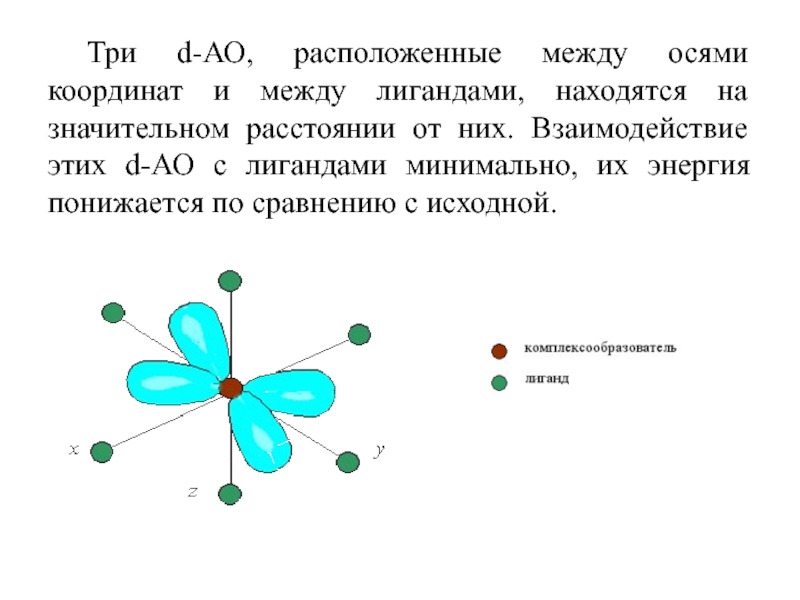
Слайд 46 Атомные орбитали, вытянутые вдоль осей координат, ближе всего
подходят к лигандам. Между ними и лигандами возникают силы отталкивания,
приводящие к увеличению энергии орбиталей.
Слайд 47Три d-АО, расположенные между осями координат и между лигандами, находятся
на значительном расстоянии от них. Взаимодействие этих d-АО с лигандами
минимально, их энергия понижается по сравнению с исходной.
Слайд 48Пять одинаковых d-АО комплексообразователя, попадая в поле лигандов, подвергаются расщеплению
на две группы новых орбиталей – с более низкой энергией,
d(xy), d(xz) и d(yz), и с более высокой энергией, d(z2) и d(x2-y2).
АО с более низкой энергией обозначаются dε.
АО с более высокой энергией обозначают dγ.
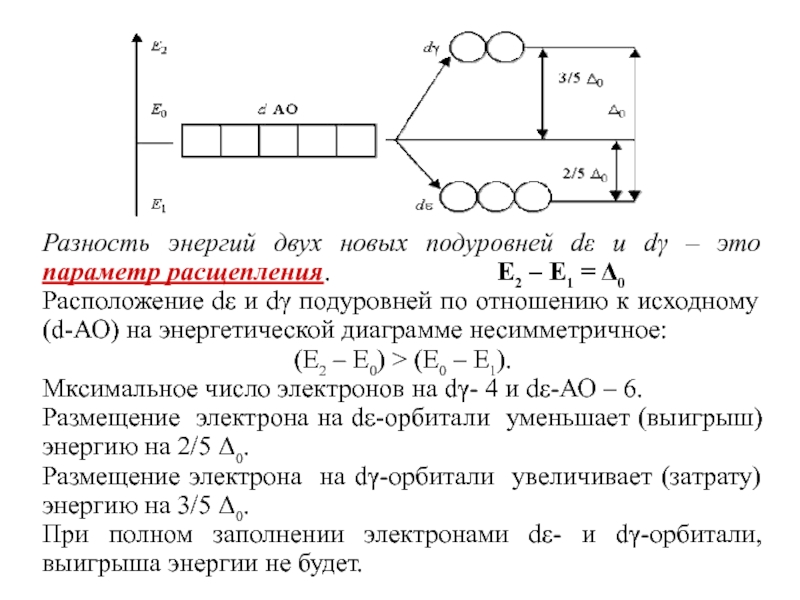
Слайд 49Разность энергий двух новых подуровней dε и dγ – это
параметр расщепления.
E2 – E1 = Δ0
Расположение dε и dγ подуровней по отношению к исходному (d-АО) на энергетической диаграмме несимметричное:
(Е2 – Е0) > (Е0 – Е1).
Мксимальное число электронов на dγ- 4 и dε-АО – 6.
Размещение электрона на dε-орбитали уменьшает (выигрыш) энергию на 2/5 Δ0.
Размещение электрона на dγ-орбитали увеличивает (затрату) энергию на 3/5 Δ0.
При полном заполнении электронами dε- и dγ-орбитали, выигрыша энергии не будет.
Слайд 50Выигрыш энергии за счет заселения электронами dε-атомных орбиталей называют энергией
стабилизации комплекса полем лигандов.
Чем сильнее поле лигандов, чем больше значение
параметра расщепления Δ0.
Δ0 зависит от степени окисления и природы комплексообразователя. С ростом степени окисления комплексообразователя и его заряда значение Δ0 увеличивается.
Спектрохимический ряд, вдоль которого значение Δ0 монотонно растет:
I-
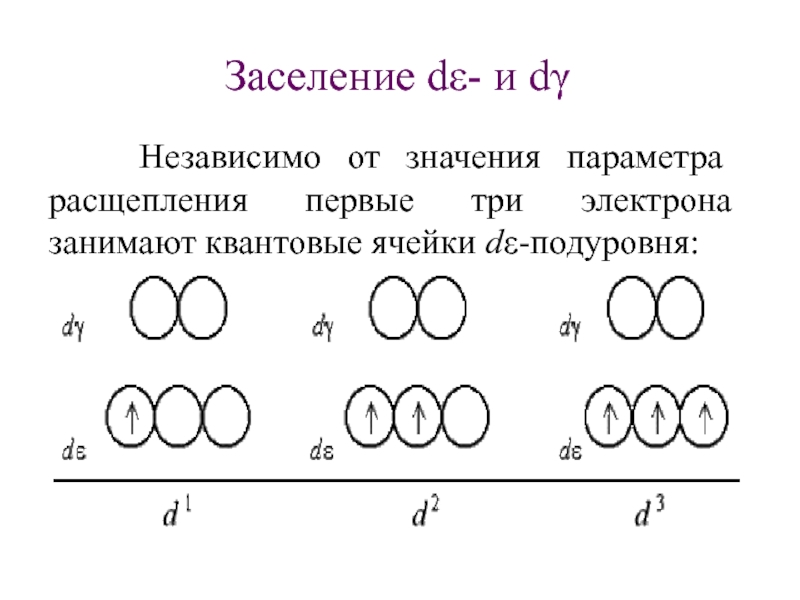
Слайд 51Заселение dε- и dγ
Независимо от значения
параметра расщепления первые три электрона занимают квантовые ячейки dε-подуровня:
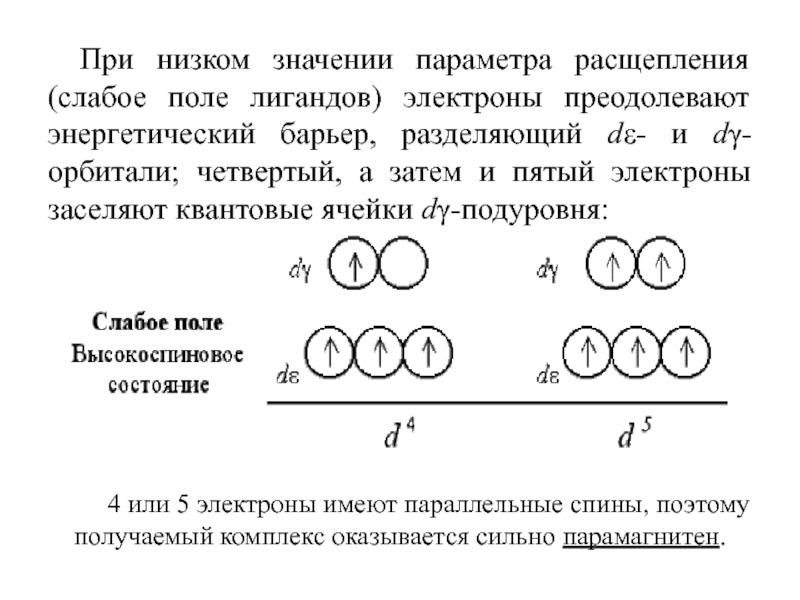
Слайд 52При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают
энергетический барьер, разделяющий dε- и dγ-орбитали; четвертый, а затем и
пятый электроны заселяют квантовые ячейки dγ-подуровня:
4 или 5 электроны имеют параллельные спины, поэтому получаемый комплекс оказывается сильно парамагнитен.
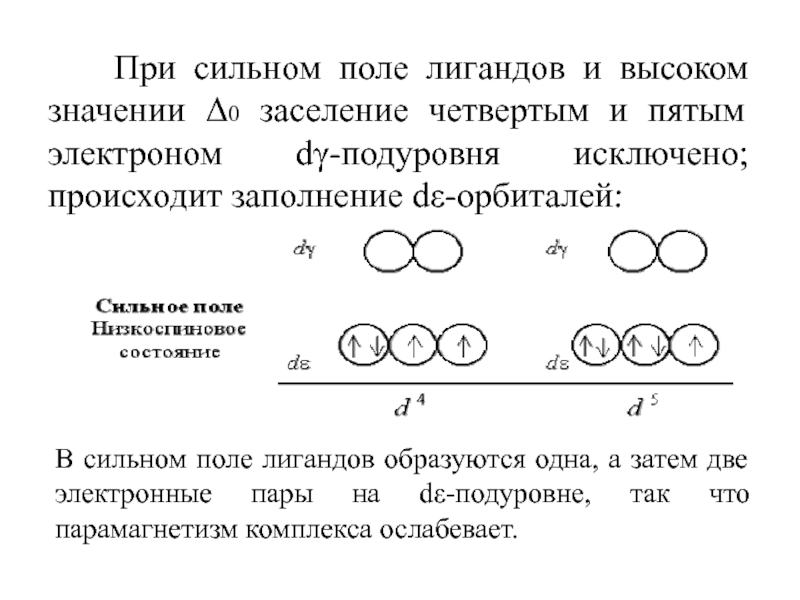
Слайд 53 При сильном поле лигандов и высоком значении Δ0
заселение четвертым и пятым электроном dγ-подуровня исключено; происходит заполнение dε-орбиталей:
В сильном поле лигандов образуются одна, а затем две электронные пары на dε-подуровне, так что парамагнетизм комплекса ослабевает.
Слайд 54Шестой, седьмой и восьмой электроны в случае слабого поля оказываются
снова на dε-подуровне, дополняя конфигурации до электронных пар (одной в
случае d6, двух – d7 и трех – d8):
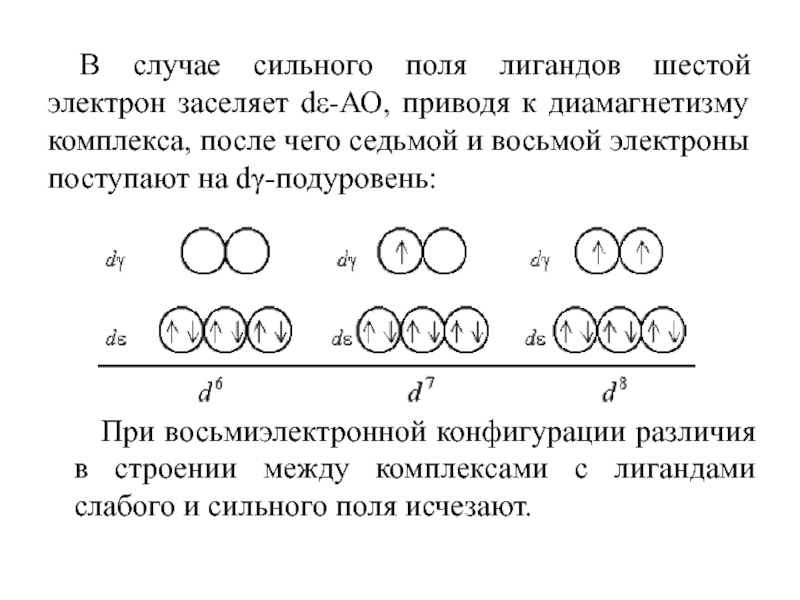
Слайд 55В случае сильного поля лигандов шестой электрон заселяет dε-АО, приводя
к диамагнетизму комплекса, после чего седьмой и восьмой электроны поступают
на dγ-подуровень:
При восьмиэлектронной конфигурации различия в строении между комплексами с лигандами слабого и сильного поля исчезают.
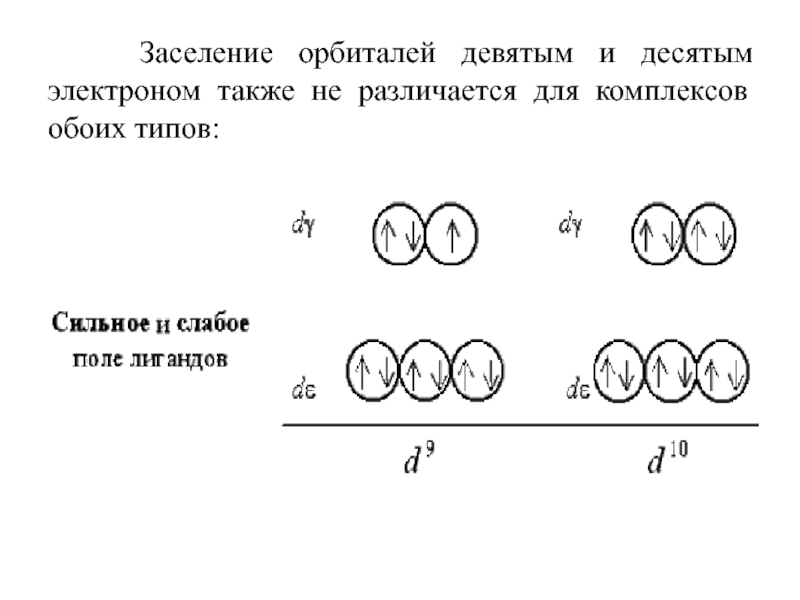
Слайд 56 Заселение орбиталей девятым и десятым электроном также не
различается для комплексов обоих типов:
Слайд 57 Строение октаэдрического комплексного ионов [CoF6]3-. Фторид-ион F- –
лиганд слабого поля.
Комплексный ион является высокоспиновым и содержит четыре
не спаренных электрона, поэтому он парамагнитен.
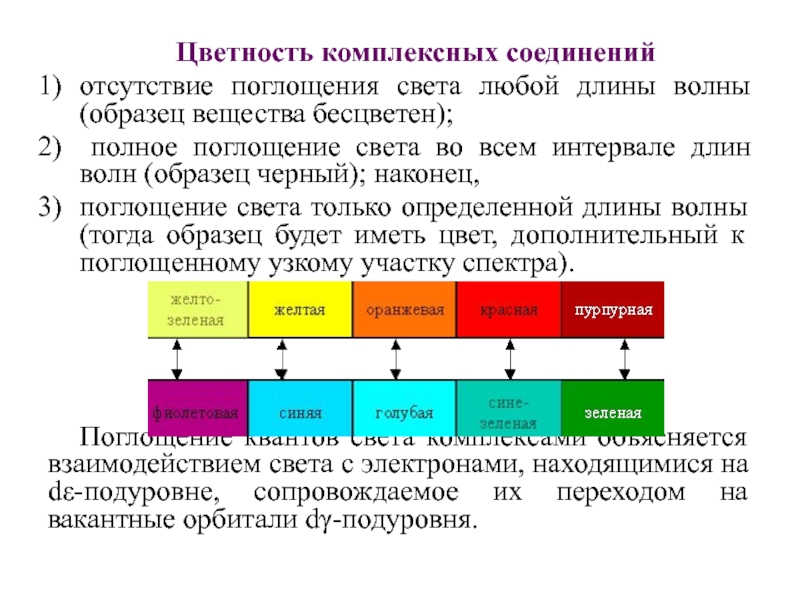
Слайд 58Цветность комплексных соединений
отсутствие поглощения света любой длины волны (образец вещества
бесцветен);
полное поглощение света во всем интервале длин волн (образец
черный); наконец,
поглощение света только определенной длины волны (тогда образец будет иметь цвет, дополнительный к поглощенному узкому участку спектра).
Поглощение квантов света комплексами объясняется взаимодействием света с электронами, находящимися на dε-подуровне, сопровождаемое их переходом на вакантные орбитали dγ-подуровня.
Слайд 59Например, при пропускании света через водный раствор, содержащий [Ti(H2O)6]3+, обнаруживается
полоса поглощения света в желто-зеленой области спектра (20300см-1, λ ~
500нм).
Поэтому раствор, содержащий [Ti(H2O)6]3+, приобретает фиолетовый цвет (дополнительный к поглощенному желто-зеленому).
Слайд 60 Избирательность поглощения света зависит:
от степени окисления комплексообразователя;
от вида
лигандов.
При замене в комплексном соединении лигандов, находящихся в левой
части спектрохимического ряда, на лиганды, создающие сильное электростатическое поле, наблюдается увеличение доли энергии, поглощаемой электронами из проходящего света и как следствие – уменьшение длины волны соответствующей полосы поглощения.



![Комплексные соединения.ppt Виды комплексовКатионный - результат координации вокруг положительно заряженного иона нейтральных молекул Виды комплексовКатионный - результат координации вокруг положительно заряженного иона нейтральных молекул (Н2О, NН3 и др.), например: [Сu(NН3)4]SО4.Анионный](/img/thumbs/7c130224864f1c0e43e79c41888fd177-800x.jpg)





![Комплексные соединения.ppt В комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32- образует две В комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32- образует две связи с комплексообразователем – условным ионом](/img/thumbs/8a2fb2dd540b865fcdb592a4a939a8fe-800x.jpg)

![Комплексные соединения.ppt 2) Если атомы комплексообразователя связаны между собой непосредственно, то комплекс 2) Если атомы комплексообразователя связаны между собой непосредственно, то комплекс относят к кластерному типу. Например, [Re2Cl8]2-:](/img/thumbs/34bf3687ddbfc4028cc8694ff9a5b6fd-800x.jpg)













![Комплексные соединения.ppt Примеры образования и разрушения комплексов1) Желтый раствор FeCl3 обесцвечивается при добавлении Примеры образования и разрушения комплексов1) Желтый раствор FeCl3 обесцвечивается при добавлении КF из-за реакции:[Fe(H2O)6]3+ + 6F- =[FeF6]3-](/img/thumbs/2e07774bcc20d0b03f641b30531d92e1-800x.jpg)
![Комплексные соединения.ppt 3) Реакция:[Ag(NH3)2]Cl+2KCN+2H2O=K[Ag(CN)2]+KCl+2NH3*H2Oнеобратима, т.к. Кнест[Ag(NH3)2]Cl>КнестK[Ag(CN)2] значит, что комплексный ион [Ag(CN)2]- прочнее, чем 3) Реакция:[Ag(NH3)2]Cl+2KCN+2H2O=K[Ag(CN)2]+KCl+2NH3*H2Oнеобратима, т.к. Кнест[Ag(NH3)2]Cl>КнестK[Ag(CN)2] значит, что комплексный ион [Ag(CN)2]- прочнее, чем [Ag(NH3)2]+. Устойчивость комплексных соединений](/img/thumbs/c9c5cee78117ba640c0be605ce040df6-800x.jpg)

![Комплексные соединения.ppt Например, [Zn(NH3)4]2+Электронная конфигурация Zn2+ 3d104s04p0 :Орбитали атомов азота, содержащие не поделенные Например, [Zn(NH3)4]2+Электронная конфигурация Zn2+ 3d104s04p0 :Орбитали атомов азота, содержащие не поделенные пары электронов, перекрываются с sp3-гибридными орбиталями](/img/thumbs/84fbaddf7e2095e9b5d56bd3582bcdb9-800x.jpg)
![Комплексные соединения.ppt Образуется тетраэдрический комплексный ион тетрааммионцинка(II) [Zn(NH3)4]2+: В ионе [Zn(NH3)4]2+ нет Образуется тетраэдрический комплексный ион тетрааммионцинка(II) [Zn(NH3)4]2+: В ионе [Zn(NH3)4]2+ нет не спаренных электронов, то он](/img/thumbs/0f63ff865205cdc5ebfda5128a6b9f85-800x.jpg)
![Комплексные соединения.ppt Ион [MnCl4]2- содержит пять не спаренных электронов на 3d-орбитали Ион [MnCl4]2- содержит пять не спаренных электронов на 3d-орбитали и вакантные 4s- и 4p-орбитали.](/img/thumbs/b1ec3b7bc471055126281c5811c1de50-800x.jpg)

![Комплексные соединения.ppt Гексафтороферрат(II)-ион [FeF6]4- - парамагнитный высокоспиновый Гексафтороферрат(II)-ион [FeF6]4- - парамагнитный высокоспиновый](/img/thumbs/1673344114035bae5ea0e9049731ee0a-800x.jpg)
![Комплексные соединения.ppt Гексацианоферрат(II)-ион [Fe(CN)6]4- - диамагнитный низкоспиновый .Недостатки теории валентных связей:Не определяет Гексацианоферрат(II)-ион [Fe(CN)6]4- - диамагнитный низкоспиновый .Недостатки теории валентных связей:Не определяет вид комплекса в каждом случае;Не учитывает](/img/thumbs/0361a03820af4a0522b51bb3404702e9-800x.jpg)






![Комплексные соединения.ppt Строение октаэдрического комплексного ионов [CoF6]3-. Фторид-ион F- – лиганд слабого Строение октаэдрического комплексного ионов [CoF6]3-. Фторид-ион F- – лиганд слабого поля. Комплексный ион является высокоспиновым](/img/thumbs/c952cc686def3def9aae0934bf61ccac-800x.jpg)
![Комплексные соединения.ppt Например, при пропускании света через водный раствор, содержащий [Ti(H2O)6]3+, обнаруживается полоса Например, при пропускании света через водный раствор, содержащий [Ti(H2O)6]3+, обнаруживается полоса поглощения света в желто-зеленой области спектра](/img/thumbs/cad485da5ea08ab233e0705d7df1af96-800x.jpg)