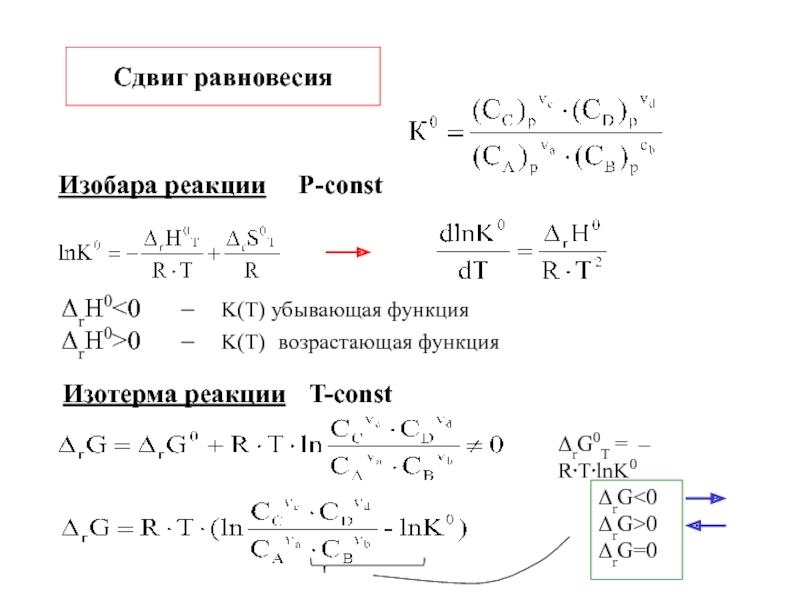
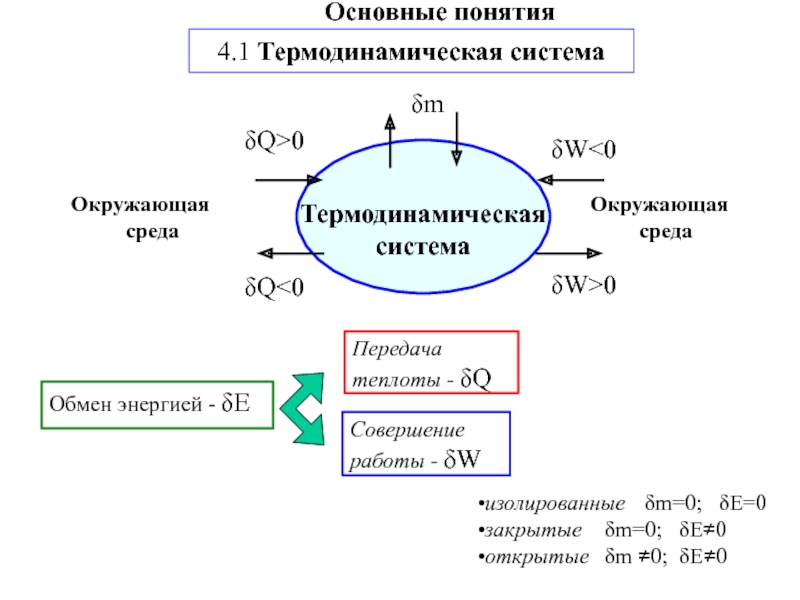
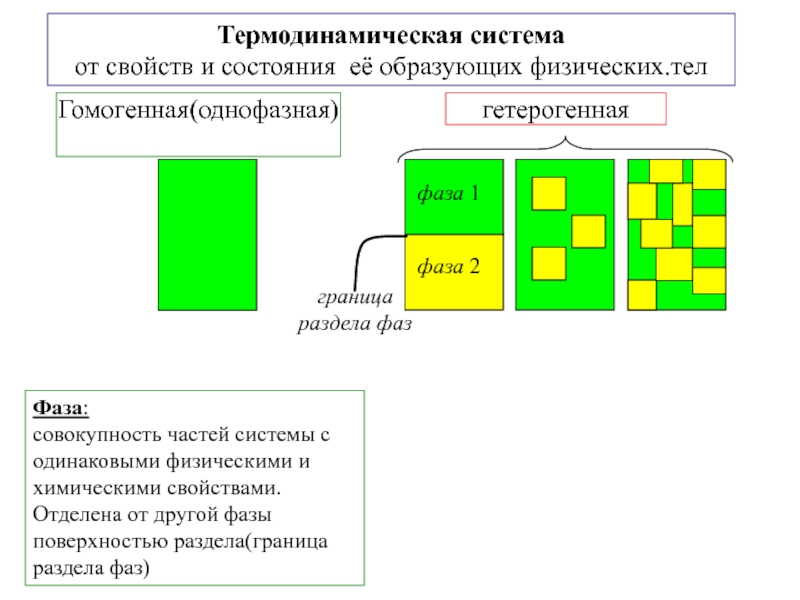
другую, от одной части системы к другой
Химическая термодинамика -
термодинамика
химических процессов.Описывает статистически значимые процессы (большое число частиц)
энергетические эффекты, сопровождающие физические и химические процессы
возможность, направления и предел самопроизвольного протекания процессов.


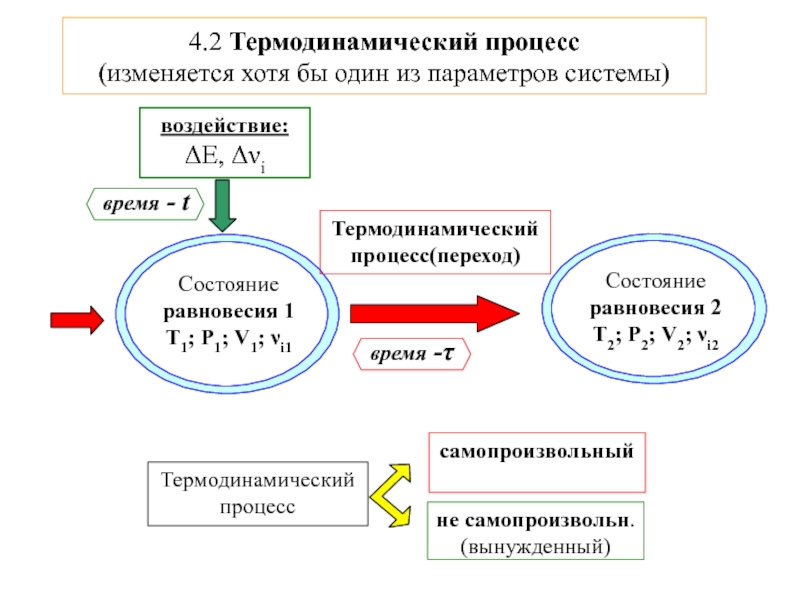
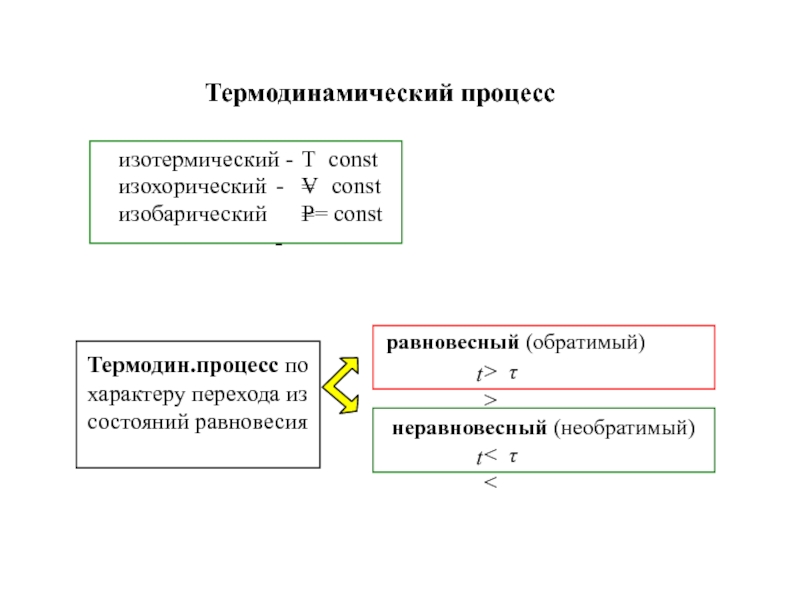
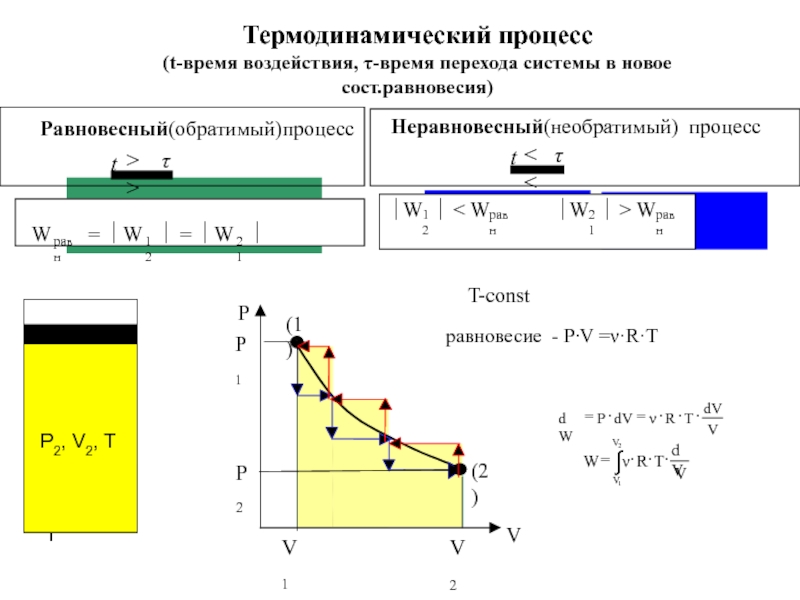

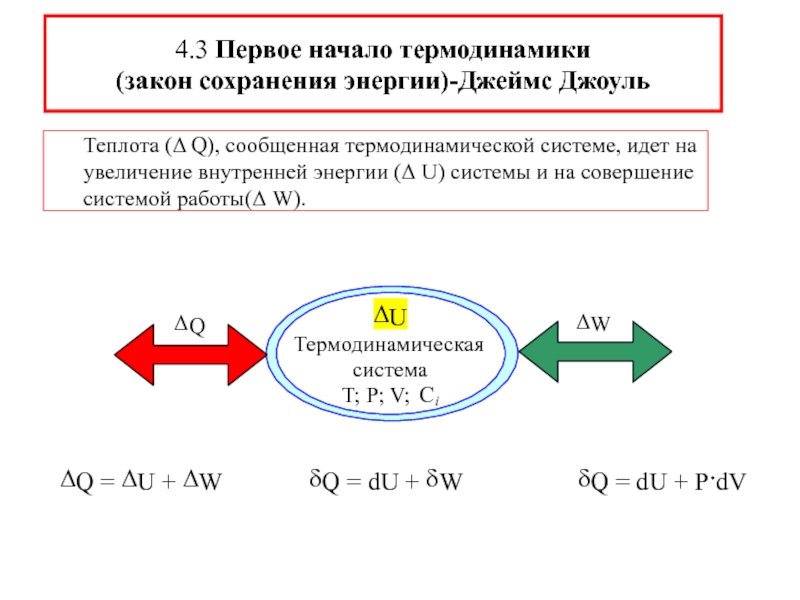

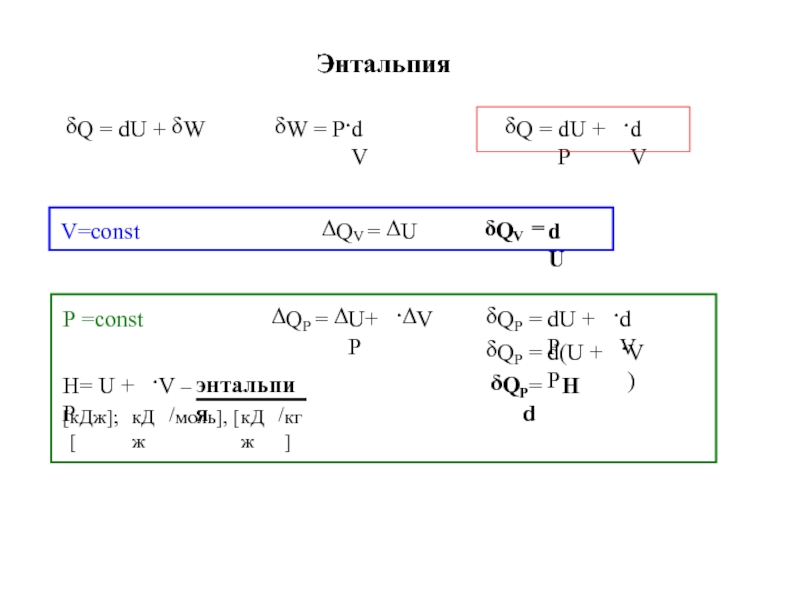
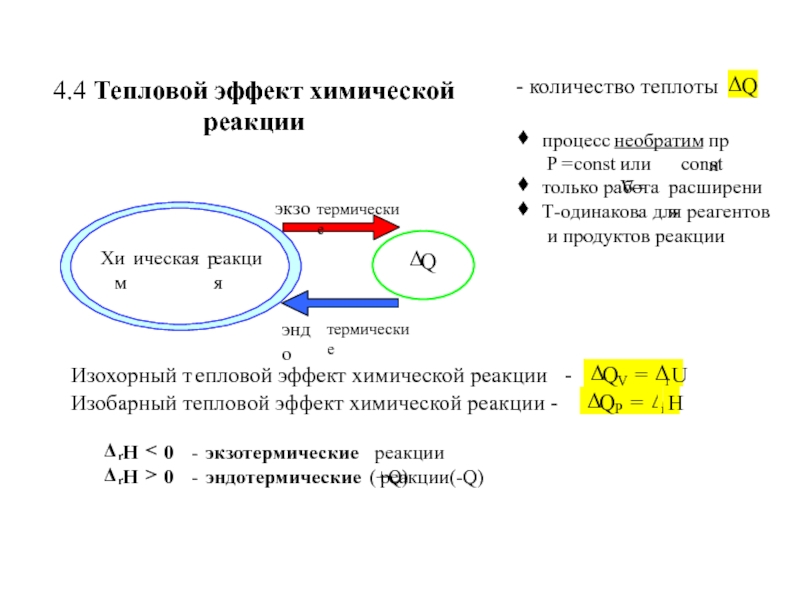

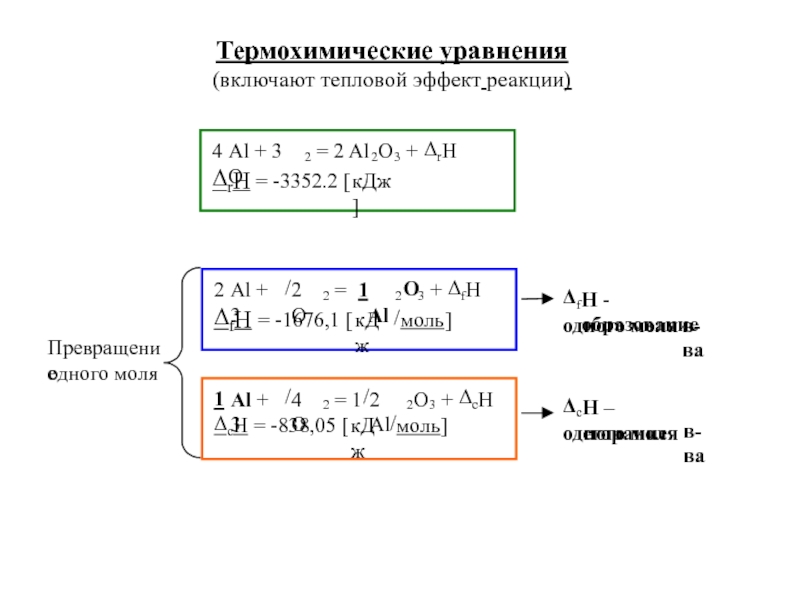








![4-ТЕРМОДИНАМИКА.ppt S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии](/img/thumbs/7d74671ca28d2cdbd7323f9bb652bebb-800x.jpg)