Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Первое начало термодинамики
Содержание
- 1. Первое начало термодинамики
- 2. Лекция 15. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ВНУТРЕННЯЯ ЭНЕРГИЯ.
- 3. Термодинамика - раздел физики, изучающий общие свойства
- 4. Область применения термодинамики значительно шире, чем молекулярно-кинетической
- 5. Термодинамика анализирует условия и количественные соотношения превращения
- 6. Состояние системы задается термодинамическими параметрами (параметрами состояния)
- 7. Параметры состояния системы могут изменяться. Любое изменение
- 8. Термодинамическое равновесие существенно отличается от механического тем,
- 9. Исторически раньше сложилась термодинамика, или общая теория
- 10. Термодинамика возникла в XIX веке как теоретическая
- 11. О тепловом движении можно говорить только в
- 12. Время перехода – время релаксации. Если равновесие
- 13. 1. Внутренняя энергия. Работа и теплота Наряду с
- 14. В термодинамических процессах изменяется только кинетическая энергия
- 15. Изменение внутренней энергии U равно разности внутренней
- 16. Если же камень был холодный, т.е. температура
- 17. Опыт показывает, что во всех случаях превращение
- 18. Учитывая правило знаков можно записать:U = Q
- 19. Первое начало термодинамики Первое начало термодинамики есть закон
- 20. При контакте термодинамической системы с окружающей средой
- 21. Затрачиваемая работа А может пойти на увеличение
- 22. Работа, совершаемая системой при бесконечно малом изменении
- 23. В каждом состоянии система обладает определенным и
- 24. Величины δQ и δA бесконечно малы, но
- 25. Из формулы (15.5) следует, что количество теплоты
- 26. Если ΔU=0, то согласно первому началу термо-динамики
- 27. 2. Теплоёмкость идеального газа. Уравнение Майера Теплоёмкость тела
- 28. Для газов удобно пользоваться молярной тепло-емкостью Сμ
- 29. Если газ нагревать при постоянном объёме, то
- 30. Итак, подводимое тепло и теплоёмкость зависят от
- 31. В общем случае(15.13)так как U может зависеть
- 32. Для произвольной идеальной массы газа:(15.16) При изобарическом
- 33. Подставим полученный результат в уравнение (15.18)СР =
- 34. 3. Теплоёмкости одноатомных и многоатомных газов Напомню, что
- 35. Внутренняя энергия произвольного количества газа:(15.24)Её изменение:(15.25)Теплоёмкости одноатомных
- 36. Учитывая физический смысл R для изобаричес-ких процессов
- 37. Тогда
- 38. Теплоемкости многоатомных газов Однако опыты с азотом и
- 39. Положение материальной точки задаётся тремя координатами и
- 40. Итак, у двухатомных молекул пять степеней свободы
- 41. 4. Закон о равномерном распределении энергии по
- 42. Но на среднюю кинетическую энергию молекулы, имеющей
- 43. В общем случае, для молярной массы газа(15.36)(15.37)(15.38)Для произвольного количества газов:(15.39)(15.40)
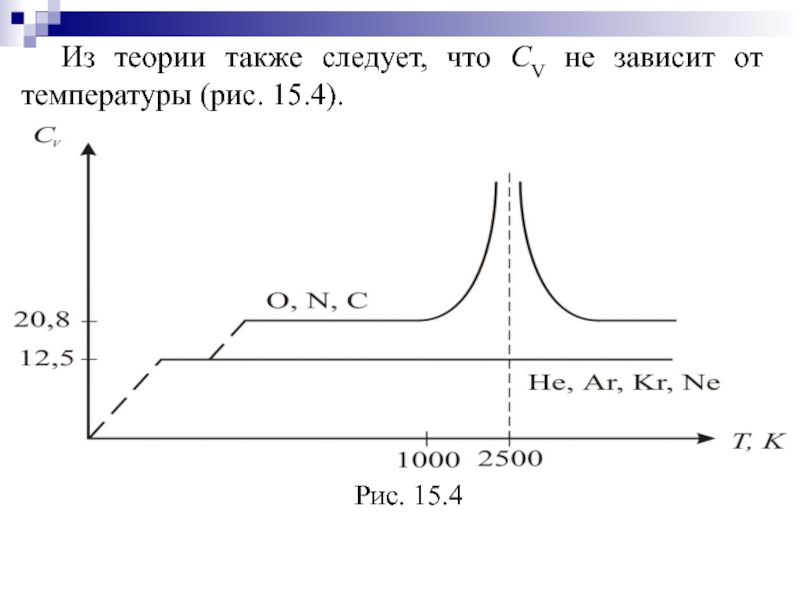
- 44. Из теории также следует, что СV не зависит от температуры (рис. 15.4).
- 45. Для одноатомных газов это выполняется в очень
- 46. Одна колебательная степень свободы несёт
- 47. 5. Применение первого начала термодинамики к изопроцессам
- 48. Слайд 48
- 49. Слайд 49
- 50. Слайд 50
- 51. Здесь уместно рассмотреть еще и политропный процесс
- 52. С помощью этого показателя можно легко описать
- 53. Лекция окончена!
- 54. Зависимость теплоемкости от температурыЗакономерности изменения теплоемкости твердых
- 55. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ЗДРАВСТВУЙТЕ!
http://portal.tpu.ru/departments/head/methodic/standart
Работы выпускные квалификационные, проекты и работы курсовые. Структура и правила
оформления. СТО ТПУ 2.5.01-2006
Слайд 2Лекция 15. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ВНУТРЕННЯЯ ЭНЕРГИЯ. РАБОТА И ТЕПЛОТА
1.
Внутренняя энергия. Работа и теплота.
2. Теплоемкость идеального газа. Уравнение Майера.
3.
Теплоемкости одноатомных и многоатомных газов.4. Закон о равномерном распределении энергии по степеням свободы.
5. Применение первого начала термодинамики к изопроцессам идеальных газов.
Слайд 3Термодинамика - раздел физики, изучающий общие свойства макроскопических систем, находящихся
в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Термодинамика не рассматривает микропроцессы, которые лежат в основе этих превращений Этим термодинамический метод отличается от статистического. Термодинамика базируется на двух началах - фундаментальных законах, установленных в результате обобщения опытных данных.Слайд 4Область применения термодинамики значительно шире, чем молекулярно-кинетической теории, ибо нет
таких областей физики и химии, в которых нельзя было бы
пользоваться термодинамическим методом. Однако, с другой стороны, термодинамический метод несколько ограничен: термодинамика ничего не говорит о микроскопическом строении вещества, о механизме явлений, а лишь устанавливает связи между .макроскопическими свойствами вещества. Молеку-лярно-кинетическая теория и термодинамика взаимно дополняют друг друга, образуя единое целое, но отличаясь различными методами исследования.Слайд 5Термодинамика анализирует условия и количественные соотношения превращения энергии.
Термодинамика имеет дело
с термодинамической системой - совокупностью макроскопических тел, которые взаимодействуют и
обмениваются энергией как между собой, так и с другими телами (внешней средой). Основа термодинамического метода — определение состояния термодинамической системы.Слайд 6Состояние системы задается термодинамическими параметрами (параметрами состояния) — совокупностью физических
величин, характеризующих свойства термодинамической системы.
Обычно в качестве параметров состояния
выбирают температуру, давление и удельный объем.Слайд 7Параметры состояния системы могут изменяться. Любое изменение в термодинамической системе,
связанное с изменением хотя бы одного из ее термодинамических параметров,
называется термодинамическим процессом. Макроскопическая система находится в термодинамическом равновесии, если ее состояние с течением времени не меняется (предполагается, что внешние условия рассматриваемой системы при этом не меняются).Слайд 8 Термодинамическое равновесие существенно отличается от механического тем, что хотя параметры
системы остаются неизменными, частицы, из которых состоит система, находятся в
непрерывном движении.Например, рассмотрим газ равномерно распределенный по всему объему. Но даже при большом числе молекул, некоторые области отклоняются от равномерного распределения.
Слайд 9 Исторически раньше сложилась термодинамика, или общая теория теплоты. Термодинамика является
феноменологической наукой. Она не вводит никаких конкретных представлений и специальных
гипотез о строении вещества и физической природы теплоты. Ее выводы основаны на общих принципах или началах, являющихся обобщением опытных фактов.Слайд 10 Термодинамика возникла в XIX веке как теоретическая основа начавшей развиваться
теплотехники.
Её первоначальная задача – изучение закономерностей превращения тепла в работу
(в тепловых машинах). Основным содержанием современной физической термодинамики является изучение закономерностей тепловой формы движущейся материи и связанных с ней физических явлений. Тепловая форма движения материи – это хаотическое движение атомов и молекул в макроскопических телах. Слайд 11 О тепловом движении можно говорить только в тех случаях, когда
рассматриваемая система является макроскопической, то есть состоит из огромного числа
атомов и молекул. Не имеет смысла говорить о тепловом движении, когда система состоит из одного или нескольких атомов.Особое положение термодинамики связано с тем, что любая форма энергии при ее превращениях в конце концов переходит в тепловую форму движения материи: электрическая, механическая, химическая энергии становятся в конце концов тепловыми энергиями.
Слайд 12 Время перехода – время релаксации. Если равновесие установилось, то система
самопроизвольно не сможет выйти из него. Горячий камень опустили в
воду. Наступит равновесное состояние: температуры одинаковы, и сколько не жди, температура не увеличится.Слайд 131. Внутренняя энергия. Работа и теплота
Наряду с механической энергией любое
тело (или система) обладает внутренней энергией.
Внутренняя энергия – энергия покоя.
Она складывается из теплового хаотического движения молекул, составляющих тело, потенциальной энергии их взаимного расположения, кинетической и потенциальной энергии электронов в атомах, нуклонов в ядрах, и так далее. В термодинамике важно знать не абсолютное значение внутренней энергии, а её изменение.Слайд 14 В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой
энергии недостаточно, чтобы изменить строение атома, а тем более ядра).
Следовательно, фактически под внутренней энергией в термодинамике подразумевают энергию теплового хаотического движения молекул. Тогда внутренняя энергия U одного моля идеального газа равна(15.1)
т.е. (15.2)
Таким образом, внутренняя энергия зависит только от температуры, т.е. внутренняя энергия U является функцией состояния системы независимо от предыстории!!!
Слайд 15 Изменение внутренней энергии U равно разности внутренней энергии в этих
состояниях, независимо от пути, по которому шёл этот процесс.
Понятно, что
в общем случае термодинамическая система может обладать как внутренней, так и механической энергией и разные системы могут обмениваться этими видами энергии. При этом обмен механической энергии характеризуется совершенной работой (А), а обмен внутренней энергией – количеством переданного тепла (Q).Например. Зимой вы бросили в снег горячий камень, за счёт запаса потенциальной энергии (механическая) совершена работа по смятию снега, а за счёт запаса внутренней энергии снег был растоплен.
Слайд 16 Если же камень был холодный, т.е. температура камня равна температуре
среды, то будет совершена только работа, но не будет обмена
внутренней энергией. Итак, работа и теплота не есть особые формы энергии. Нельзя говорить о запасе теплоты или работы. Это мера переданной другой системе механической или внутренней энергии.Вот о запасе этих энергий можно говорить. Кроме того механическая энергия может переходить в тепловую энергию и обратно. Например, если стучать молотком по наковальне, то через некоторое время молоток и наковальня нагреются. Можно найти ещё массу примеров диссипации или превращения одной формы энергии в другую.
Слайд 17 Опыт показывает, что во всех случаях превращение механической энергии в
тепловую и обратно совершается всегда в строго эквивалентных количествах. В
этом и состоит суть первого начала термодинамики, следующая из закона сохранения энергии.Правило знаков: ∆Q>0, если тепло передаётся от окружающей среды данной системе, ∆U>0 и ∆А>0, если система производит работу над окружающими телами, при этом U<0.
Слайд 18 Учитывая правило знаков можно записать:
U = Q – А
(15.3)
изменение внутренней энергии тела равно разности сообщаемой телу теплоты и произведённой телом работы.
Или
Q = U + А (15.4)
количество теплоты, сообщаемой телу идёт на увеличение внутренней энергии и на совершение телом работы. Это есть первое начало термодинамики или закон сохранения энергии в термодинамики.
Слайд 19Первое начало термодинамики
Первое начало термодинамики есть закон сохранения энергии для
макроскопических явлений, в которых одним из существенных параметров, определяющих состояние
тел, является температура. Его открытие относится к 40-м гг. XIX в, когда было установлено, что теплота не вещество, а один из видов внутреннего движения тела.Всякое тело является консервативной системой с большим числом атомов и молекул. Для такой системы механический закон сохранения энергии справедлив при условии, что к энергии макроскопического движения добавляется энергия атомно-молекулярного движения и взаимодействия. Это последнее движение и есть теплота.
Слайд 20 При контакте термодинамической системы с окружающей средой происходит обмен энергией.
Возможны два различных способа передачи энергии от системы к внешним
телам: с изменением внешних макроскопических параметров системы и без изменения этих параметров.Первый способ передачи энергии, связанный с изменением внешних макроскопических параметров, называется работой А.
Второй способ – без изменения внешних пара-метров, но связанный с изменением нового термодинамического параметра (энтропии), называется теплообменом.
Слайд 21 Затрачиваемая работа А может пойти на увеличение любого вида энергии,
теплота Q непосредственно может пойти только на увеличение внутренней энергии
системы. Работа А и количество теплоты Q отличны от нуля только при процессе, который совершает система; состоянию системы не соответствует какое-либо значение А или Q, поэтому не говорят, например, о запасе работы в теле.Принято считать работу А положительной, если она совершается системой над внешними телами, а количество теплоты Q считается положительным, если энергия передается системе.
Слайд 22 Работа, совершаемая системой при бесконечно малом изменении объема системы dV,
равна
δA = Fdx = (F/S) Sdx = рdV.
δQ = dU
+ δA (15.5) В этом выражении U – функция состояния системы; dU – полный дифференциал; δQ и δA таковыми не являются.
здесь р – давление газа в сосуде; S – площадь поршня; dV = Sdx – изменение объема сосуда при перемещении поршня на dx.
Слайд 23 В каждом состоянии система обладает определенным и только таким значением
внутренней энергии, поэтому можно записать
(15.6)
Важно отметить, что Q и А
зависят от того, каким образом совершен переход из состояния 1 в состояние 2 (изохорически, адиабатически и т.д.). При этом нельзя сказать, что система обладает определенным для данного состояния значением теплоты и работы.Слайд 24 Величины δQ и δA бесконечно малы, но не являются полными
дифференциалами, поскольку Q и A задаются не начальным и конечным
состояниями системыа определяются процессом, совершаемым системой.
Энергия, связанная с внутренними движениями частиц системы и их взаимодействиями между собой, называется внутренней.
К внутренней энергии не относится кинетическая энергия и потенциальная энергия системы, как целого!!!
Слайд 25 Из формулы (15.5) следует, что количество теплоты выражается в тех
же единицах, что работа и энергия, т.е. в джоулях (Дж).
Особое
значение в термодинамике имеют круговые или циклические процессы, при которых система пройдя ряд состояний, возвращается в исходное (рис. 15.1). Так как U – функция состояния, то(15.7)
Это справедливо для любой функции состояния.
Слайд 26 Если ΔU=0, то согласно первому началу термо-динамики А=Q, т.е. нельзя
построить периодически действующий двигатель, который совершал бы боль-шую работу, чем
количество сообщенной ему из вне энергии. Иными словами вечный двигатель первого рода невозможен. Это одна из формулировок первого начала термодинамики.Следует отметить, что первое начало термо-динамики не указывает в каком направлении идут про-цессы изменения состояния (что является одним из его недостатков).
Содержание
Слайд 272. Теплоёмкость идеального газа. Уравнение Майера
Теплоёмкость тела характеризуется количеством теплоты,
необходимой для нагревания этого тела на один градус
(15.8)
Размерность теплоемкости: [C]=Дж/К.
Однако,
теплоёмкость – величина неопределён-ная, поэтому пользуются понятиями как удельная и мо-лярная теплоёмкости.Удельная теплоёмкость (Суд) – есть количество теплоты, необходимое для нагревания единицы массы вещества на один градус [Cуд]=Дж/К.
Слайд 28 Для газов удобно пользоваться молярной тепло-емкостью Сμ − количество теплоты
необходимое для нагревания 1 кмоля газа на 1 градус
Сμ =
Судμ (15.9)[Cμ] = Дж/(моль⋅К).
Напомню, что молярная масса – масса одного моля:
Μ = А mед NА (15.10)
где А – атомная масса; mед − атомная единица массы; NА − число Авогадро; μ (моль) – количество вещества, в котором содержится число молекул, равное числу атомов в 12 г изотопа углерода С12.
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании.
Слайд 29 Если газ нагревать при постоянном объёме, то всё подводимое тепло
идёт на нагревание газа, то есть изменение его внутренней энергии.
Теплоёмкость обозначается СV.Если нагревать газ при постоянном давлении (Ср) в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу (рис. 15.2). Следовательно подводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что Ср>CV.
Слайд 30 Итак, подводимое тепло и теплоёмкость зависят от того, каким путём
осуществляется передача тепла. Следовательно Q и С не являются функциями
состояния.Величины Ср и СV оказываются связаны просты-ми соотношениями. Найдём их.
Пусть мы нагреваем один моль идеального газа при постоянном объёме, то первое начало термодинамики.
δQ = dU (δА=0) (15.11)
т.е. δQ – бесконечно малое приращения количества теплоты равное приращению внутренней энергии dU.
Теплоёмкость при постоянном объёме:
(15.12)
Слайд 31 В общем случае
(15.13)
так как U может зависеть не только от
температуры. Но в случае идеального газа справедлива формула (15.12). Из
(15.12) следует, что dUμ=CV⋅dT.(15.14)
U = CV⋅T (15.15)
Внутренняя энергия идеального газа является только функцией Т (и не зависит от V, р и тому подобным), поэтому формула (15.15) справедлива для любого процесса.
Слайд 32 Для произвольной идеальной массы газа:
(15.16)
При изобарическом процессе кроме увеличения
внутренней энергии происходит совершение работы газом:
δQP = dUμ + рdVμ
(15.17)(15.18)
из основного уравнения молекулярно-кинетической теории рVμ=RT, так как при изобарическом процессе р = const.
Слайд 33Подставим полученный результат в уравнение (15.18)
СР = СV+R
(15.19)
это уравнение Майера для одного моля газа. Из него следует физический смысл универсальной газовой постоянной R – численно равной работе, совершаемой одним молем газа при нагревании на один градус при изобарическом процессе.
Используя это соотношение Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж. Полезно знать формулу Майера для удельных теплоёмкостей:
(15.20)
или
(15.21)
Содержание
Слайд 343. Теплоёмкости одноатомных и многоатомных газов
Напомню, что в одном моле
содержится NА = 6,02⋅1023 молекул. Один моль – количество вещества
в котором содержится число молекул равное числу ато-мов содержащихся в 12-ти граммах углерода С12.Так как энергия одной молекулы идеального газа 3/2(kT), то внутренняя энергия одного моля идеального газа равна
(15.22)
т.е.
(15.23)
Слайд 35Внутренняя энергия произвольного количества газа:
(15.24)
Её изменение:
(15.25)
Теплоёмкости одноатомных газов СV и
СР:
(15.26)
где теплоемкость при постоянном объеме СV – величина постоянная,
от температуры не зависит.Слайд 36 Учитывая физический смысл R для изобаричес-ких процессов можно записать:
dQр =
dUμ + RdT (для одного моля). (15.27)
Тогда
или
(15.28) Полезно знать отношение:
(15.29)
где γ − коэффициент Пуассона,
Так как
Слайд 37Тогда
и из этого следует, что
(15.30)
Кроме того
Подставив в выражение для внутренней
энергии:а так как , то (15.31)
Итак, численно
Это хорошо подтверждается на опыте с Ne, He, Ar, Kr, парами одноатомных металлов.
Слайд 38Теплоемкости многоатомных газов
Однако опыты с азотом и кислородом и другими
двухатомными газами дали
А для водяного пара воды и других
многоатомных газов (СН3, СН4, и так далее)То есть многоатомные газы нельзя рассматривать как материальные точки. Необходимо учитывать вращательное движение.
Числом степени свободы называется число независимых переменных, определяющих положение тела в пространстве, и обозначается как i.
Слайд 39 Положение материальной точки задаётся тремя координатами и она имеет три
степени свободы. На каждую степень свободы приходится .
Многоатомная молекула может ещё и вращаться.Например. У двухатомных молекул вращательное движение можно разложить на два независимых вращения, а любое вращение можно разложить на три вращательных движения вокруг взаимно перпендикулярных осей. Но для двухатомных молекул вращение вокруг оси z не изменит её положение в пространстве, а момент инерции относительно этой оси равен нулю (рис. 15.3).
Слайд 40 Итак, у двухатомных молекул пять степеней свободы (i = 5),
а у трёхатомных шесть степеней свободы (i = 6). При
взаимных столкновениях молекул возможен обмен их энергиями и превращение энергии вращательного движения в энергию поступательного движения и обратно. Таким путём установили равновесие между значениями средних энергий поступательного и вращательного движения молекул. Больцман доказал, что для не слишком низких температур, средняя энергия 〈Ек〉, приходящаяся на одну степень свободы
равна
Содержание
Слайд 414. Закон о равномерном распределении энергии по степеням свободы
Итак, средняя
энергия приходящаяся на одну степень свободы равна
(15.31)
Но у одноатомной молекулы
i = 3, тогда для одноатомных молекул(15.32)
для двухатомных молекул 〈Ек〉 = (15.33)
для трёхатомных молекул
(15.34)
Слайд 42 Но на среднюю кинетическую энергию молекулы, имеющей i-степеней свободы приходится
(15.35)
Это
и есть закон Больцмана о равномерном распределении средней кинетической энергии
по степеням свободы.При этом: для двухатомных молекул:
для трехатомных молекул:
Слайд 43В общем случае, для молярной массы газа
(15.36)
(15.37)
(15.38)
Для произвольного количества газов:
(15.39)
(15.40)
Слайд 45 Для одноатомных газов это выполняется в очень широких пределах, а
для двухатомных газов только в интервале от 100÷1000 К. Отличие
связано с проявлением квантовых законов. При низких температурах вращательное движение как бы «вымерзает» и двухатомные молекулы движутся поступательно, как одноатомные. При увеличении температуры, когда Т > 1000 К, начинают сказываться колебания атомов молекулы вдоль оси z (атомы в молекуле связаны не жёстко, а как бы на пружине).
Слайд 46 Одна колебательная степень свободы несёт так как при
этом есть и кинетическая и потенциальная энергия, то есть появляется
шестая степень свободы - колебательная. При температуре равной 2500 К молекулы диссоциируют. На диссоциацию молекул тратится энергия раз в десять превышающая среднюю энергию поступательного движения. Это объясняет сравнительно низкую температуру пламени. Кроме того, атом – сложная система, и при высоких температурах начинает сказываться движение электронов внутри его.Содержание
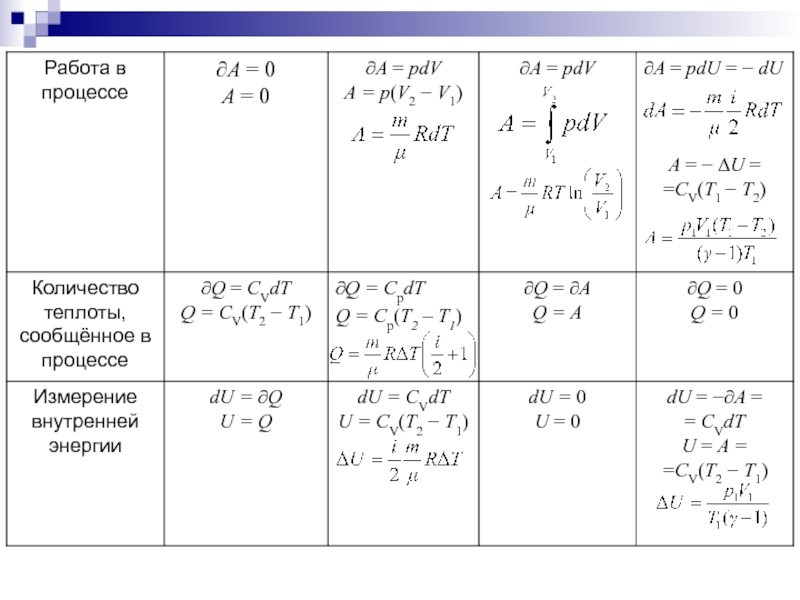
Слайд 475. Применение первого начала термодинамики к изопроцессам идеальных газов
В таблице
(15.1) приводятся сводные данные о характеристиках изопроцессов в газах. Здесь
исполь-зуются известные нам формулы:∂Q=dU+∂A – I начало термодинамики или закон сохра-нения энергии в термодинамики;
- внутренняя энергия идеального газа;
- работа идеального газа;
∂Q=mCdT - приращение теплоты;
Слайд 48 - удельная теплоемкость;
-
молярная теплоемкость;Ср=СV+R - уравнение Майера;
- показатель адиабаты или коэффициент Пуассона.
Слайд 51 Здесь уместно рассмотреть еще и политропный процесс – такой процесс,
при котором изменяются все основные параметры системы, кроме теплоемкости, т.е.
С=const.Уравнение политропы pVn=const (15.41)
или TVn–1=const (15.42)
Здесь n – показатель политропы.
Слайд 52 С помощью этого показателя можно легко описать любой изопроцесс:
1. Изобарный
процесс р = const, n = 0
(15.43)
2. Изотермический процесс Т
= const, n = 1, СТ = ± ∞.3. Изохорный процесс V = const, n = ± ∞
(15.44)
4. Адиабатический процесс ΔQ = 0, n = γ, Сад. = 0.
Во всех этих процессах работу можно вычислить по одной формуле:
(15.45)
Слайд 54Зависимость теплоемкости от температуры
Закономерности изменения теплоемкости твердых тел от температуры
с моноатомной элементарной ячейкой крис-таллической решетки с боль-шой степенью точности
опи-сываются законом теплоем-кости Дебая.назад