Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
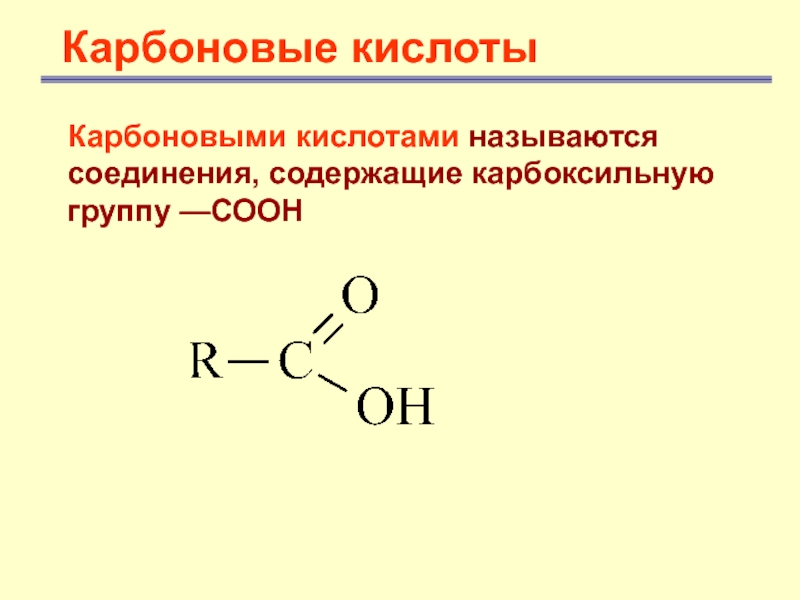
Карбоновые кислоты
Содержание
- 1. Карбоновые кислоты
- 2. Карбоновые кислотыКарбоновыми кислотами называются соединения, содержащие карбоксильную группу —СООН
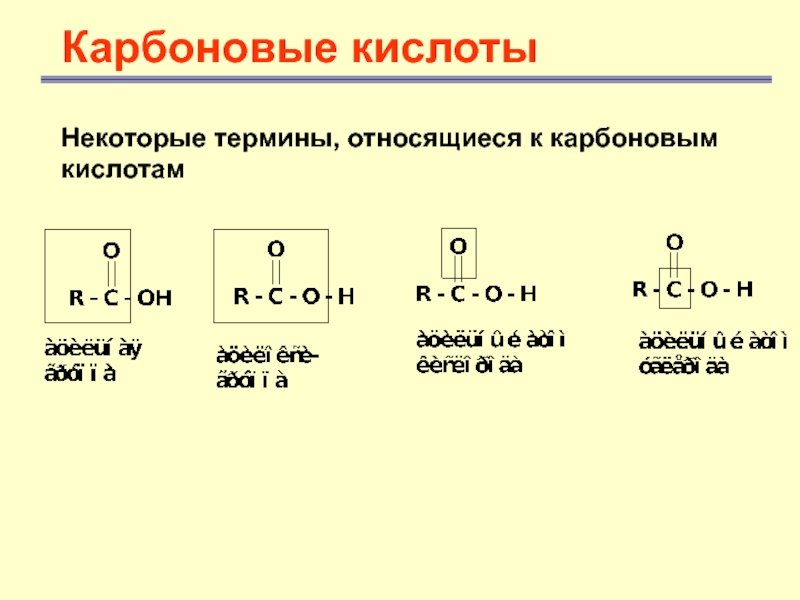
- 3. Карбоновые кислотыНекоторые термины, относящиеся к карбоновым кислотам
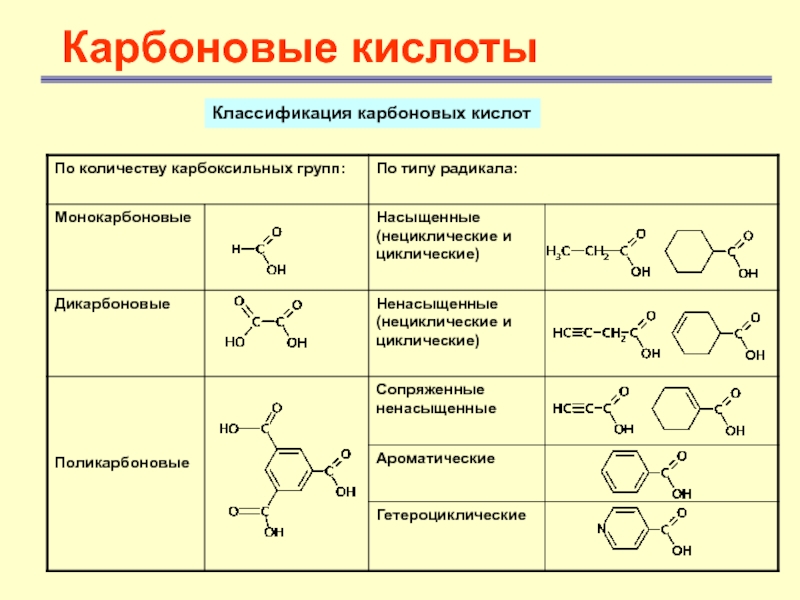
- 4. Карбоновые кислотыКлассификация карбоновых кислот
- 5. Карбоновые кислоты
- 6. Карбоновые кислоты
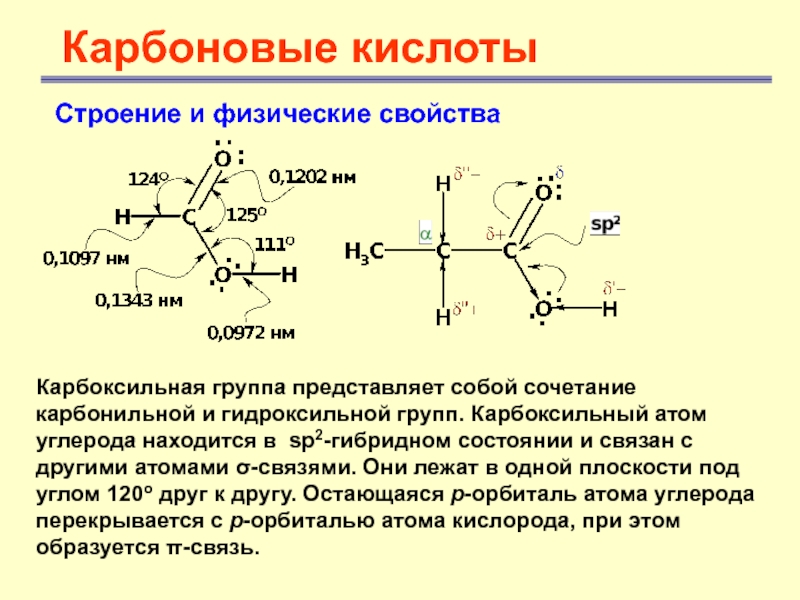
- 7. Карбоновые кислотыСтроение и физические свойства Карбоксильная группа
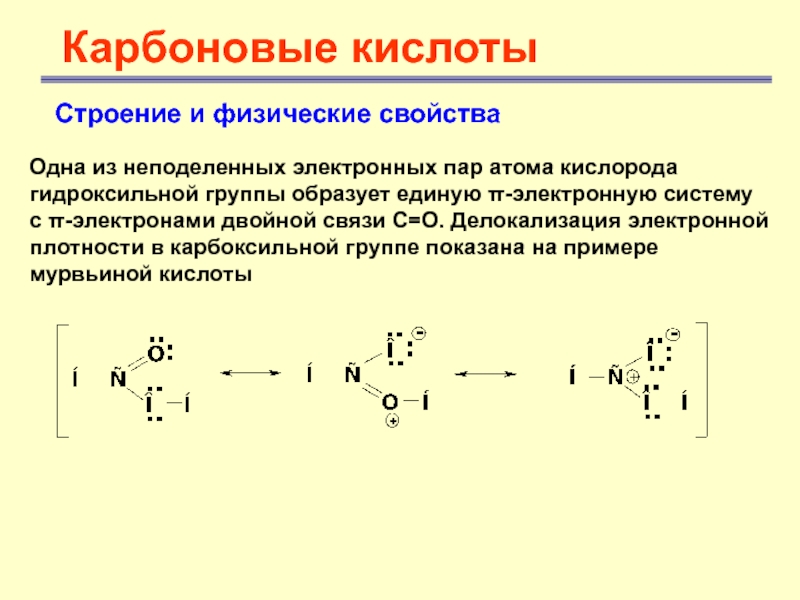
- 8. Карбоновые кислотыСтроение и физические свойства Одна из
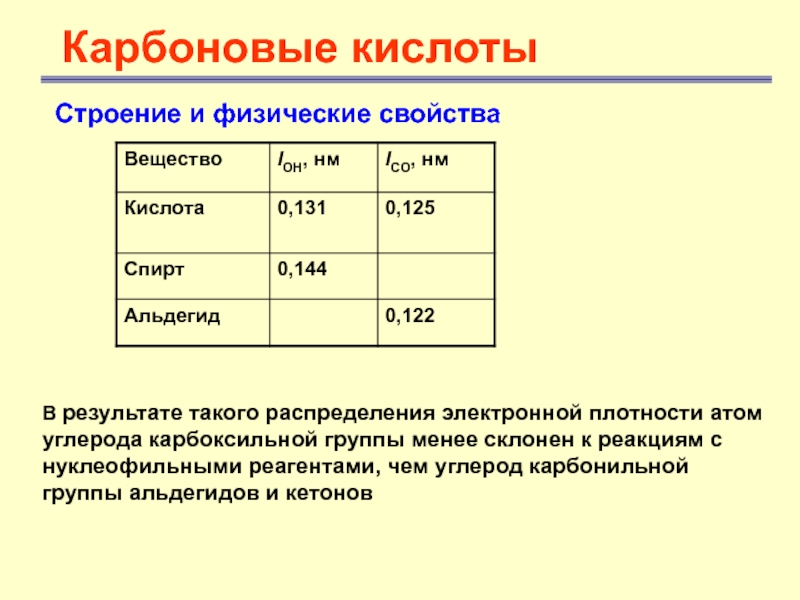
- 9. Карбоновые кислотыСтроение и физические свойства В результате
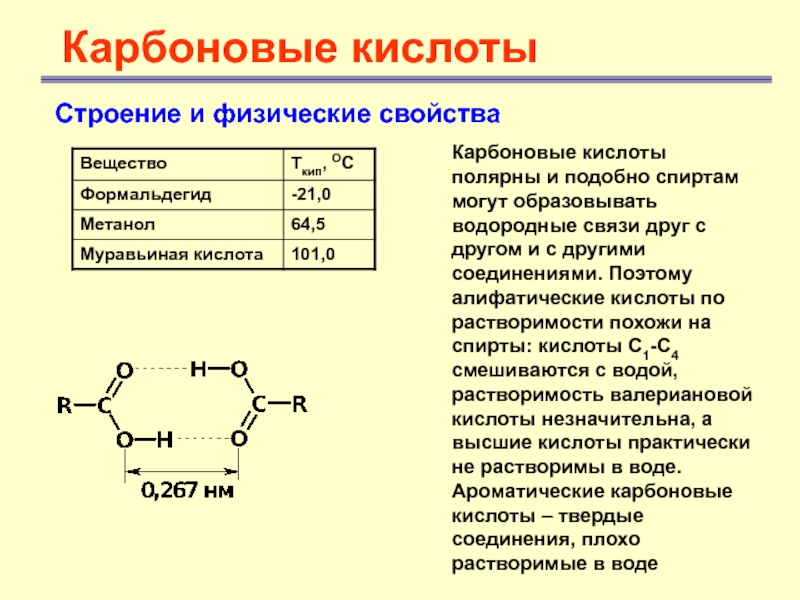
- 10. Карбоновые кислотыСтроение и физические свойства Карбоновые кислоты
- 11. Карбоновые кислотыХимические свойства Большинство реакций карбоновых кислот
- 12. Карбоновые кислотыРеакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи.
- 13. Карбоновые кислотыРеакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи.
- 14. Карбоновые кислотыРеакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи.
- 15. Карбоновые кислотыРеакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи.
- 16. Карбоновые кислотыРеакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи.
- 17. Карбоновые кислотыРеакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи.
- 18. Карбоновые кислотыРеакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи.
- 19. Карбоновые кислотыРеакции по карбонильному атому углерода, сопровождающиеся
- 20. Карбоновые кислотыПревращение в эфиры R-COOR1 Сложные эфиры
- 21. Карбоновые кислотыПревращение в эфиры R-COOR1 Объемные группы,
- 22. Карбоновые кислотыПревращение в эфиры R-COOR1 Механизм реакции
- 23. Карбоновые кислотыПревращение в эфиры R-COOR1 Механизм реакции
- 24. Карбоновые кислотыПревращение в эфиры R-COOR1 Механизм реакции
- 25. Карбоновые кислотыПревращение в эфиры R-COOR1 Присоединение протона
- 26. Карбоновые кислотыПревращение в галогенангидриды RCOHal Чаще всего
- 27. Карбоновые кислотыПревращение в ангидриды Ангидриды могут быть
- 28. Карбоновые кислотыПревращение в ангидриды
- 29. Карбоновые кислотыПревращение в амиды RCONH2 Амиды получают
- 30. Карбоновые кислотыЗамещение в ароматическом ядре Электроноакцепторная карбоксильная
- 31. Карбоновые кислотыВосстановление карбоновых кислот В целом карбоновые
- 32. Карбоновые кислотыВосстановление карбоновых кислот Далее восстановление происходит
- 33. Карбоновые кислотыДекарбоксилирование карбоновых кислот Легкость, с которой
- 34. Карбоновые кислотыДекарбоксилирование карбоновых кислот Термическое декарбоксилирование происходит
- 35. Карбоновые кислотыДекарбоксилирование карбоновых кислот Электролиз солей карбоновых кислот по Кольбе позволяет получать углеводороды
- 36. Карбоновые кислотыДекарбоксилирование карбоновых кислот Декарбоксилирование серебряных солей
- 37. Карбоновые кислотыРеакции замещения у α-углеродного атома Карбоновые
- 38. Карбоновые кислотыРеакции замещения у α-углеродного атома Катализируемая
- 39. Карбоновые кислотыРеакции замещения у α-углеродного атома Галоген
- 40. Карбоновые кислотыСпособы получения1. Окисление первичных спиртов или альдегидов2. Окисление алкилбензолов 3. Гидролиз нитрилов 4. Гидролиз тригалогенпроизводных
- 41. Карбоновые кислотыСпособы получения5. Карбоксилирование реактива Гриньяра 6.
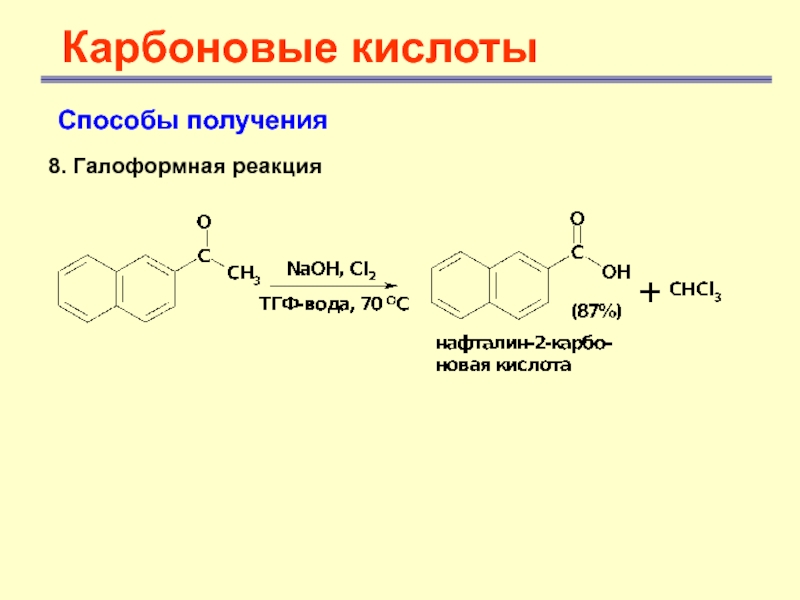
- 42. Карбоновые кислотыСпособы получения8. Галоформная реакция
- 43. Функциональные производные карбоновых кислот
- 44. Функциональные производные карбоновых кислот
- 45. Функциональные производные карбоновых кислотК производным карбоновых кислот
- 46. Функциональные производные карбоновых кислотХимические свойства Реакционная способность
- 47. Функциональные производные карбоновых кислотРеакционная способность SN(AdN, E)Первая
- 48. Функциональные производные карбоновых кислотРеакционная способность SN(AdN, E)Cтабилизация
- 49. Функциональные производные карбоновых кислотРеакционная способность AdNУ альдегидов
- 50. Функциональные производные карбоновых кислотРеакционная способность По легкости
- 51. Функциональные производные карбоновых кислотРеакционная способность В случае
- 52. Функциональные производные карбоновых кислотРеакционная способность Реакции могут
- 53. Функциональные производные карбоновых кислотРеакции замещения группы Х
- 54. Функциональные производные карбоновых кислотГидролиз – превращение в
- 55. Функциональные производные карбоновых кислотГидролиз – превращение в
- 56. Функциональные производные карбоновых кислотГидролиз – превращение в
- 57. Функциональные производные карбоновых кислотГидролиз – превращение в
- 58. Функциональные производные карбоновых кислотГидролиз – превращение в
- 59. Функциональные производные карбоновых кислотГидролиз – превращение в
- 60. Функциональные производные карбоновых кислотГидролиз – превращение в
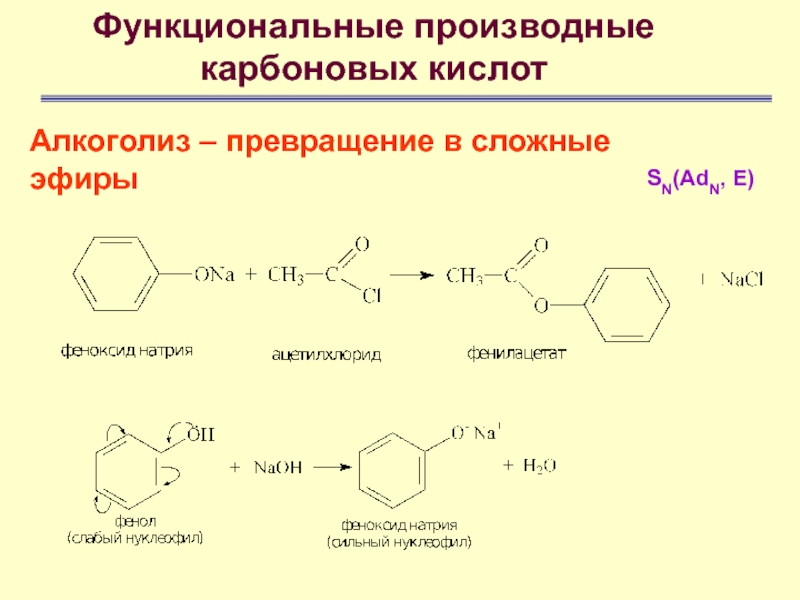
- 61. Функциональные производные карбоновых кислотАлкоголиз – превращение в
- 62. Функциональные производные карбоновых кислотАлкоголиз – превращение в сложные эфирыSN(AdN, E)
- 63. Функциональные производные карбоновых кислотАлкоголиз – превращение в сложные эфирыSN(AdN, E)
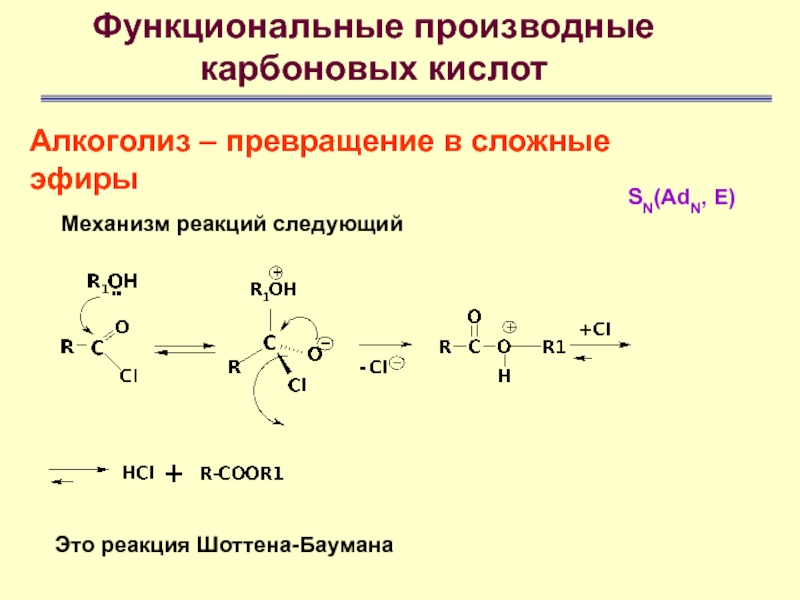
- 64. Функциональные производные карбоновых кислотАлкоголиз – превращение в сложные эфирыМеханизм реакций следующийЭто реакция Шоттена-БауманаSN(AdN, E)
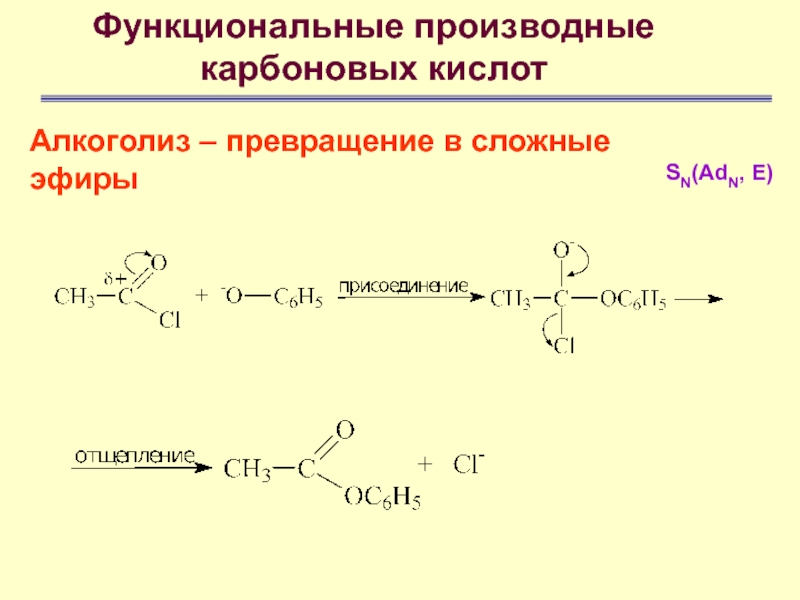
- 65. Функциональные производные карбоновых кислотАлкоголиз – превращение в
- 66. Функциональные производные карбоновых кислотАлкоголиз – превращение в
- 67. Функциональные производные карбоновых кислотАлкоголиз – превращение в
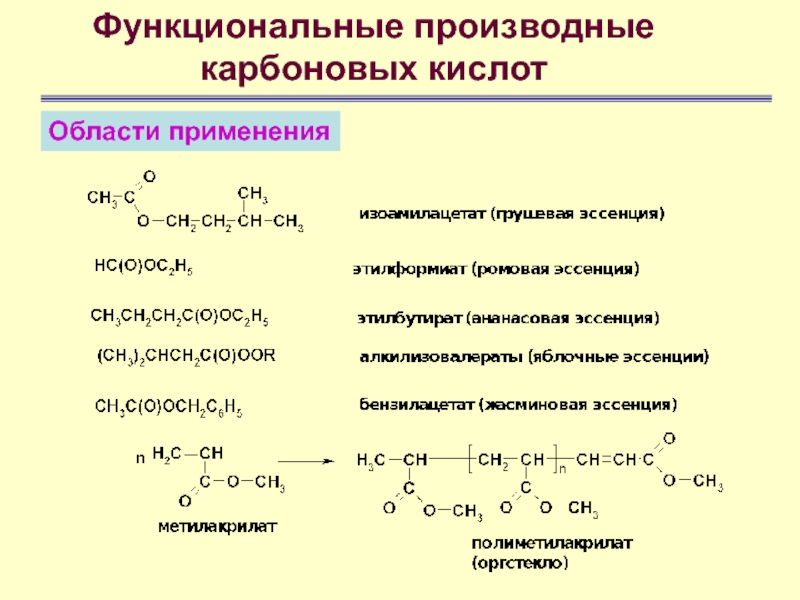
- 68. Функциональные производные карбоновых кислотОбласти применения
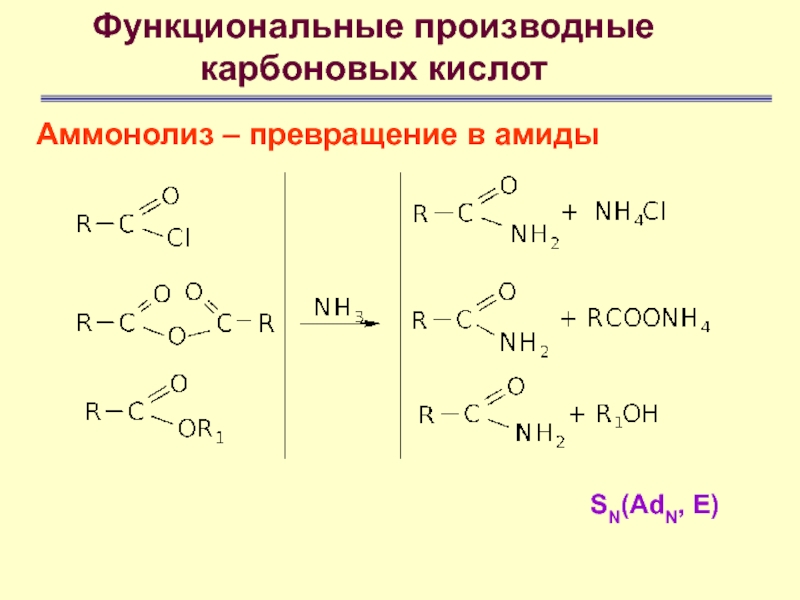
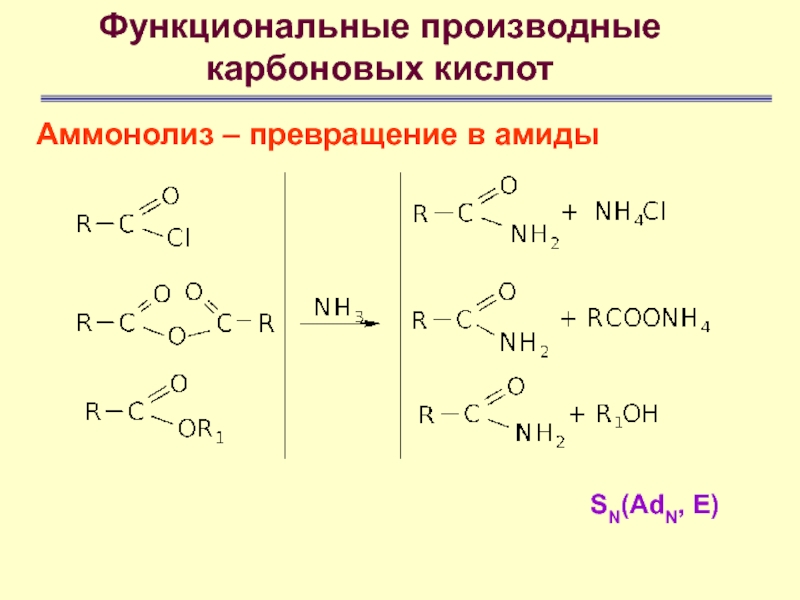
- 69. Функциональные производные карбоновых кислотАммонолиз – превращение в амидыSN(AdN, E)
- 70. Функциональные производные карбоновых кислотАммонолиз – превращение в амидыSN(AdN, E)
- 71. Функциональные производные карбоновых кислотПревращение в нитрилы R-C≡N
- 72. Функциональные производные карбоновых кислотВзаимодействие сложных эфиров с
- 73. Функциональные производные карбоновых кислотВзаимодействие сложных эфиров с
- 74. Функциональные производные карбоновых кислотВзаимодействие сложных эфиров с
- 75. Функциональные производные карбоновых кислотВзаимодействие сложных эфиров с
- 76. Функциональные производные карбоновых кислотРеакции сложного эфира по
- 77. Функциональные производные карбоновых кислотКЛЯЙЗЕН Людвиг Райнер1851 – 1930
- 78. Функциональные производные карбоновых кислотВодороды у α-углеродного атома
- 79. Функциональные производные карбоновых кислотРеакции сложного эфира по
- 80. Функциональные производные карбоновых кислотРеакции сложного эфира по
- 81. Функциональные производные карбоновых кислотРасщепление амидов по Гофману
- 82. Функциональные производные карбоновых кислотРасщепление амидов по Гофману
- 83. Функциональные производные карбоновых кислотГофман Август Вильгельм 1818 — 1892
- 84. Функциональные производные карбоновых кислотВосстановление производных кислот Сложные
- 85. Функциональные производные карбоновых кислотВосстановление производных кислот Амиды
- 86. Функциональные производные карбоновых кислотВосстановление производных кислот Нитрилы
- 87. Функциональные производные карбоновых кислот
- 88. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
Карбоновые кислоты
Карбоновыми кислотами называются соединения, содержащие карбоксильную группу —СООН
Слайд 7
Карбоновые кислоты
Строение и физические свойства
Карбоксильная группа представляет собой сочетание
Слайд 8
Карбоновые кислоты
Строение и физические свойства
Одна из неподеленных электронных пар
атома кислорода гидроксильной группы образует единую π-электронную систему с π-электронами
двойной связи С=О. Делокализация электронной плотности в карбоксильной группе показана на примере мурвьиной кислоты
Слайд 9
Карбоновые кислоты
Строение и физические свойства
В результате такого распределения электронной
плотности атом углерода карбоксильной группы менее склонен к реакциям с
нуклеофильными реагентами, чем углерод карбонильной группы альдегидов и кетоновСлайд 10
Карбоновые кислоты
Строение и физические свойства
Карбоновые кислоты полярны и подобно
спиртам могут образовывать водородные связи друг с другом и с
другими соединениями. Поэтому алифатические кислоты по растворимости похожи на спирты: кислоты С1-С4 смешиваются с водой, растворимость валериановой кислоты незначительна, а высшие кислоты практически не растворимы в воде. Ароматические карбоновые кислоты – твердые соединения, плохо растворимые в водеСлайд 11
Карбоновые кислоты
Химические свойства
Большинство реакций карбоновых кислот можно отнести к
одному из четырех основных типов:
1. Реакции сопровождающиеся разрывом -О –
Н связей (кислотная диссоциация, сольволиз)2. Реакции по карбонильному углероду – атака нуклеофила :Y по углероду карбонильной группы с последующим разрывом С – О связи (образование сложных эфиров, образование ацилхлоридов, восстановление гидридами)
3. Декарбоксилирование (электролиз по Кольбе, реакция Хунсдиккера)
4. Реакции по α-углеродному атому (галогенирование, реакции α-замещенных карбоновых кислот).
Слайд 12
Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
В водном
растворе карбоновые кислоты диссоциируют с образованием карбоксилат-аниона и иона водорода
pKa= - lg Ka
Константы их кислотности Ка приблизительно равны 10-5 (pKa 5)
Слайд 13
Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
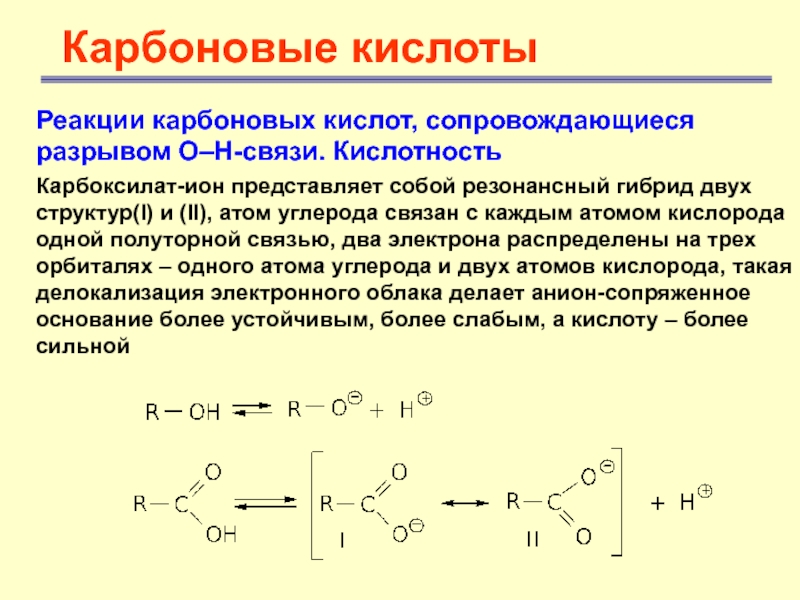
Карбоксилат-ион представляет
собой резонансный гибрид двух структур(I) и (II), атом углерода связан
с каждым атомом кислорода одной полуторной связью, два электрона распределены на трех орбиталях – одного атома углерода и двух атомов кислорода, такая делокализация электронного облака делает анион-сопряженное основание более устойчивым, более слабым, а кислоту – более сильнойСлайд 14
Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
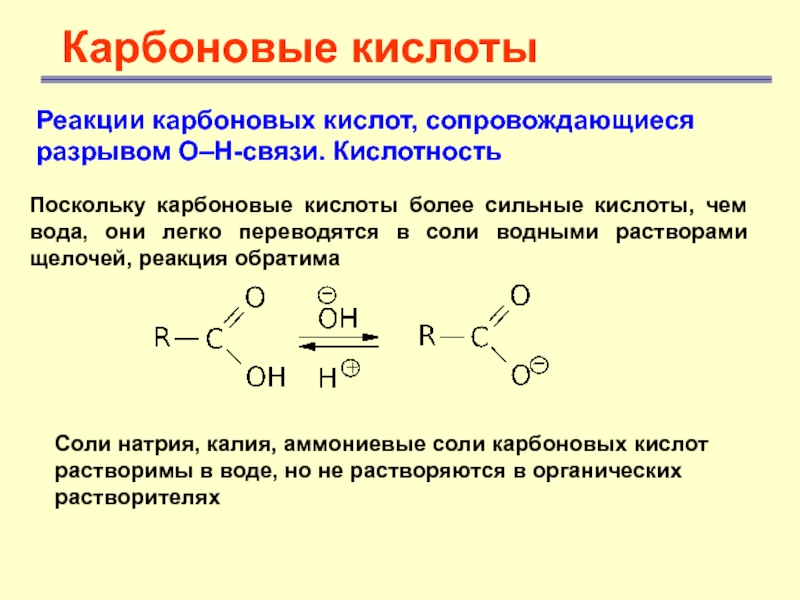
Поскольку карбоновые
кислоты более сильные кислоты, чем вода, они легко переводятся в
соли водными растворами щелочей, реакция обратимаСоли натрия, калия, аммониевые соли карбоновых кислот растворимы в воде, но не растворяются в органических растворителях
Слайд 15
Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
Электроноакцепторные заместители,
способствующие распределению отрицательного заряда в анионе, делают его более устойчивым
и тем самым увеличивают кислотность. Электронодонорные заместители увеличивают отрицательный заряд и дестабилизируют анион – кислотность уменьшаетсяЭлектронодонорная группа СН3 подает электроны, дестабилизирует анион, уменьшает кислотность
Слайд 16
Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
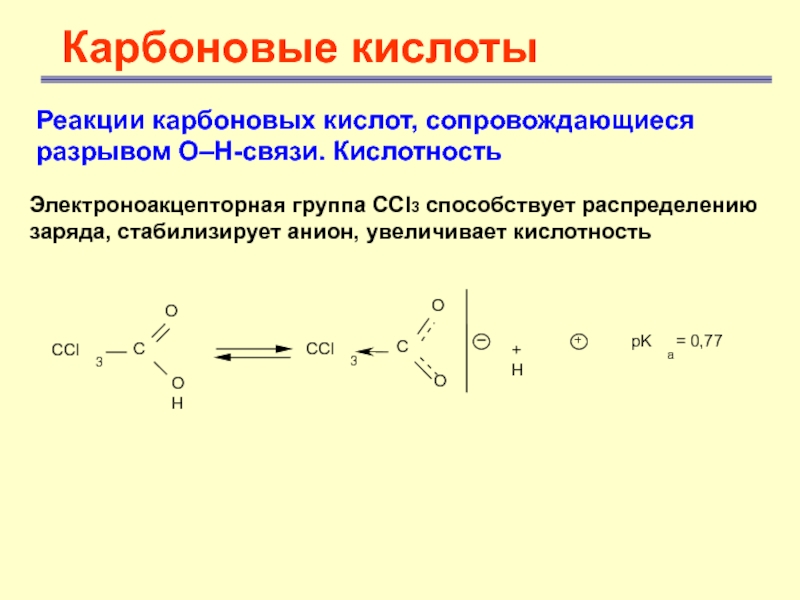
Электроноакцепторная группа
ССl3 способствует распределению заряда, стабилизирует анион, увеличивает кислотность
Слайд 17
Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
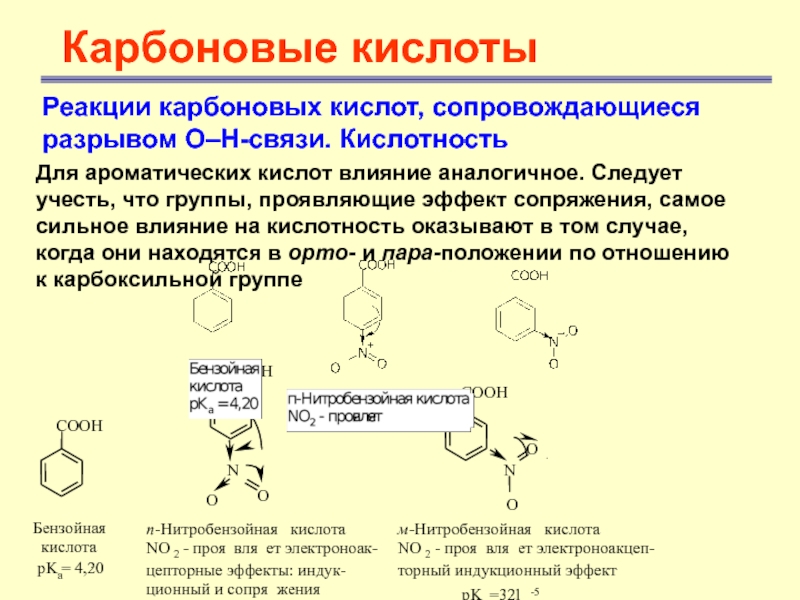
Для ароматических
кислот влияние аналогичное. Следует учесть, что группы, проявляющие эффект сопряжения,
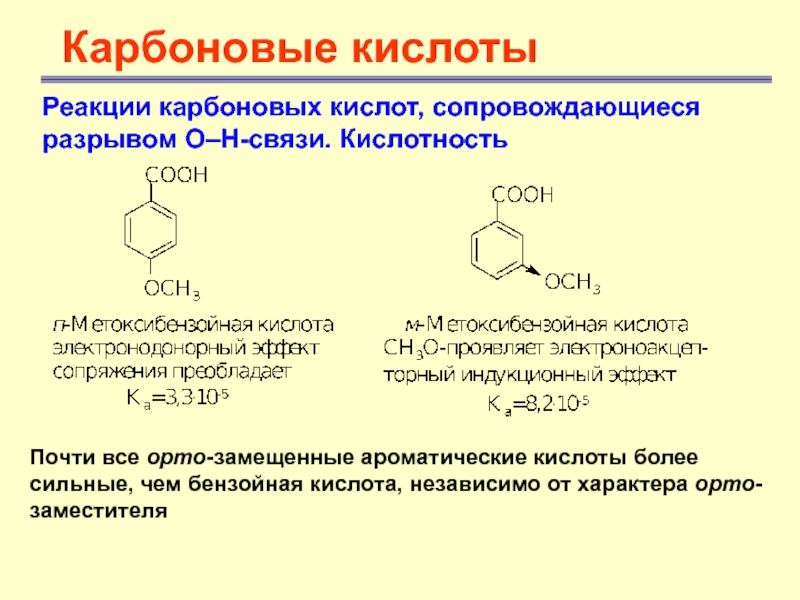
самое сильное влияние на кислотность оказывают в том случае, когда они находятся в орто- и пара-положении по отношению к карбоксильной группеСлайд 18
Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
Почти все
орто-замещенные ароматические кислоты более сильные, чем бензойная кислота, независимо от
характера орто-заместителяСлайд 19
Карбоновые кислоты
Реакции по карбонильному атому углерода, сопровождающиеся разрывом связи С-ОН.
Превращение кислот в их функциональные производные RCOX
Гидроксил кислоты может
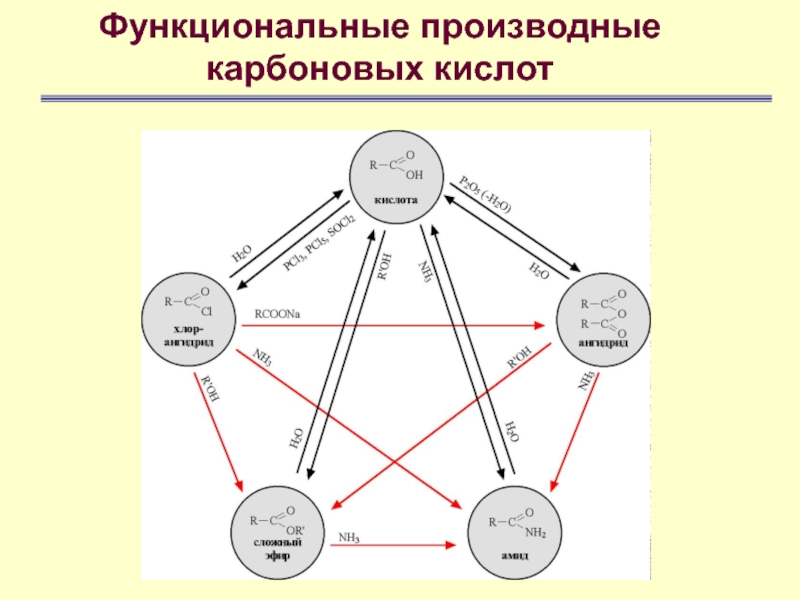
быть замещен рядом других групп –Cl, OR’, NH2 и др., что приводит к образованию соединений, известных под названием хлорангидриды, сложные эфиры, амиды. Это функциональные производные кислот, все они содержат ацильную группу RCO. Функциональные производные легко перевести вновь в кислоты простым гидролизом, они часто могут превращаться также и друг в друга Слайд 20
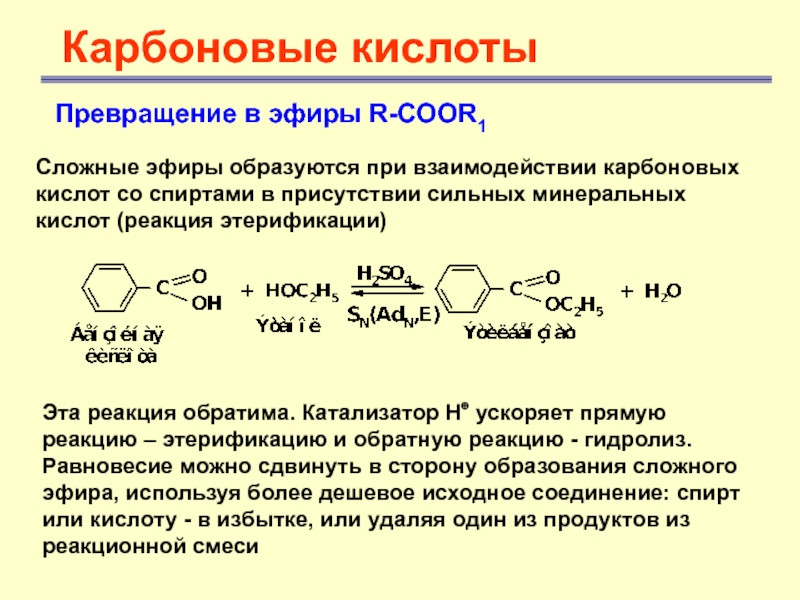
Карбоновые кислоты
Превращение в эфиры R-COOR1
Сложные эфиры образуются при взаимодействии
карбоновых кислот со спиртами в присутствии сильных минеральных кислот (реакция
этерификации)Эта реакция обратима. Катализатор Н⊕ ускоряет прямую реакцию – этерификацию и обратную реакцию - гидролиз. Равновесие можно сдвинуть в сторону образования сложного эфира, используя более дешевое исходное соединение: спирт или кислоту - в избытке, или удаляя один из продуктов из реакционной смеси
Слайд 21
Карбоновые кислоты
Превращение в эфиры R-COOR1
Объемные группы, содержащиеся около реакционного
центра в кислоте или спирте, затрудняют реакцию. В некоторых случаях
пространственные препятствия для сближения молекул настолько велики, что необходимы специальные методы получения сложных эфиров.Реакционная способность в реакции этерификации уменьшается
в ряду спиртов:
СН3ОН > первичные > вторичные > третичные;
в ряду кислот:
НСООН > СН3СООН > RСН2СООН > R1R2CНСООН > R1R2R3CСООН
Слайд 22
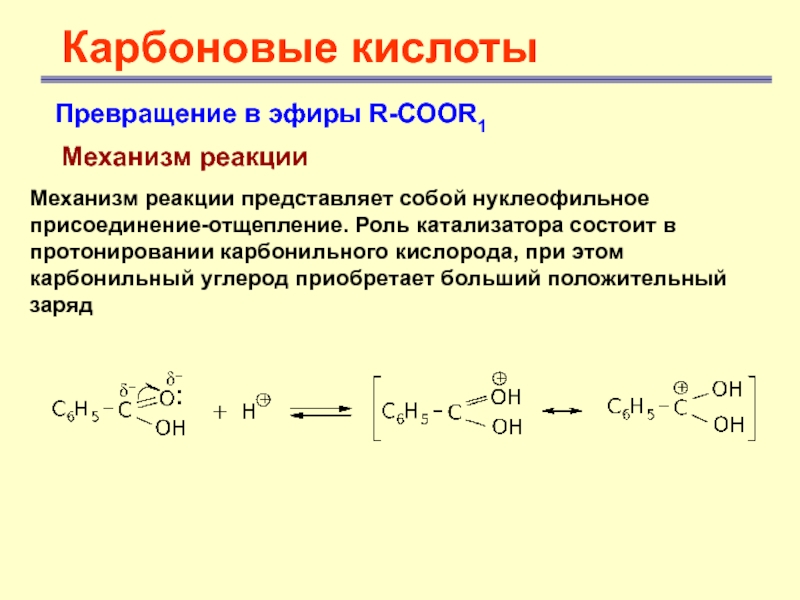
Карбоновые кислоты
Превращение в эфиры R-COOR1
Механизм реакции
Механизм реакции представляет
собой нуклеофильное присоединение-отщепление. Роль катализатора состоит в протонировании карбонильного кислорода,
при этом карбонильный углерод приобретает больший положительный зарядСлайд 23
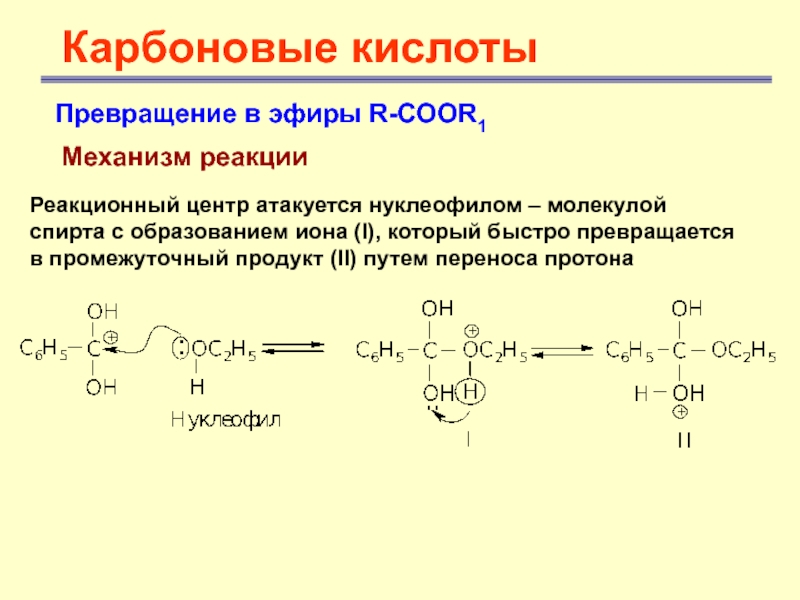
Карбоновые кислоты
Превращение в эфиры R-COOR1
Механизм реакции
Реакционный центр атакуется
нуклеофилом – молекулой спирта с образованием иона (I), который быстро
превращается в промежуточный продукт (II) путем переноса протонаСлайд 24
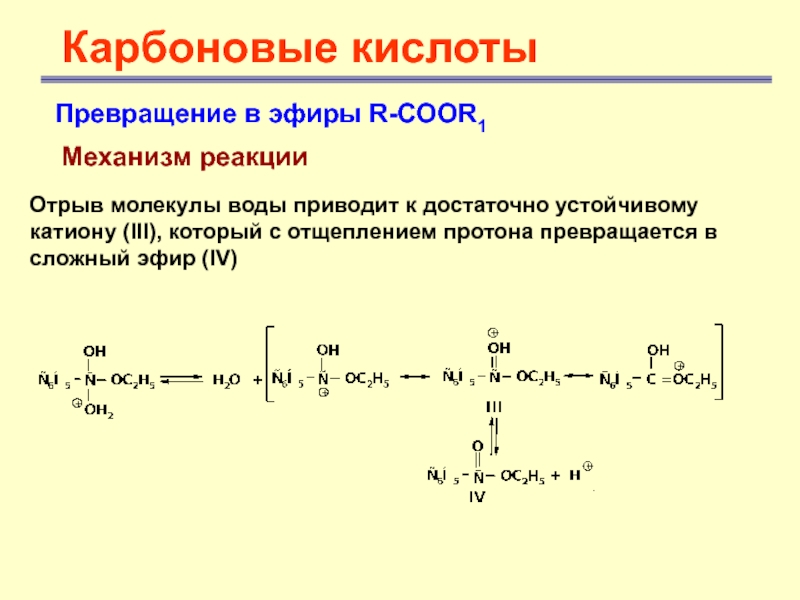
Карбоновые кислоты
Превращение в эфиры R-COOR1
Механизм реакции
Отрыв молекулы воды
приводит к достаточно устойчивому катиону (III), который с отщеплением протона
превращается в сложный эфир (IV)
Слайд 25
Карбоновые кислоты
Превращение в эфиры R-COOR1
Присоединение протона к молекуле спирта
делает спирт нереакционноспособным
Этот антикаталитический эффект при низких концентрациях минеральной кислоты
не препятствуют протеканию реакции, т.к. перекрывается увеличением реакционной способности кислот за счет протонирования карбонильного кислорода. Более высокая концентрация H2SO4 замедляет реакцию.Сложные эфиры можно также получать алкилированием спиртов ангидридами и хлорангидридами кислот
Слайд 26
Карбоновые кислоты
Превращение в галогенангидриды RCOHal
Чаще всего кислоты превращают в
хлорангидриды. Замещение гидроксильной группы -ОН на хлор осуществляют с помощью
тионилхлорида SOCl2, треххлористого фосфора PCl3 или пятихлористого фосфора PCl5Слайд 27
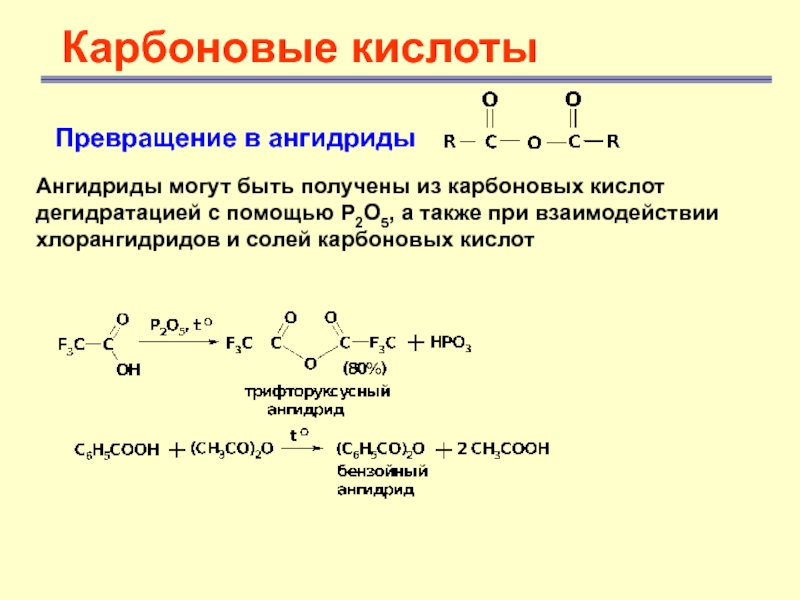
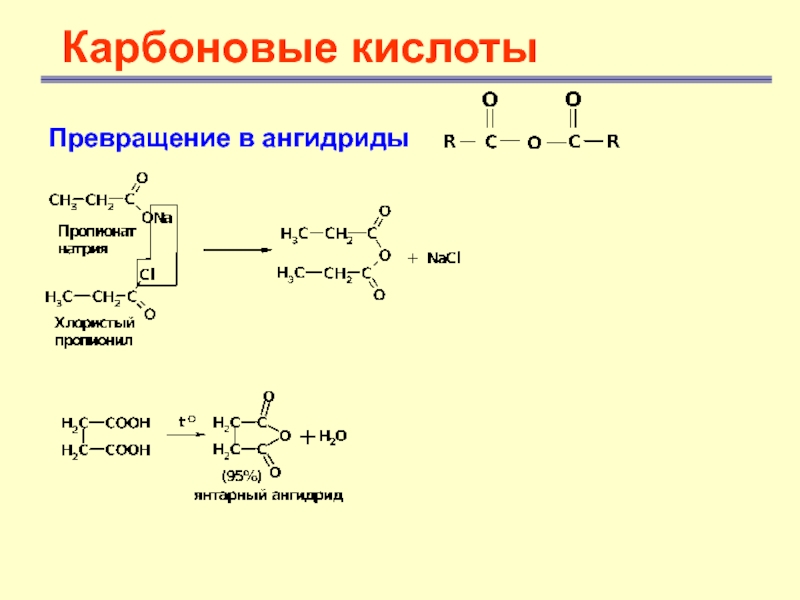
Карбоновые кислоты
Превращение в ангидриды
Ангидриды могут быть получены из карбоновых
кислот дегидратацией с помощью Р2О5, а также при взаимодействии хлорангидридов
и солей карбоновых кислотСлайд 29
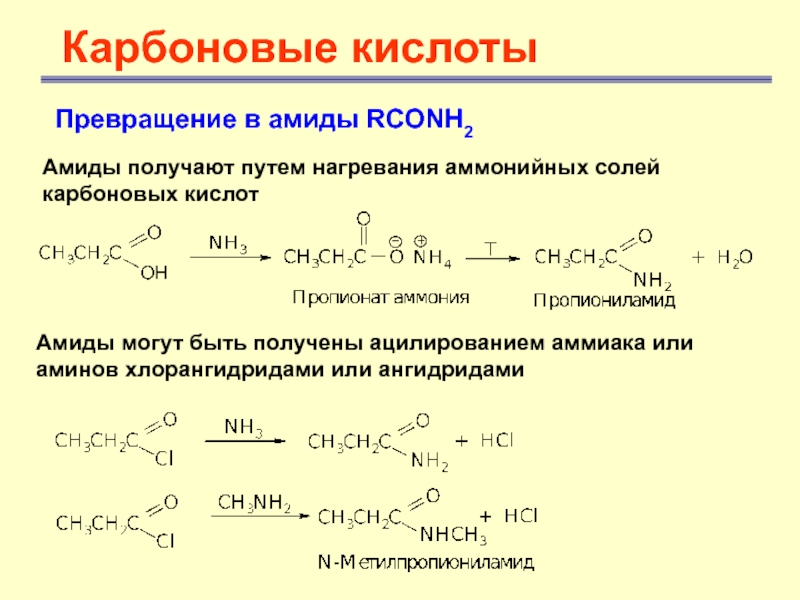
Карбоновые кислоты
Превращение в амиды RCONH2
Амиды получают путем нагревания аммонийных
солей карбоновых кислот
Амиды могут быть получены ацилированием аммиака или
аминов хлорангидридами или ангидридами Слайд 30
Карбоновые кислоты
Замещение в ароматическом ядре
Электроноакцепторная карбоксильная группа, проявляющая эффекты
-I, -M, дезактивирует ароматическое кольцо в реакциях электрофильного замещения
Слайд 31
Карбоновые кислоты
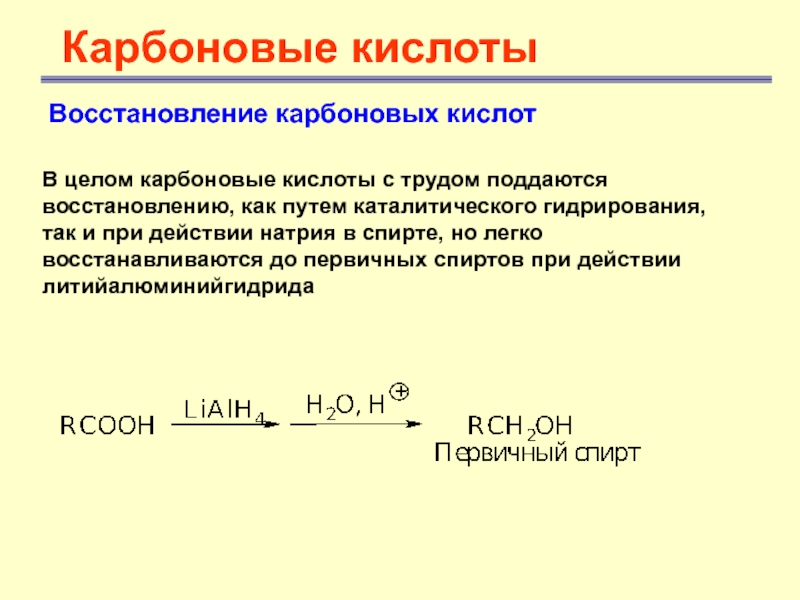
Восстановление карбоновых кислот
В целом карбоновые кислоты с трудом
поддаются восстановлению, как путем каталитического гидрирования, так и при действии
натрия в спирте, но легко восстанавливаются до первичных спиртов при действии литийалюминийгидридаСлайд 32
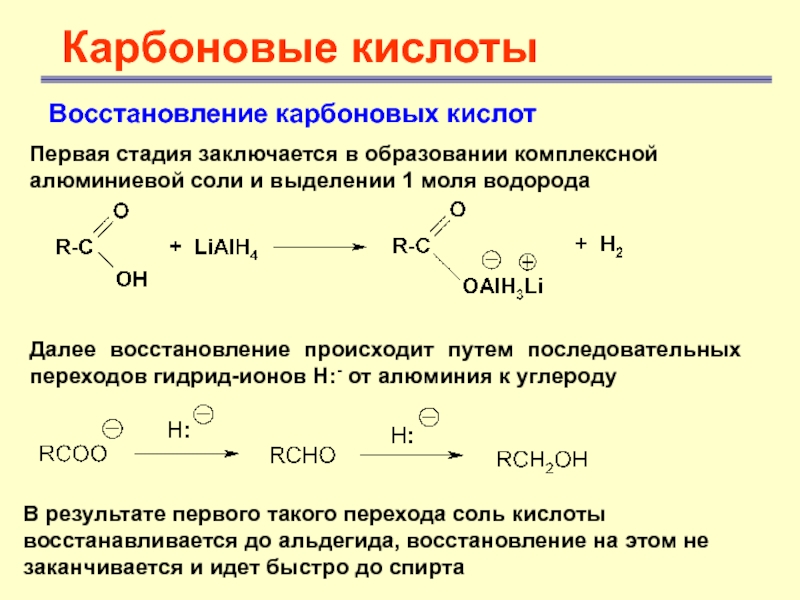
Карбоновые кислоты
Восстановление карбоновых кислот
Далее восстановление происходит путем последовательных переходов
гидрид-ионов Н:- от алюминия к углероду
В результате первого такого перехода
соль кислоты восстанавливается до альдегида, восстановление на этом не заканчивается и идет быстро до спирта Первая стадия заключается в образовании комплексной алюминиевой соли и выделении 1 моля водорода
Слайд 33
Карбоновые кислоты
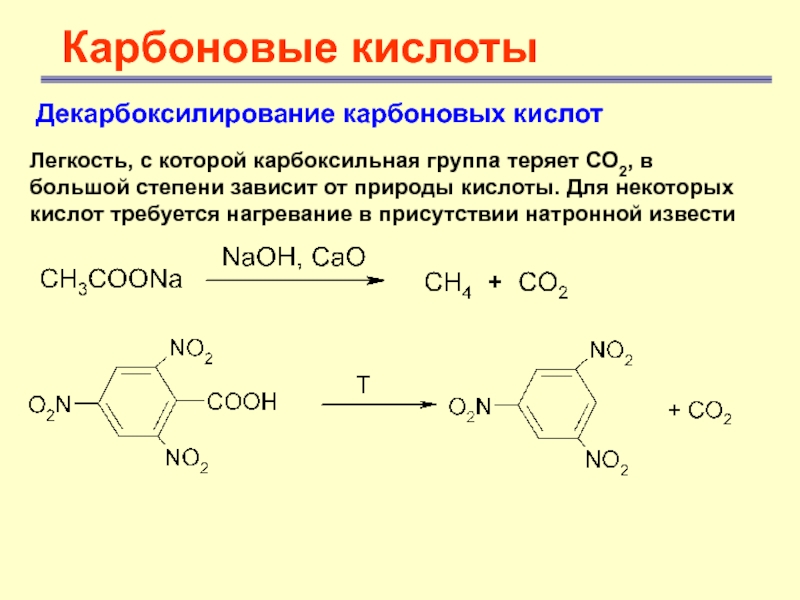
Декарбоксилирование карбоновых кислот
Легкость, с которой карбоксильная группа теряет
СО2, в большой степени зависит от природы кислоты. Для некоторых
кислот требуется нагревание в присутствии натронной извести
Слайд 34
Карбоновые кислоты
Декарбоксилирование карбоновых кислот
Термическое декарбоксилирование происходит с большой легкостью,
когда α-углеродный атом связан сильный электроноакцепторный заместитель
NC-CH2-COOH
Слайд 35
Карбоновые кислоты
Декарбоксилирование карбоновых кислот
Электролиз солей карбоновых кислот по Кольбе
позволяет получать углеводороды
Слайд 36
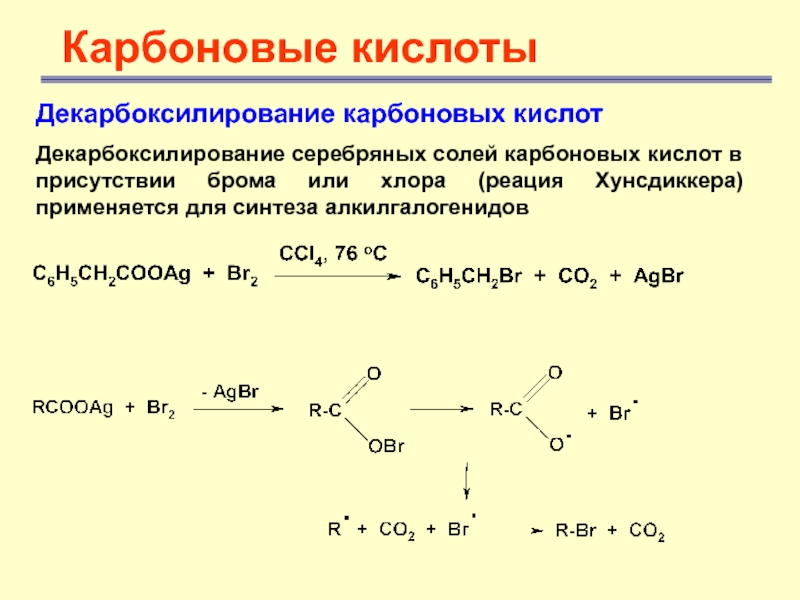
Карбоновые кислоты
Декарбоксилирование карбоновых кислот
Декарбоксилирование серебряных солей карбоновых кислот в
присутствии брома или хлора (реация Хунсдиккера) применяется для синтеза алкилгалогенидов
Слайд 37
Карбоновые кислоты
Реакции замещения у α-углеродного атома
Карбоновые кислоты реагируют с
бромом или хлором в присутствии небольших количеств фосфора с образованием
α-галогензамещенных кислот (реакция Гелля-Фольгарда-Зелинского)Роль фосфора в этой реакции состоит в превращении небольшого количества кислоты в галогенангидрид.
Слайд 38
Карбоновые кислоты
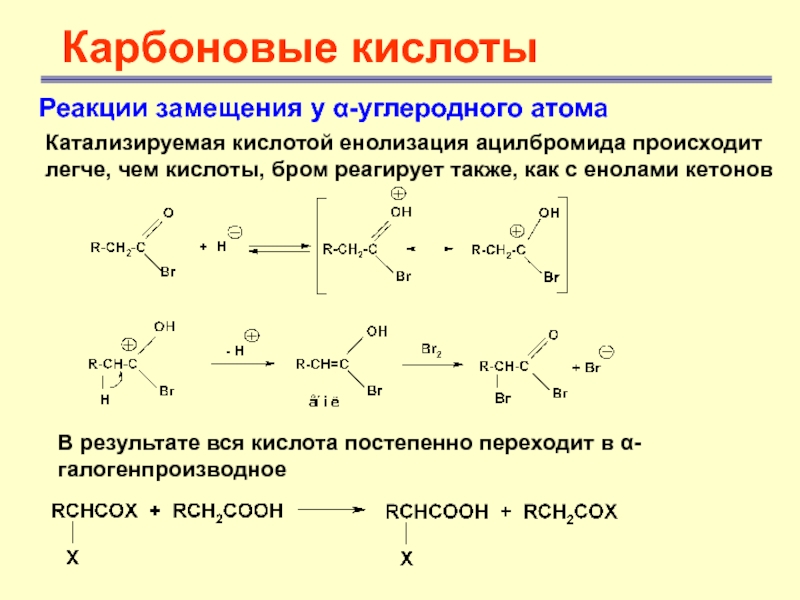
Реакции замещения у α-углеродного атома
Катализируемая кислотой енолизация ацилбромида
происходит легче, чем кислоты, бром реагирует также, как с енолами
кетоновВ результате вся кислота постепенно переходит в α-галогенпроизводное
Слайд 39
Карбоновые кислоты
Реакции замещения у α-углеродного атома
Галоген в этих кислотах
так же, как в галогеналканах замещается при действии нуклеофильных реагентов:
CN, HO, NH3, I, или отщепляется при действии спиртового раствора щелочи
Слайд 40
Карбоновые кислоты
Способы получения
1. Окисление первичных спиртов или альдегидов
2. Окисление алкилбензолов
3. Гидролиз нитрилов
4. Гидролиз тригалогенпроизводных
Слайд 41
Карбоновые кислоты
Способы получения
5. Карбоксилирование реактива Гриньяра
6. Реакция Канницаро
7. Гидролиз
сложных эфиров, хлорангидридов и амидов кислот
Слайд 45
Функциональные производные
карбоновых кислот
К производным карбоновых кислот относятся и нитрилы
так как
при гидролизе они также превращаются в кислотыСлайд 46
Функциональные производные
карбоновых кислот
Химические свойства
Реакционная способность
Ацильные соединения, т.е.
карбоновые кислоты и их функциональные производные, вступают в реакции нуклеофильного
замещения групп Х: –ОН, –Сl, –OCOR, –OR, NH2
Слайд 47
Функциональные производные
карбоновых кислот
Реакционная способность
SN(AdN, E)
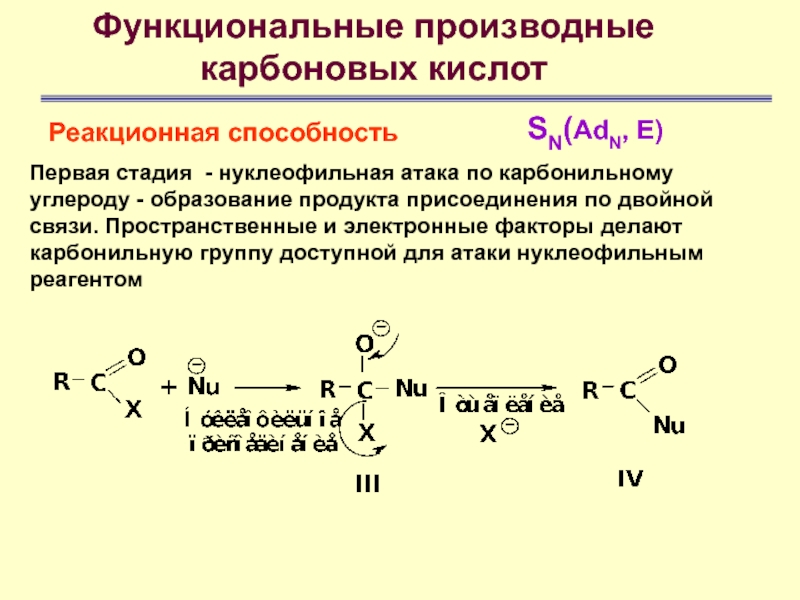
Первая стадия - нуклеофильная
атака по карбонильному углероду - образование продукта присоединения по двойной
связи. Пространственные и электронные факторы делают карбонильную группу доступной для атаки нуклеофильным реагентомСлайд 48
Функциональные производные
карбоновых кислот
Реакционная способность
SN(AdN, E)
Cтабилизация промежуточного аниона происходит
путем отщепления групп, которые являются слабыми основаниями Сl, RCOO или
сравнительно сильными основаниями R1O, NH2Электроотрицательный кислород, легко приобретает и несет на себе отрицательный заряд, возникающий в промежуточном соединении
Таким образом, нуклеофильное замещение в ацильных производных происходит в две стадии: 1) нуклеофильное присоединение по двойной связи С = О с образованием промежуточного тетраэдрического продукта; 2) стабилизация последнего путем отщепления группы Х
Слайд 49
Функциональные производные
карбоновых кислот
Реакционная способность
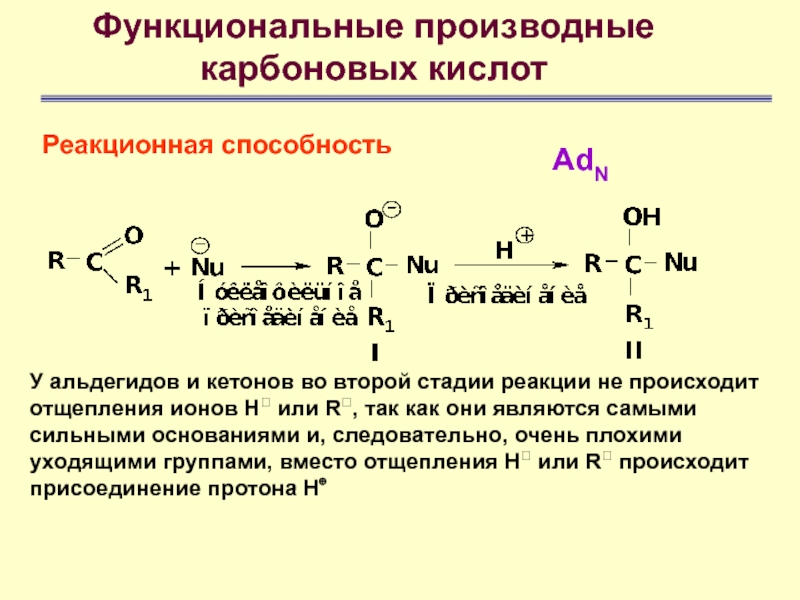
AdN
У альдегидов и кетонов во
второй стадии реакции не происходит отщепления ионов Н или R,
так как они являются самыми сильными основаниями и, следовательно, очень плохими уходящими группами, вместо отщепления Н или R происходит присоединение протона Н⊕Слайд 50
Функциональные производные
карбоновых кислот
Реакционная способность
По легкости протекания второй стадии
ацильные производные располагаются в следующий ряд
Способность быть хорошей уходящей
группой соответственно уменьшается в рядуСлайд 51
Функциональные производные
карбоновых кислот
Реакционная способность
В случае слабого нуклеофила реакция
ацильных соединений катализируется кислотой: протон Н⊕ делает карбонильную группу более
доступной для нуклеофильной атаки (I) и образуется устойчивый незаряженный промежуточный продукт (II)
Слайд 52
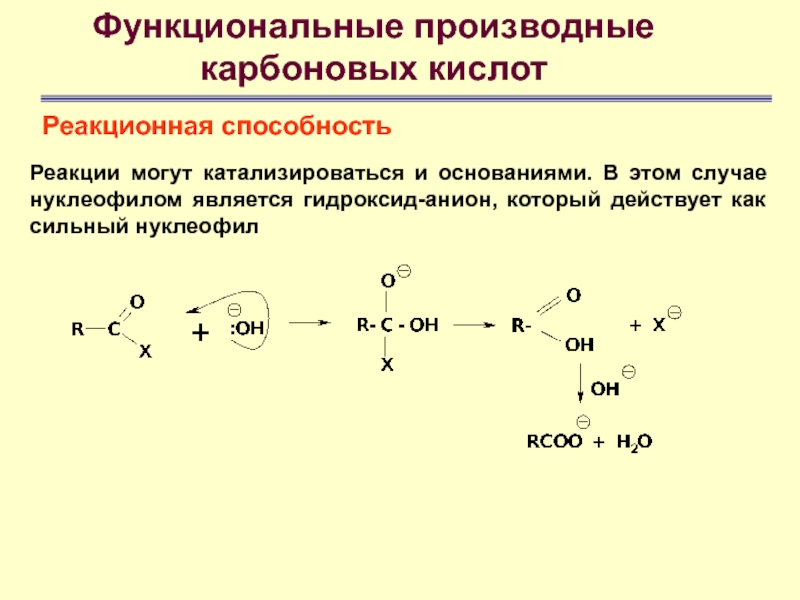
Функциональные производные
карбоновых кислот
Реакционная способность
Реакции могут катализироваться и основаниями.
В этом случае нуклеофилом является гидроксид-анион, который действует как сильный
нуклеофил
Слайд 53
Функциональные производные
карбоновых кислот
Реакции замещения группы Х у карбонильного
атома
углерода
Наиболее важными реакциями производных кислот
являются следующие:
Гидролиз –
превращение в кислоты Алкоголиз – превращение в сложные эфиры
Аммонолиз – превращение в амиды
Слайд 54
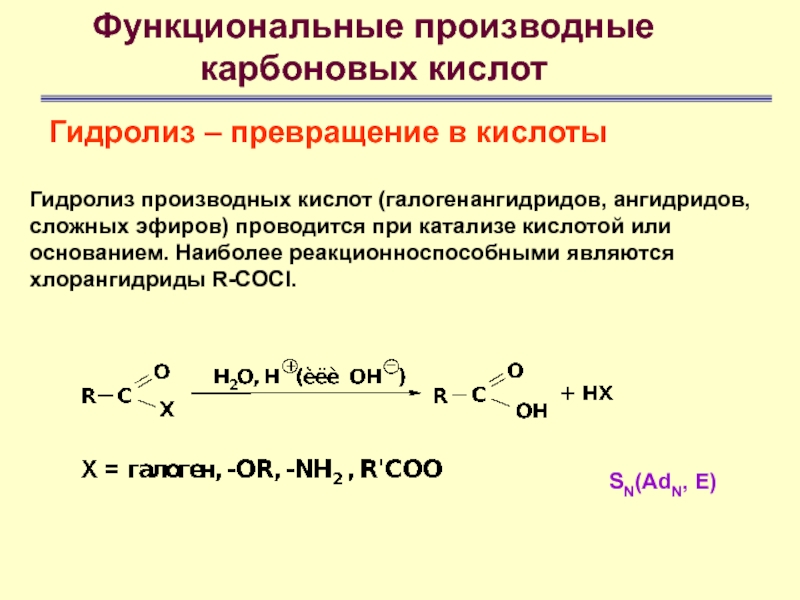
Функциональные производные
карбоновых кислот
Гидролиз – превращение в кислоты
Гидролиз производных
кислот (галогенангидридов, ангидридов, сложных эфиров) проводится при катализе кислотой или
основанием. Наиболее реакционноспособными являются хлорангидриды R-COCl.SN(AdN, E)
Слайд 55
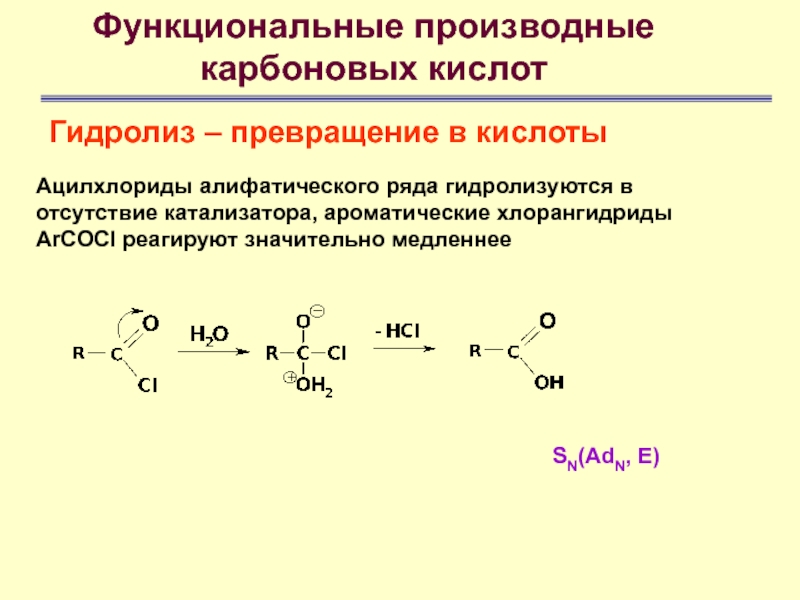
Функциональные производные
карбоновых кислот
Гидролиз – превращение в кислоты
Ацилхлориды алифатического
ряда гидролизуются в отсутствие катализатора, ароматические хлорангидриды ArCOCl реагируют значительно
медленнееSN(AdN, E)
Слайд 56
Функциональные производные
карбоновых кислот
Гидролиз – превращение в кислоты
SN(AdN, E)
Реакция
гидролиза сложных эфиров в присутствии кислоты обратна реакции этерификации
Слайд 57
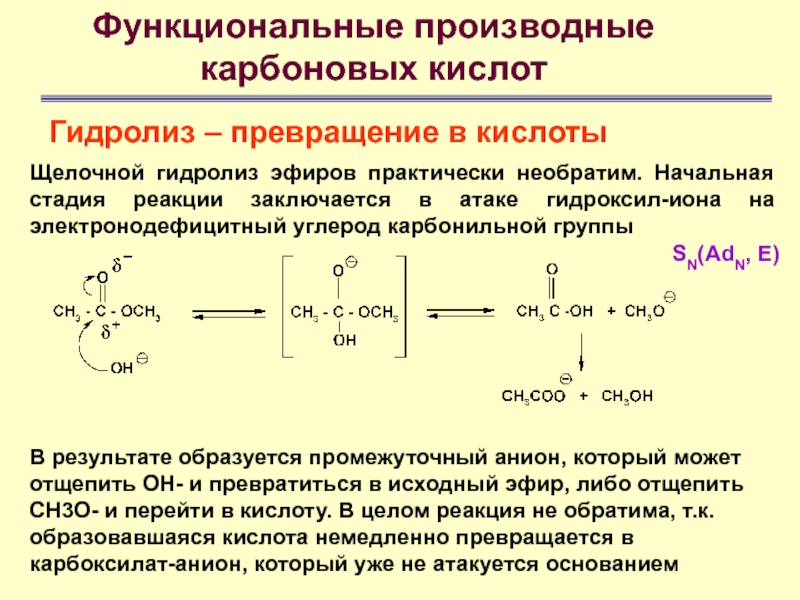
Функциональные производные
карбоновых кислот
Гидролиз – превращение в кислоты
SN(AdN, E)
Щелочной
гидролиз эфиров практически необратим. Начальная стадия реакции заключается в атаке
гидроксил-иона на электронодефицитный углерод карбонильной группыВ результате образуется промежуточный анион, который может отщепить ОН- и превратиться в исходный эфир, либо отщепить СН3О- и перейти в кислоту. В целом реакция не обратима, т.к. образовавшаяся кислота немедленно превращается в карбоксилат-анион, который уже не атакуется основанием
Слайд 58
Функциональные производные
карбоновых кислот
Гидролиз – превращение в кислоты
SN(AdN, E)
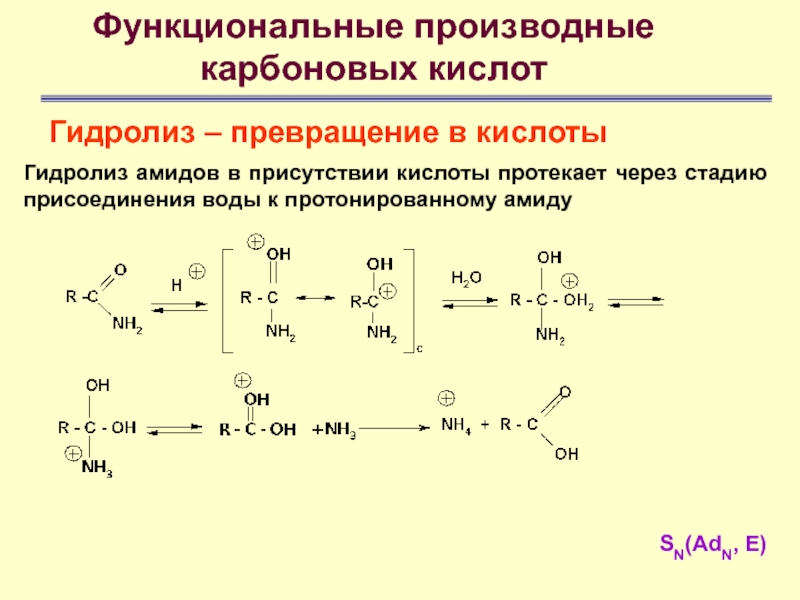
Гидролиз
амидов в присутствии кислоты протекает через стадию присоединения воды к
протонированному амиду
Слайд 59
Функциональные производные
карбоновых кислот
Гидролиз – превращение в кислоты
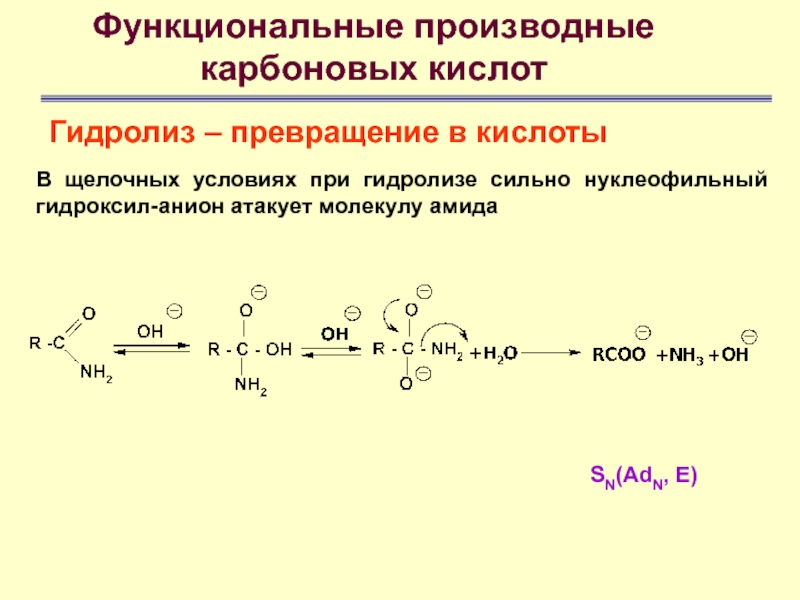
SN(AdN, E)
В
щелочных условиях при гидролизе сильно нуклеофильный гидроксил-анион атакует молекулу амида
Слайд 60
Функциональные производные
карбоновых кислот
Гидролиз – превращение в кислоты
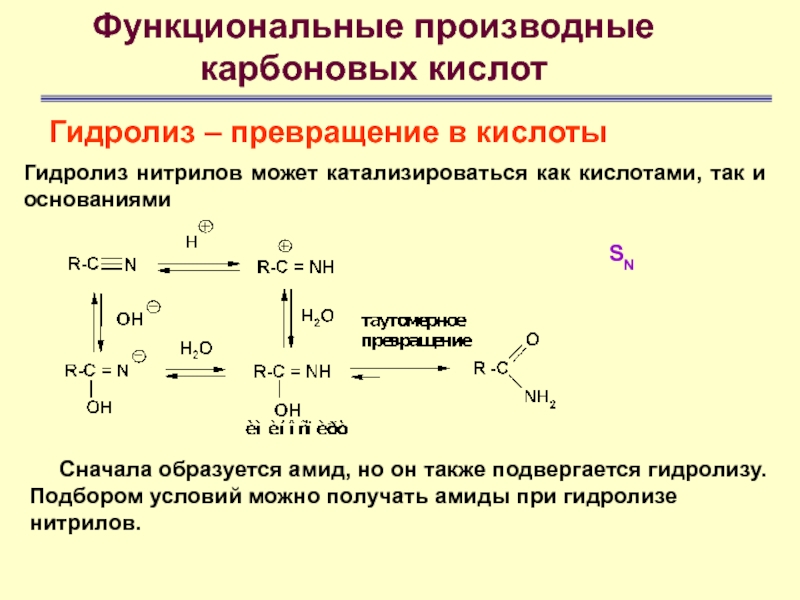
SN
Гидролиз нитрилов
может катализироваться как кислотами, так и основаниями
Сначала образуется амид, но
он также подвергается гидролизу. Подбором условий можно получать амиды при гидролизе нитрилов.Слайд 61
Функциональные производные
карбоновых кислот
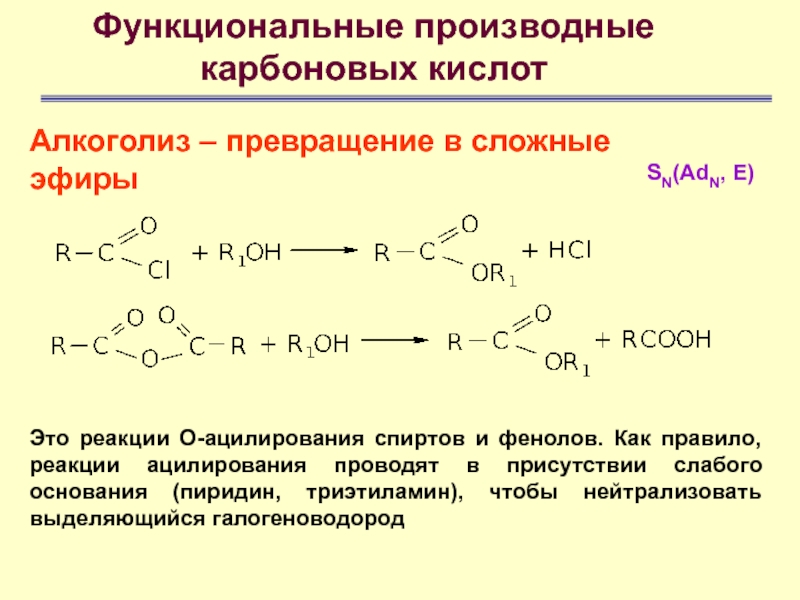
Алкоголиз – превращение в сложные эфиры
Это реакции
О-ацилирования спиртов и фенолов. Как правило, реакции ацилирования проводят в
присутствии слабого основания (пиридин, триэтиламин), чтобы нейтрализовать выделяющийся галогеноводородSN(AdN, E)
Слайд 62
Функциональные производные
карбоновых кислот
Алкоголиз – превращение в сложные эфиры
SN(AdN, E)
Слайд 63
Функциональные производные
карбоновых кислот
Алкоголиз – превращение в сложные эфиры
SN(AdN, E)
Слайд 64
Функциональные производные
карбоновых кислот
Алкоголиз – превращение в сложные эфиры
Механизм реакций
следующий
Это реакция Шоттена-Баумана
SN(AdN, E)
Слайд 65
Функциональные производные
карбоновых кислот
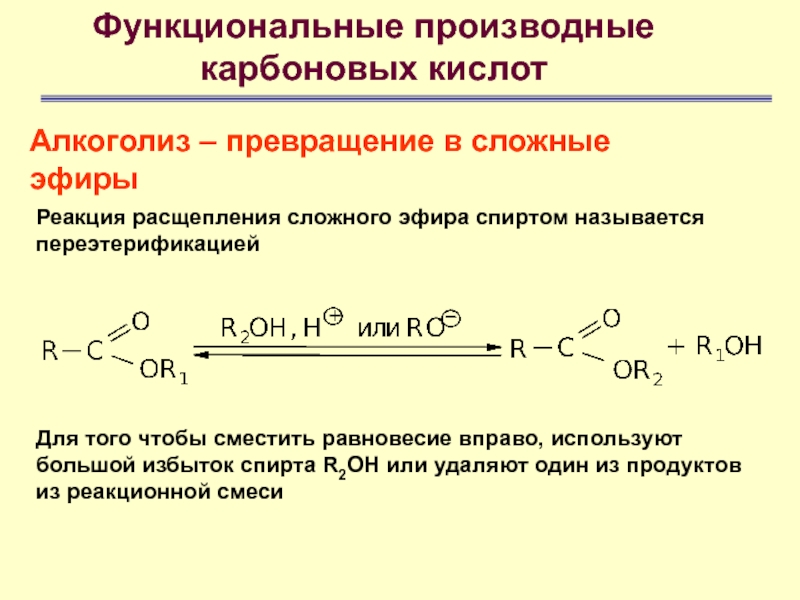
Алкоголиз – превращение в сложные эфиры
Реакция расщепления
сложного эфира спиртом называется переэтерификацией
Для того чтобы сместить равновесие
вправо, используют большой избыток спирта R2OH или удаляют один из продуктов из реакционной смеси Слайд 66
Функциональные производные
карбоновых кислот
Алкоголиз – превращение в сложные эфиры
Примером использования
реакции переэтерификации служит синтез поливинилового спирта
При полимеризации винилацетата образуется
поливинилацетат
Слайд 67
Функциональные производные
карбоновых кислот
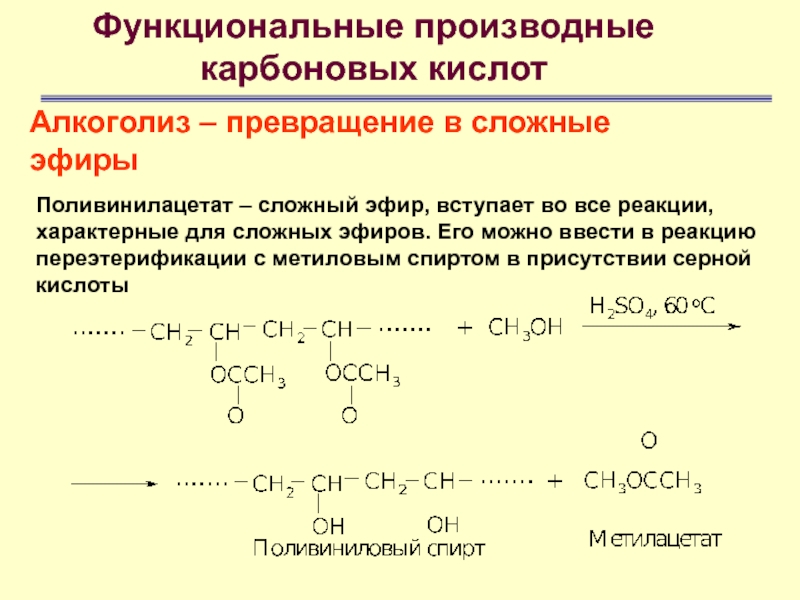
Алкоголиз – превращение в сложные эфиры
Поливинилацетат –
сложный эфир, вступает во все реакции, характерные для сложных эфиров.
Его можно ввести в реакцию переэтерификации с метиловым спиртом в присутствии серной кислоты
Слайд 71
Функциональные производные
карбоновых кислот
Превращение в нитрилы R-C≡N
можно осуществить обезвоживанием
амидов посредством фосфорного ангидрида
Другой путь получения нитрилов – реакция
галогеналканов с солями синильной кислоты Слайд 72
Функциональные производные
карбоновых кислот
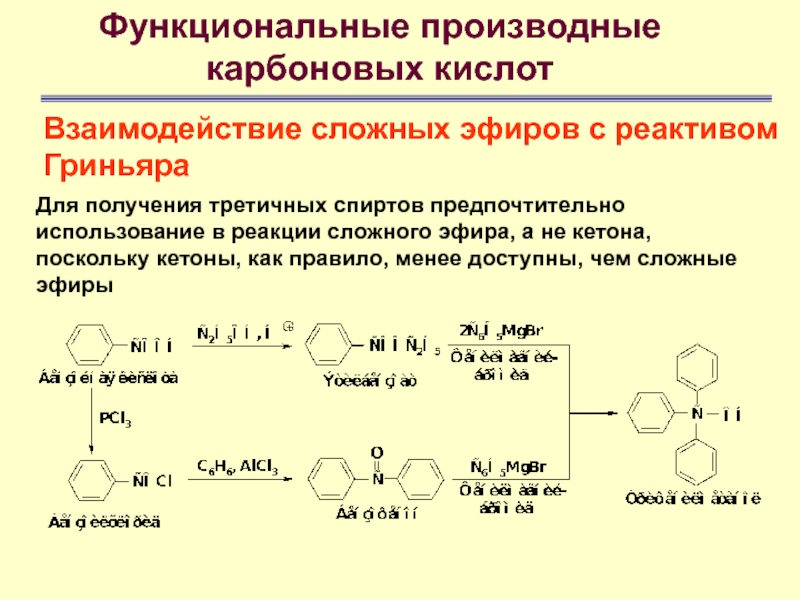
Взаимодействие сложных эфиров с реактивом
Гриньяра
прекрасный
метод получения кетонов и третичных спиртов
Слайд 73
Функциональные производные
карбоновых кислот
Взаимодействие сложных эфиров с реактивом
Гриньяра
Если
в реакцию вводится удвоенное количество реактива Гриньяра, то продуктом реакции
будет третичный спирт
Слайд 74
Функциональные производные
карбоновых кислот
Взаимодействие сложных эфиров с реактивом
Гриньяра
Для
получения третичных спиртов предпочтительно использование в реакции сложного эфира, а
не кетона, поскольку кетоны, как правило, менее доступны, чем сложные эфирыСлайд 75
Функциональные производные
карбоновых кислот
Взаимодействие сложных эфиров с реактивом
Гриньяра
Реакция
эфиров муравьиной кислоты НСООR, содержащих атом водорода при углероде карбонильной
группы, с реактивом Гриньяра – отличный метод получения симметричных вторичных спиртов RCH(OH)RСлайд 76
Функциональные производные
карбоновых кислот
Реакции сложного эфира по α-углеродному
атому
Под
действием оснований происходит реакция автоконденсации этилацетата, приводящая к этиловому эфиру
ацетоуксусной кислоты (этилацетоацетат)Конденсация Кляйзена
Слайд 78
Функциональные производные
карбоновых кислот
Водороды у α-углеродного атома сложного эфира так
же, как в альдегидах и кетонах, обладают слабыми кислотными свойствами.
Сильное основание может отрывать подвижный водород с образованием устойчивого аниона (I)Реакции сложного эфира по α-углеродному
атому
Слайд 79
Функциональные производные
карбоновых кислот
Реакции сложного эфира по α-углеродному
атому
Образующийся
анион (I) - сильный нуклеофил - атакует карбонильный атом второй
молекулы сложного эфира. Промежуточное соединение (II) стабилизируется отщеплением аниона С2Н5О, давая продукт сложноэфирной конденсации (III)SN(AN, Е)
Механизм конденсации представляет собой нуклеофильное замещение в производных кислот, одна молекула сложного эфира является субстратом, а вторая - дает карбанион - нуклеофильный реагент
Слайд 80
Функциональные производные
карбоновых кислот
Реакции сложного эфира по α-углеродному
атому
Поскольку
из ряда равновесий, устанавливающихся в ходе реакции, лишь последнее сдвинуто
в сторону образования целевого продукта, для успешного проведения реакции следует применять большой избыток этоксида натрияСлайд 81
Функциональные производные
карбоновых кислот
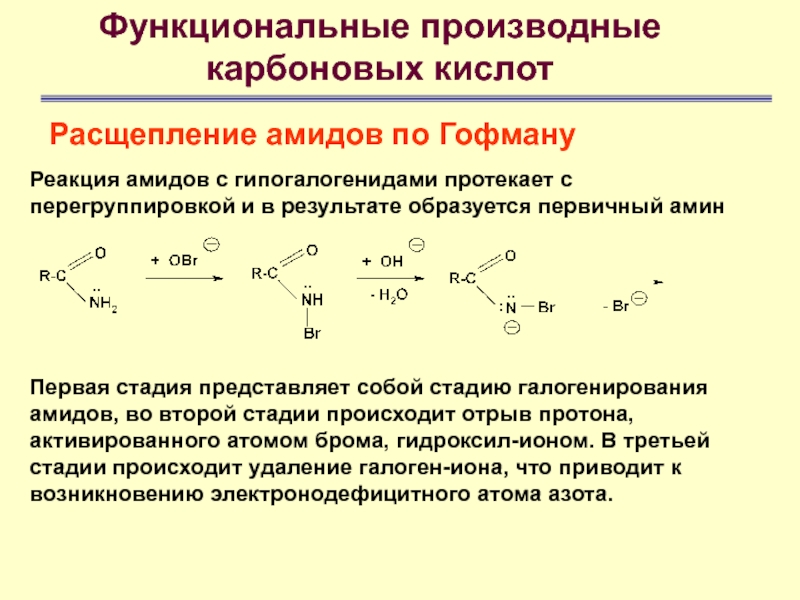
Расщепление амидов по Гофману
Реакция амидов с
гипогалогенидами протекает с перегруппировкой и в результате образуется первичный амин
Первая стадия представляет собой стадию галогенирования амидов, во второй стадии происходит отрыв протона, активированного атомом брома, гидроксил-ионом. В третьей стадии происходит удаление галоген-иона, что приводит к возникновению электронодефицитного атома азота.
Слайд 82
Функциональные производные
карбоновых кислот
Расщепление амидов по Гофману
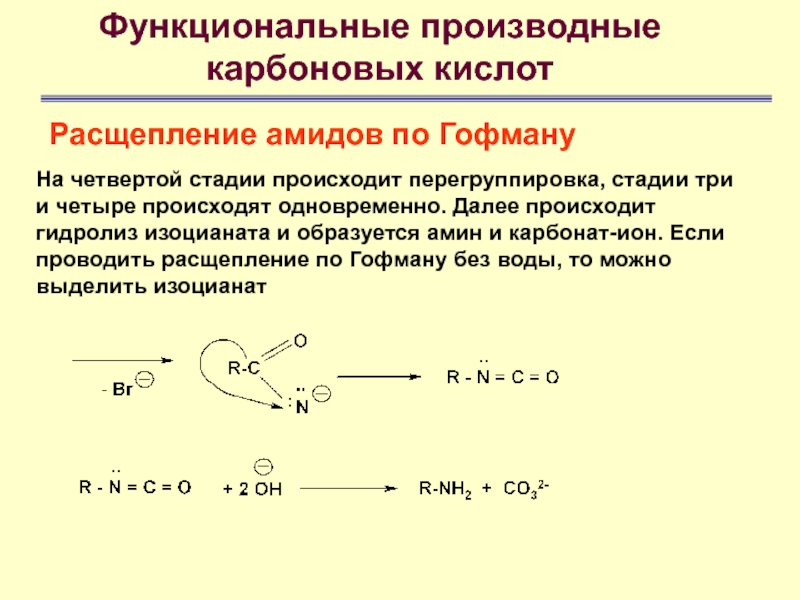
На четвертой стадии
происходит перегруппировка, стадии три и четыре происходят одновременно. Далее происходит
гидролиз изоцианата и образуется амин и карбонат-ион. Если проводить расщепление по Гофману без воды, то можно выделить изоцианатСлайд 84
Функциональные производные
карбоновых кислот
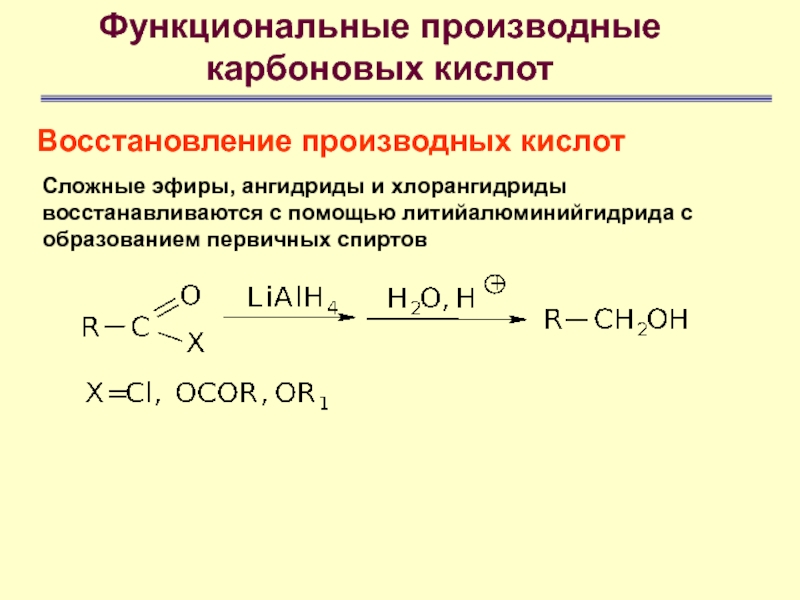
Восстановление производных кислот
Сложные эфиры, ангидриды и
хлорангидриды восстанавливаются с помощью литийалюминийгидрида с образованием первичных спиртов
Слайд 85
Функциональные производные
карбоновых кислот
Восстановление производных кислот
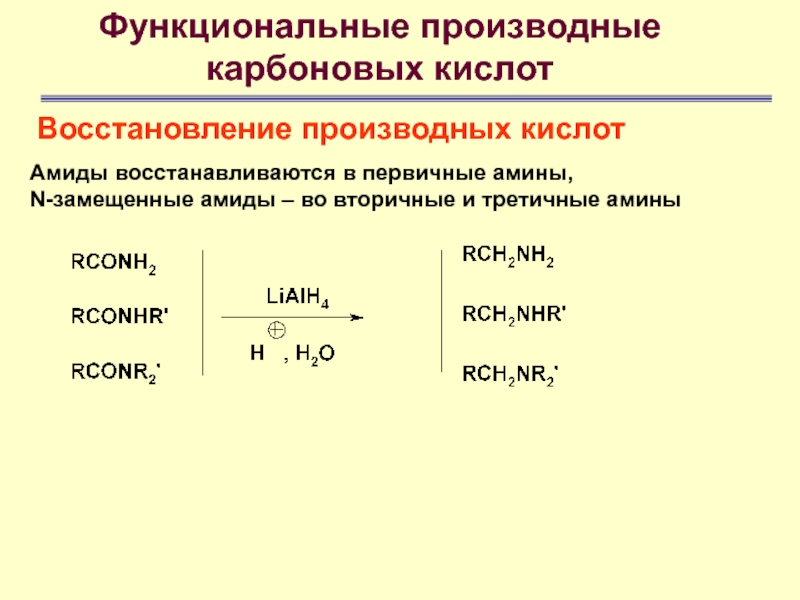
Амиды восстанавливаются в первичные
амины,
N-замещенные амиды – во вторичные и третичные амины
Слайд 86
Функциональные производные
карбоновых кислот
Восстановление производных кислот
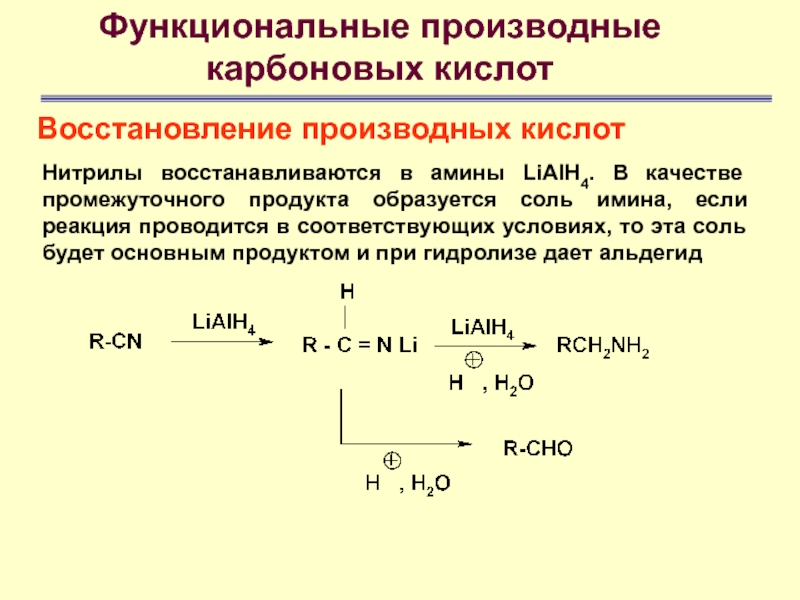
Нитрилы восстанавливаются в амины
LiAlH4. В качестве промежуточного продукта образуется соль имина, если реакция
проводится в соответствующих условиях, то эта соль будет основным продуктом и при гидролизе дает альдегид