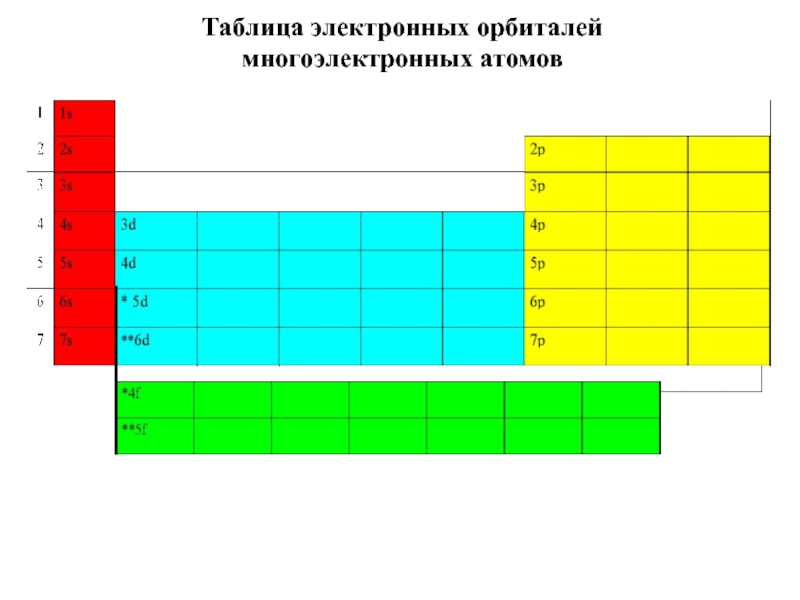
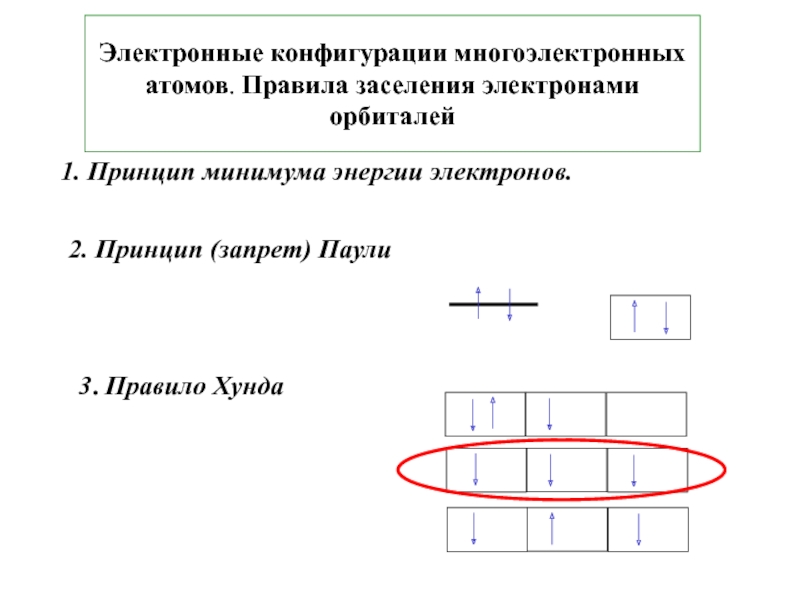
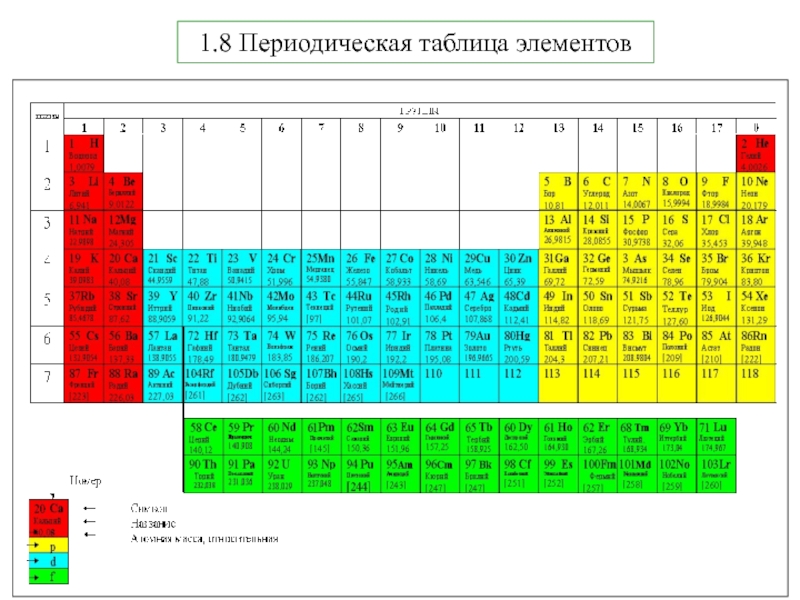
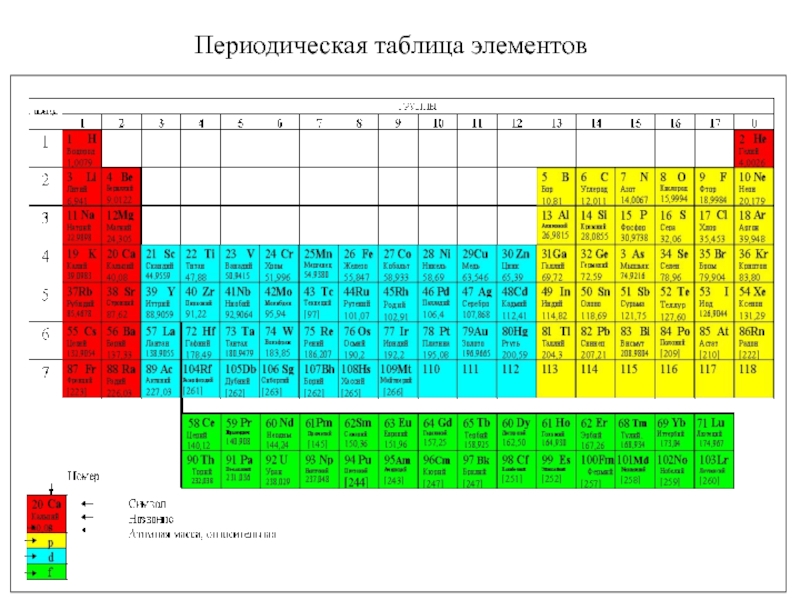
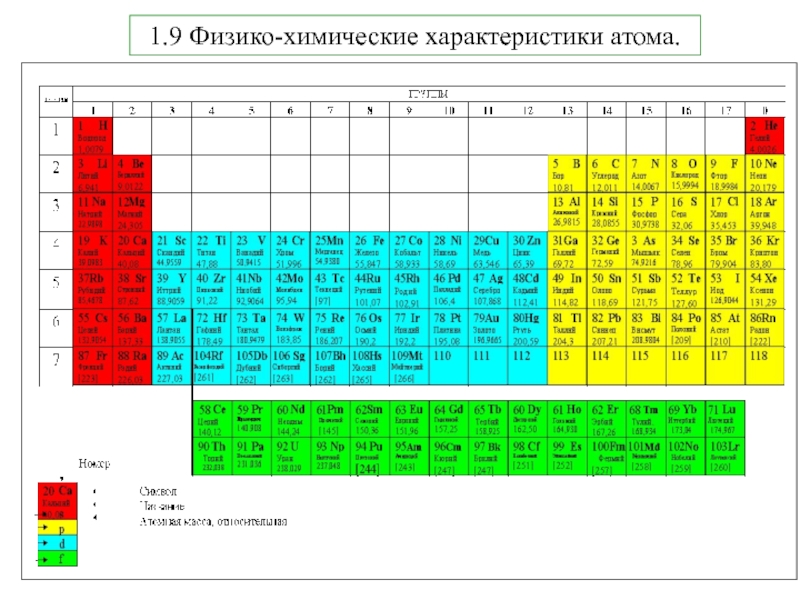
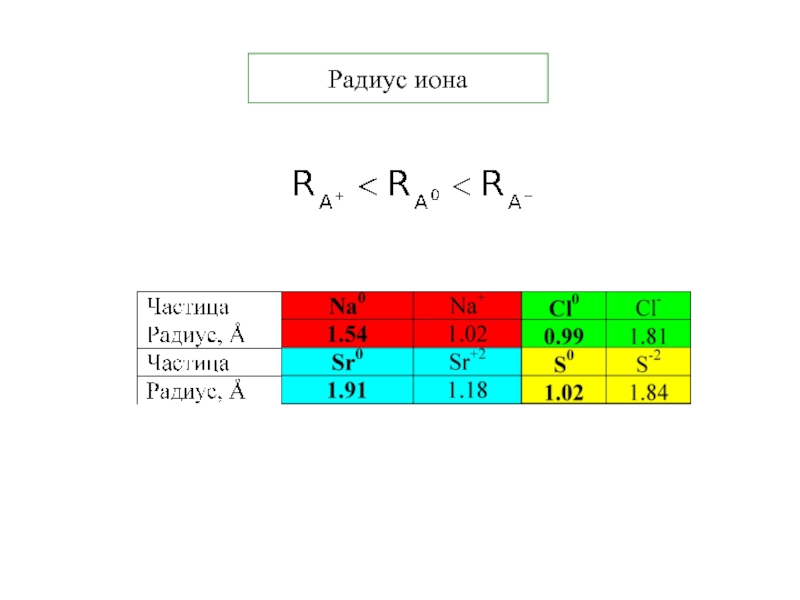
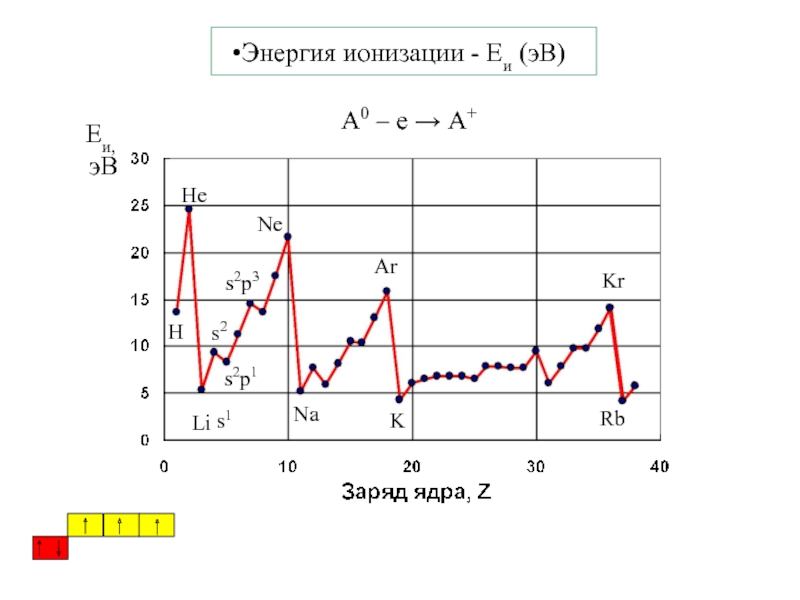
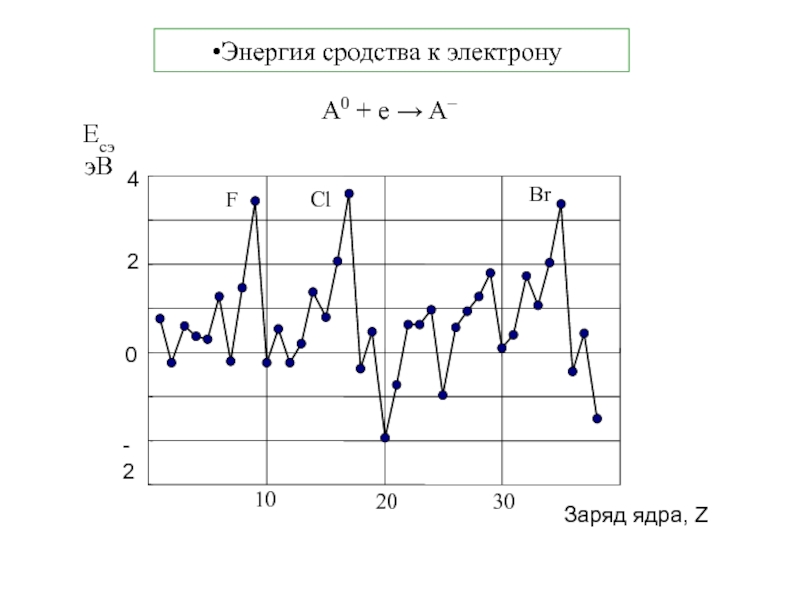
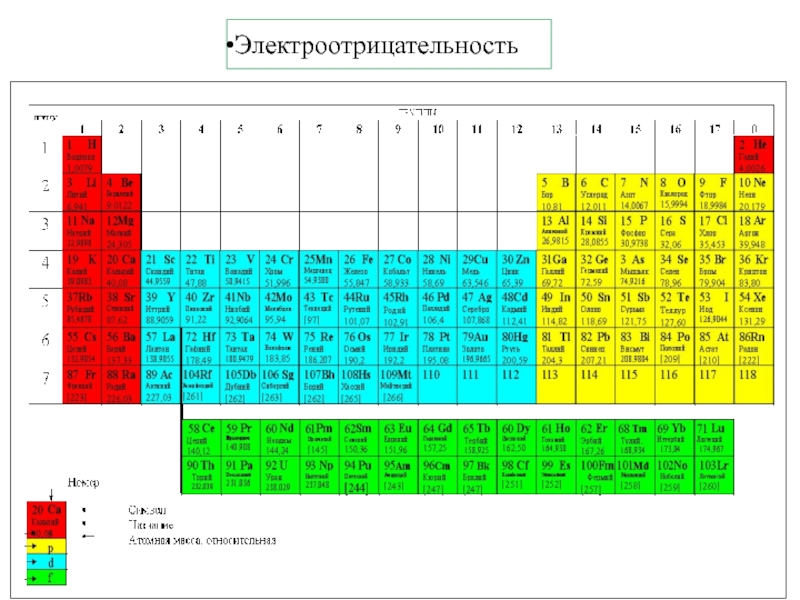
5. В.В.Фролов 6. Н.В.Коровин
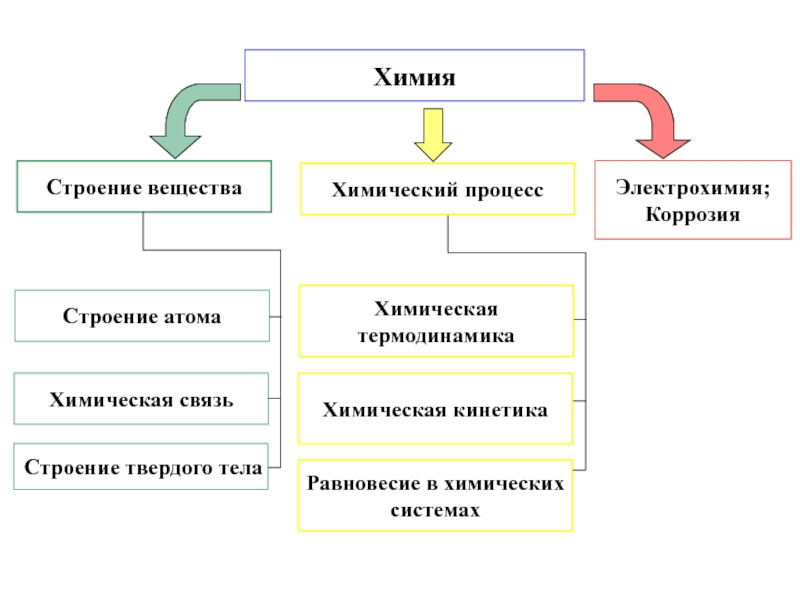
Часть 1 Строение
вещества 2002 г.(552)Часть 2 Термодин.и кинетика химического процесса 2003 г.(599)
- теоретические основы
Часть 3 Электрохим. и коррозионные процессы 2007(837)





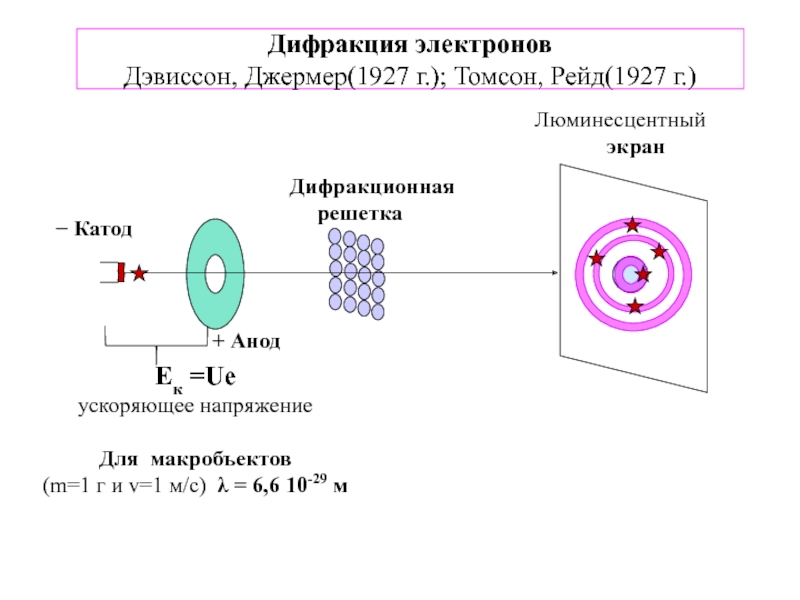

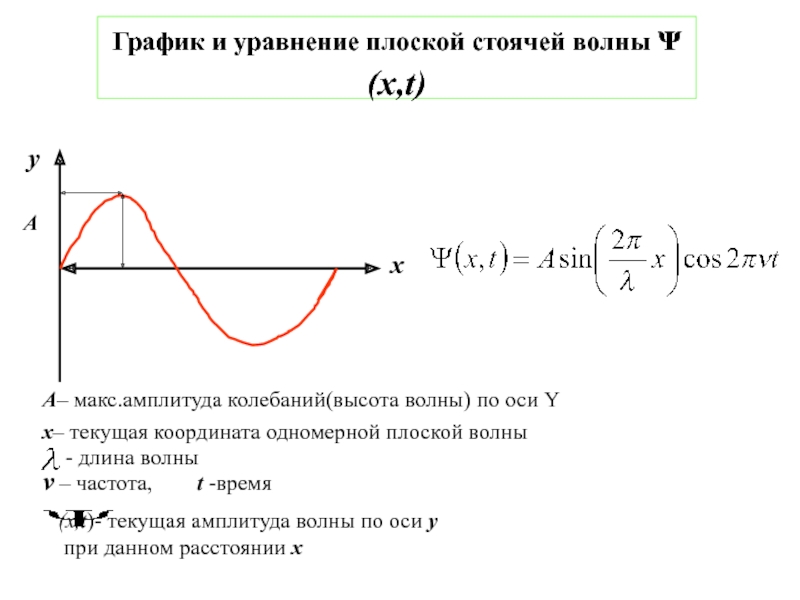





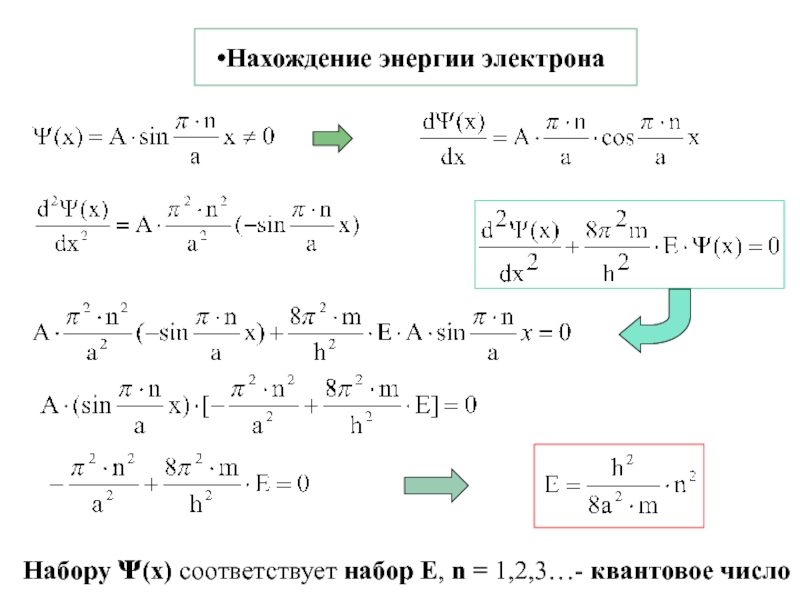
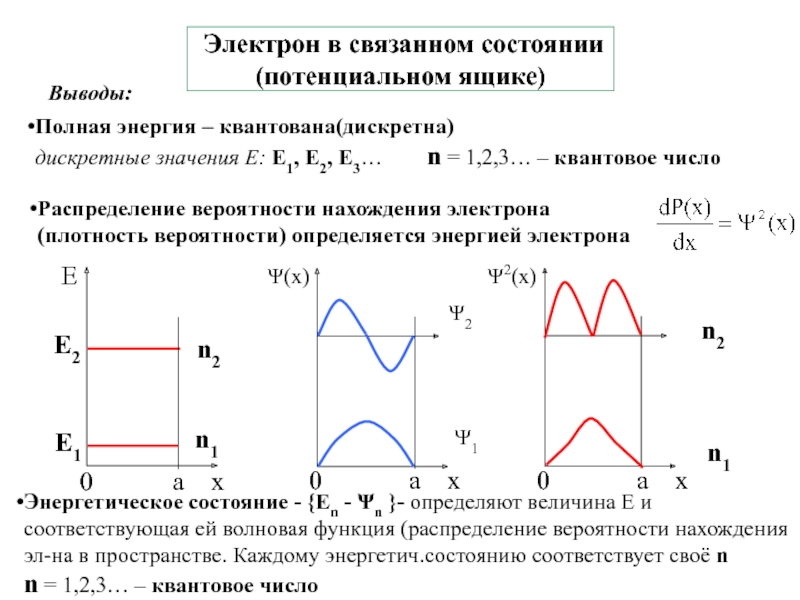


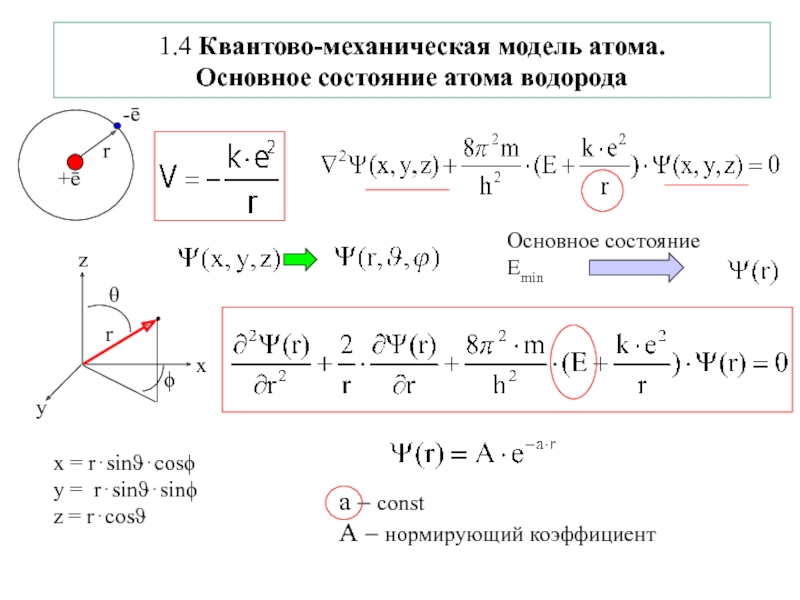

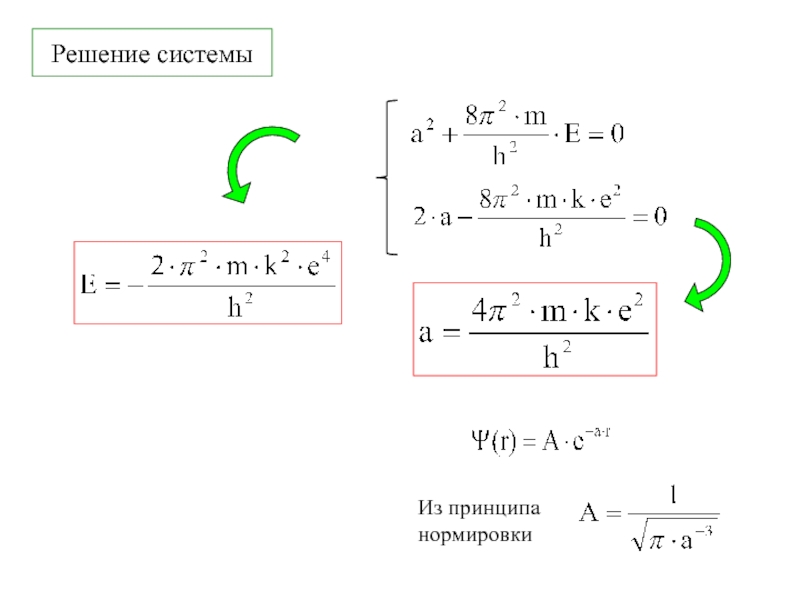
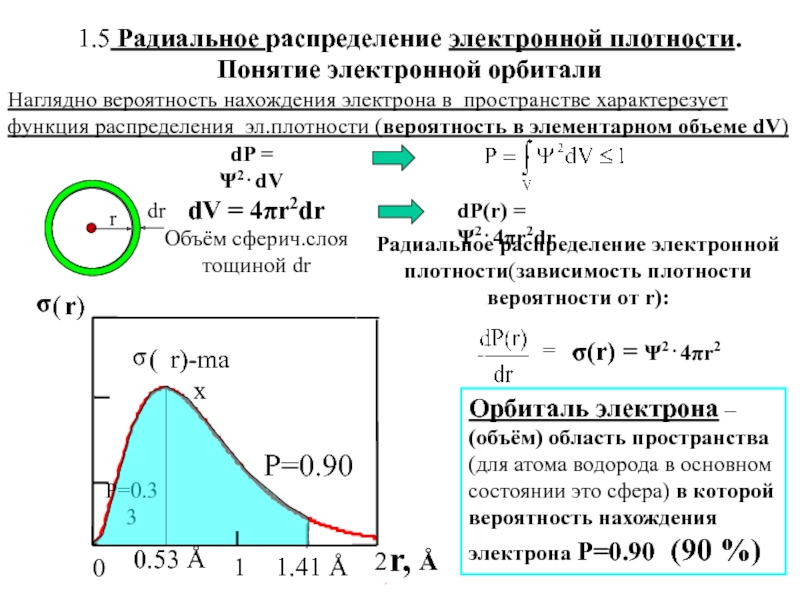
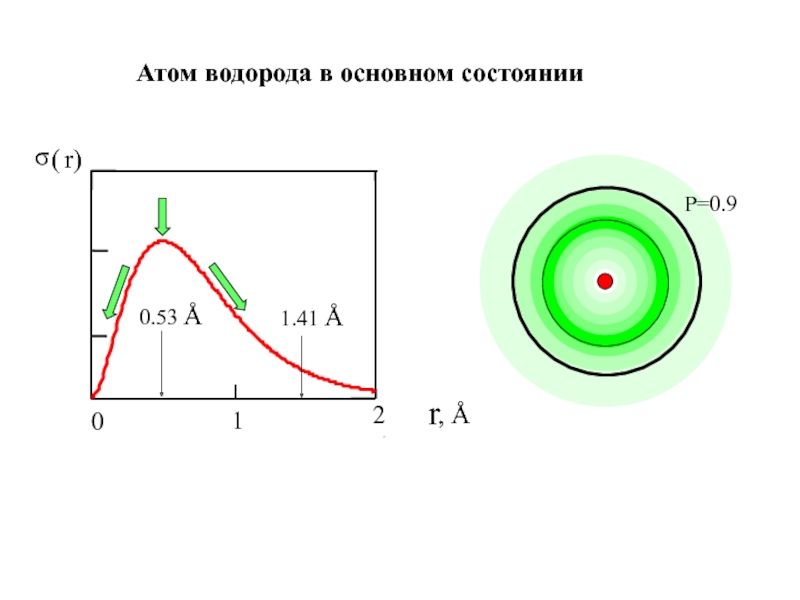
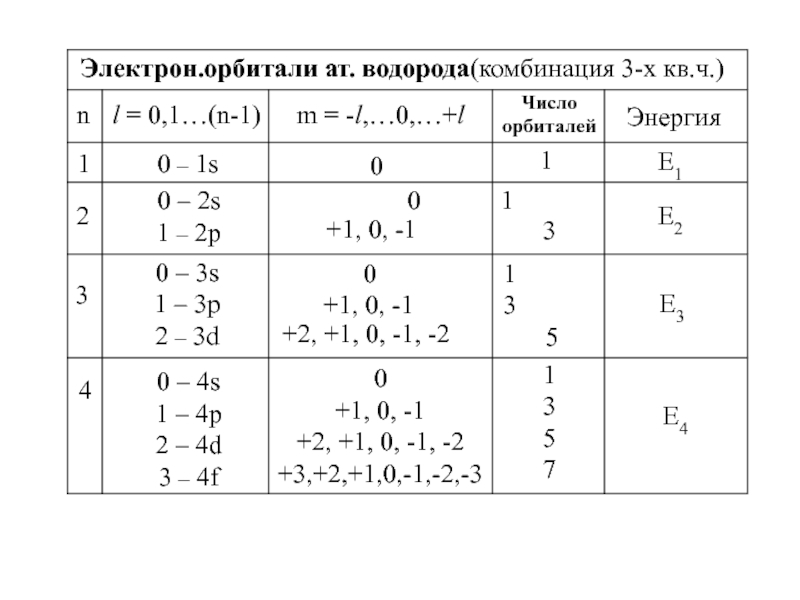
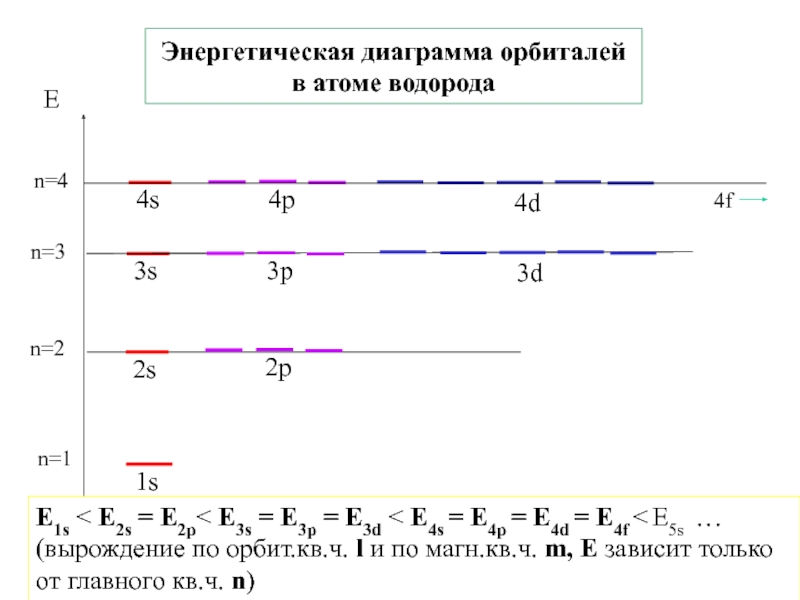
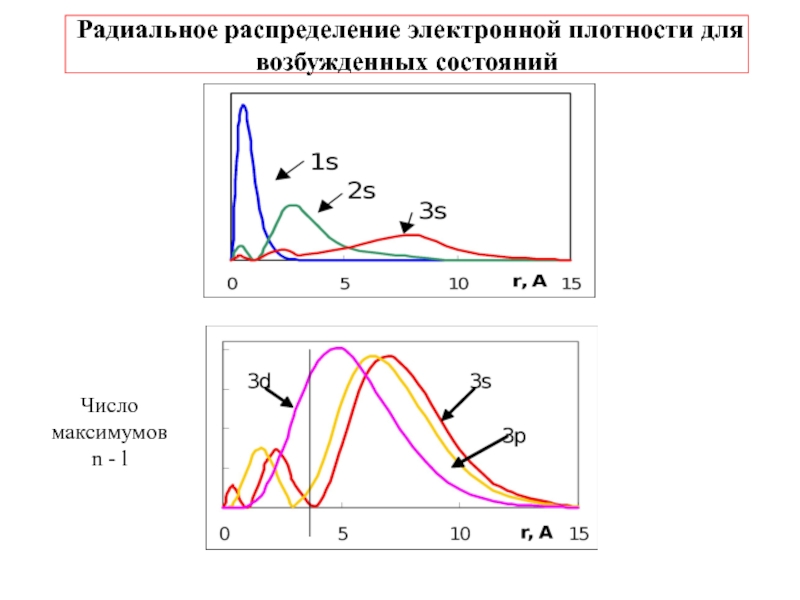
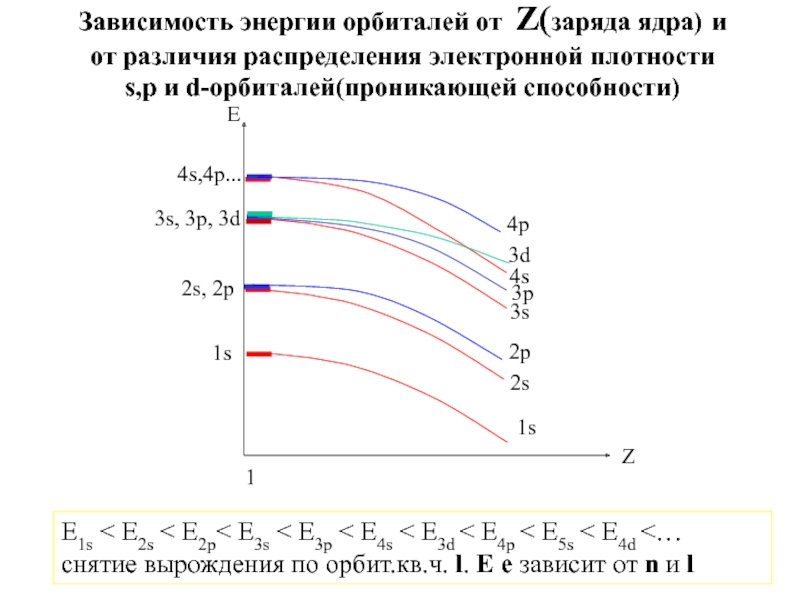
![1-АТОМ.ppt 1.6 Возбужденные состояния атома водорода Общий вид волновой функции-Ψ(r,ϑ,ϕ) = R(r)⋅Y(θ,ϕ)-[метод 1.6 Возбужденные состояния атома водорода Общий вид волновой функции-Ψ(r,ϑ,ϕ) = R(r)⋅Y(θ,ϕ)-[метод разделения переменных]R(r)n, l -](/img/thumbs/3f76853dfdd61b4e39457fd96e71a6ec-800x.jpg)