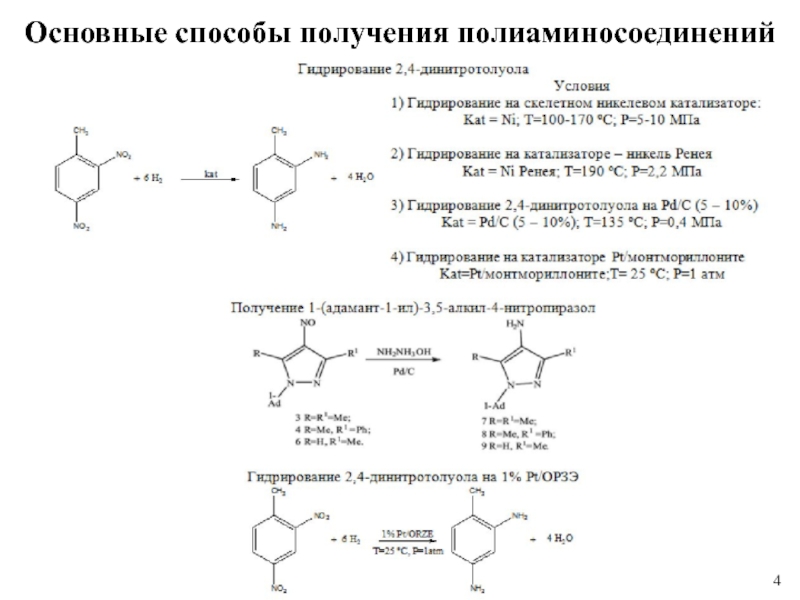
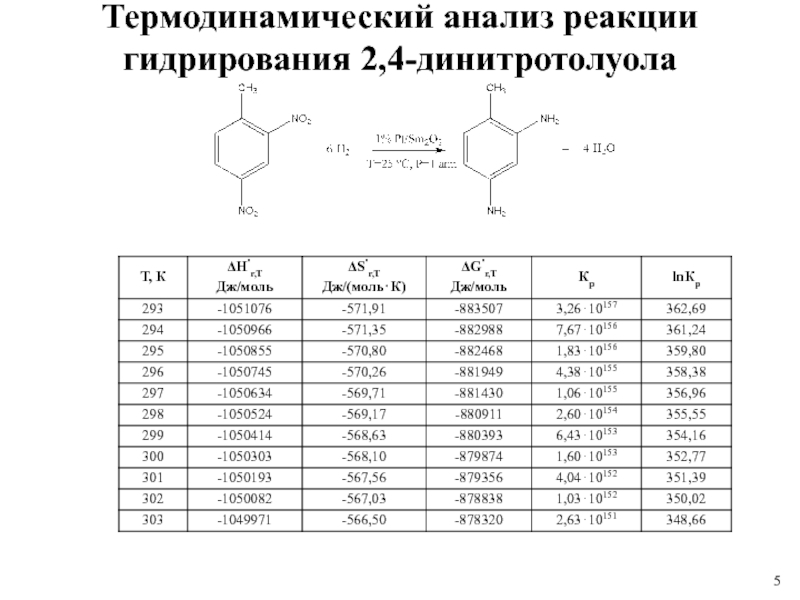
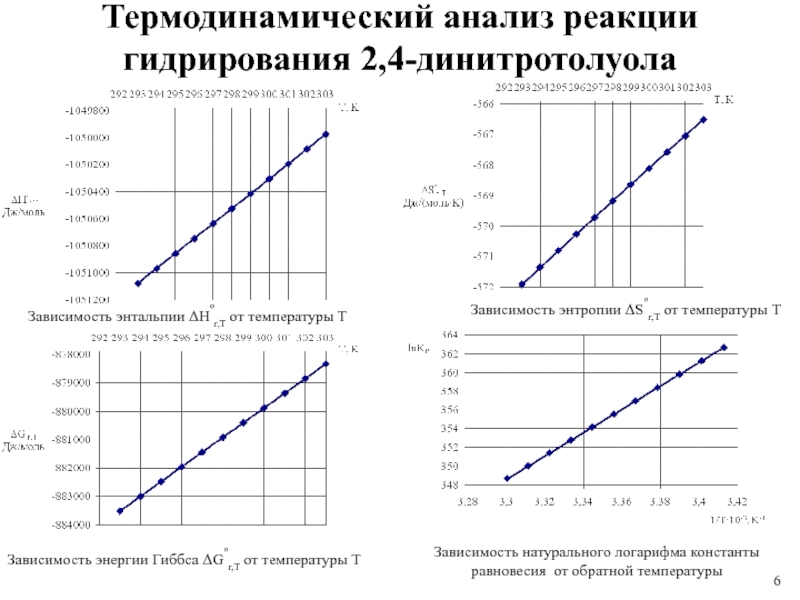
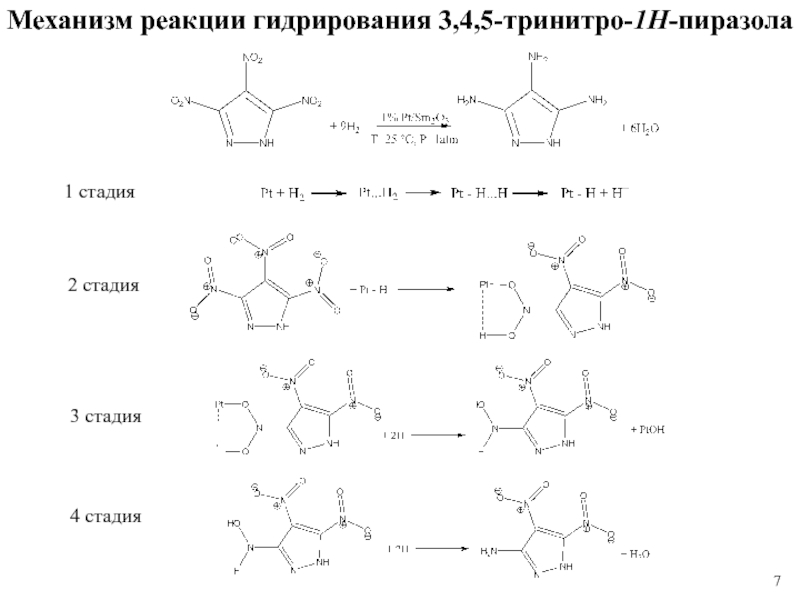
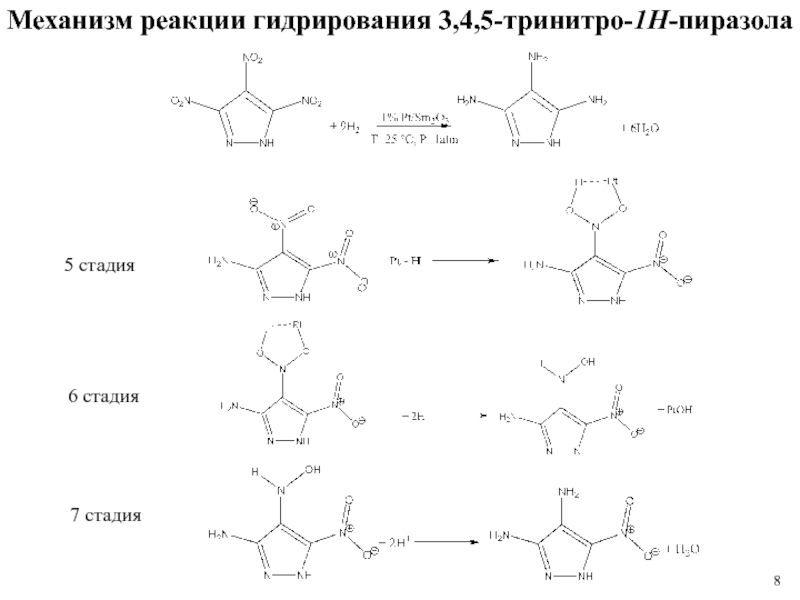
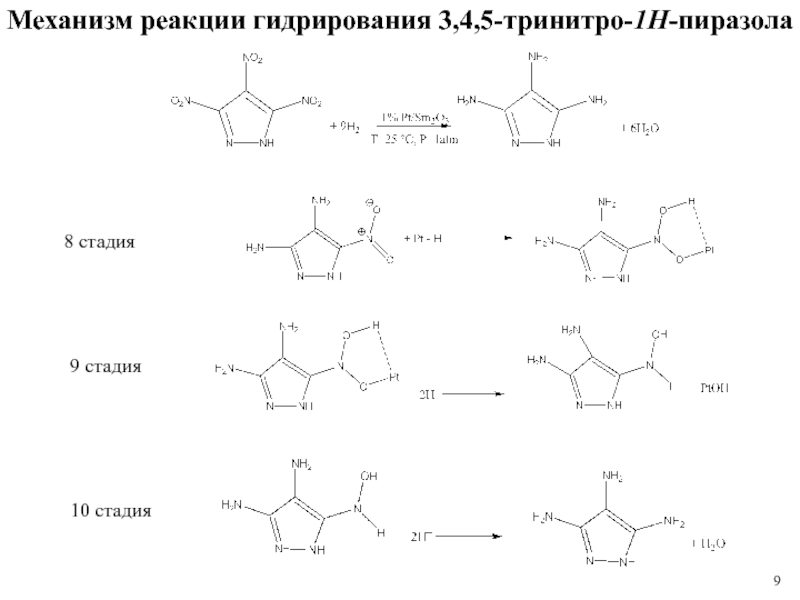
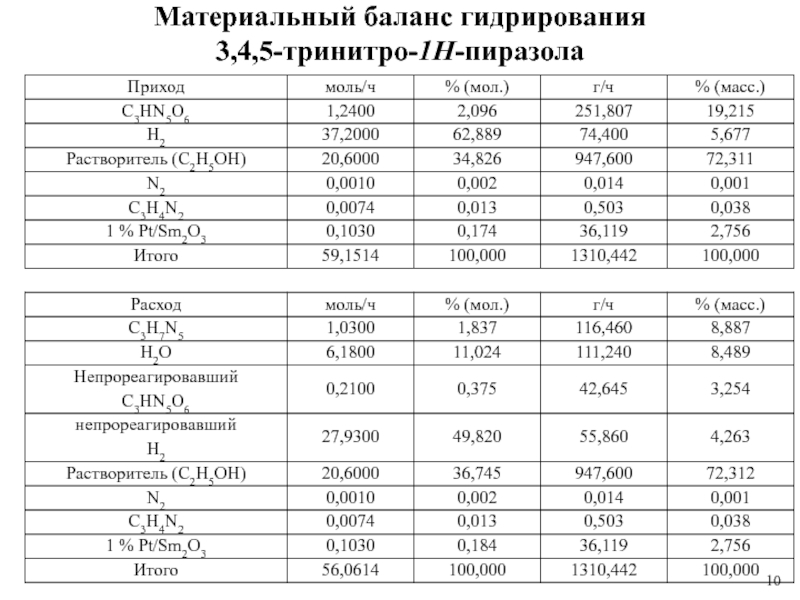
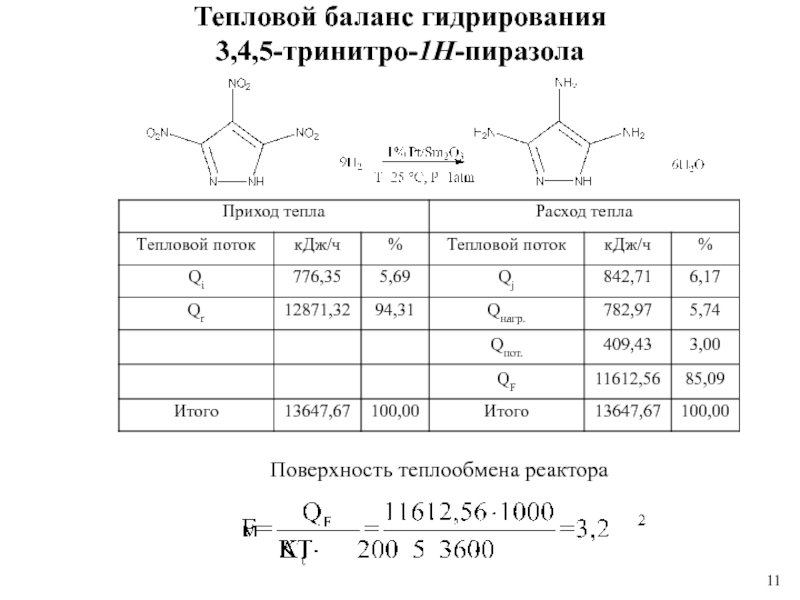
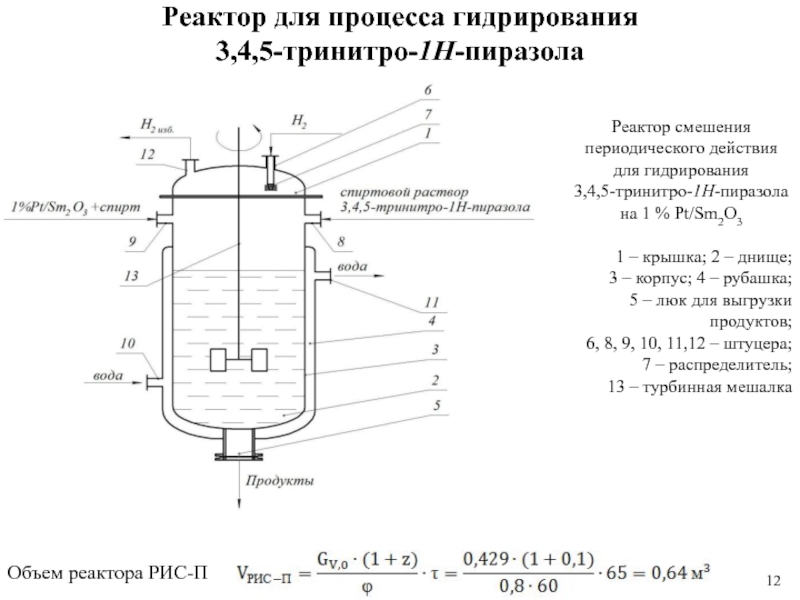
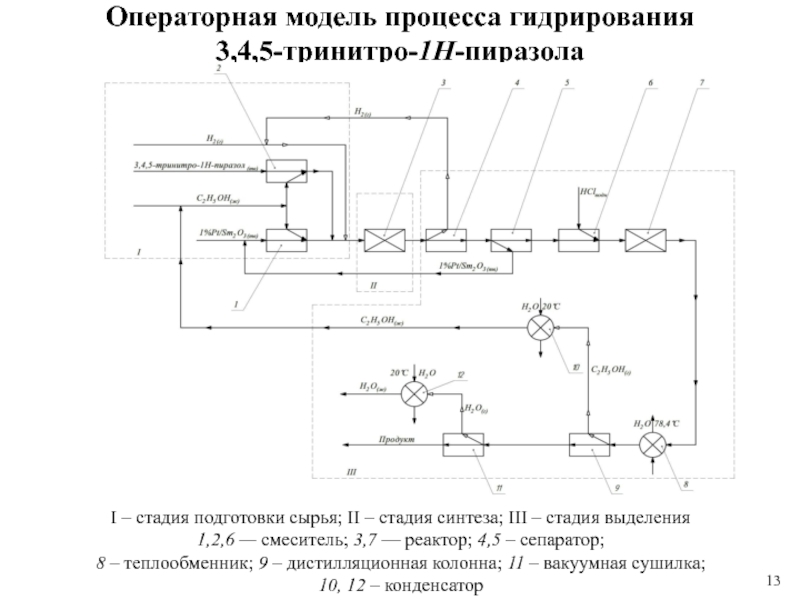
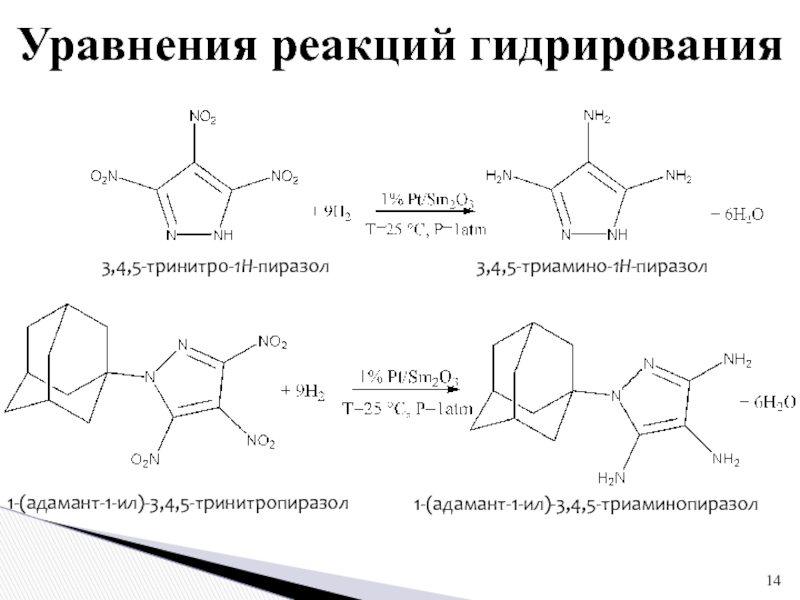
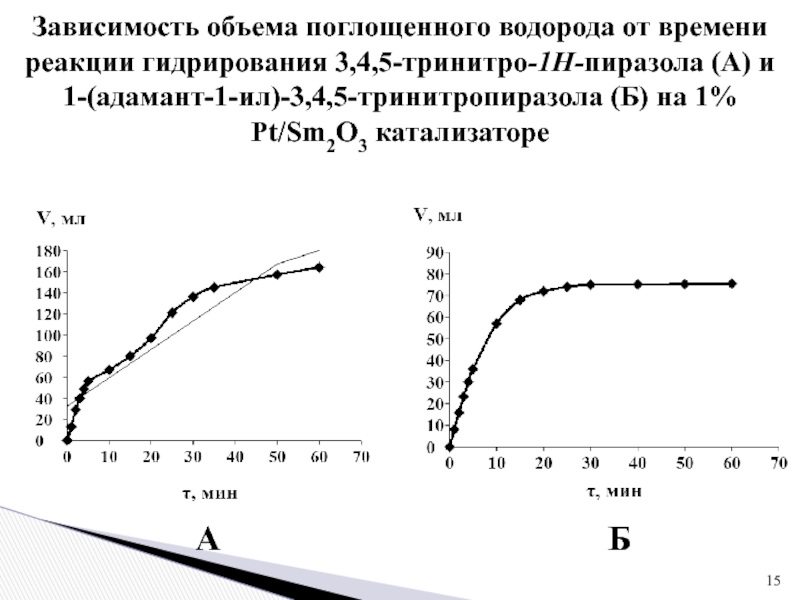
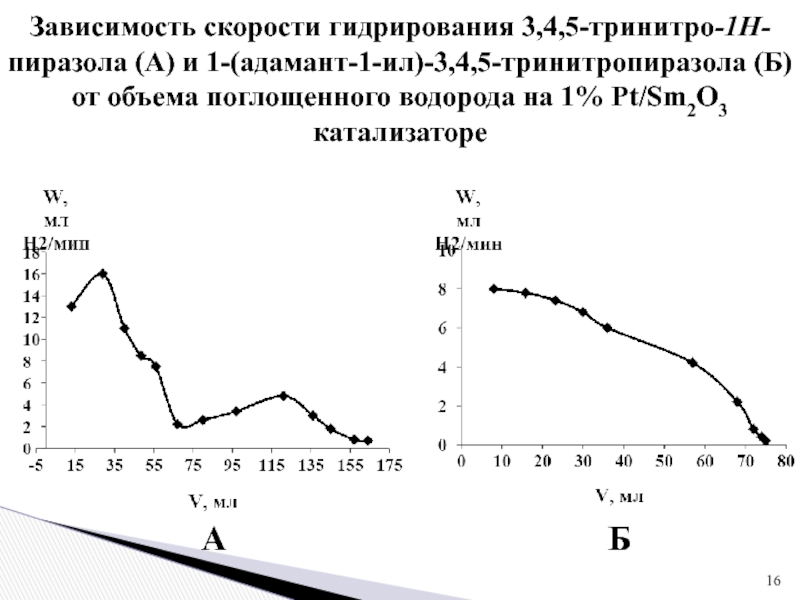
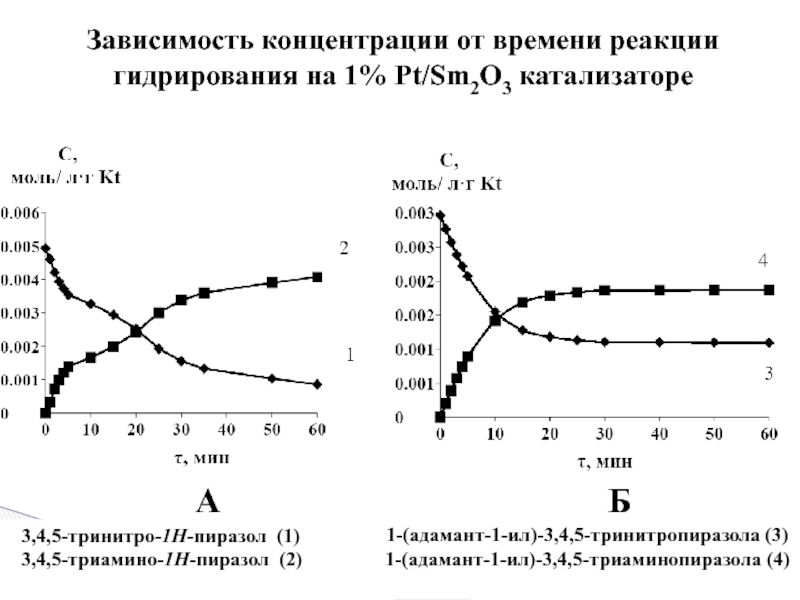
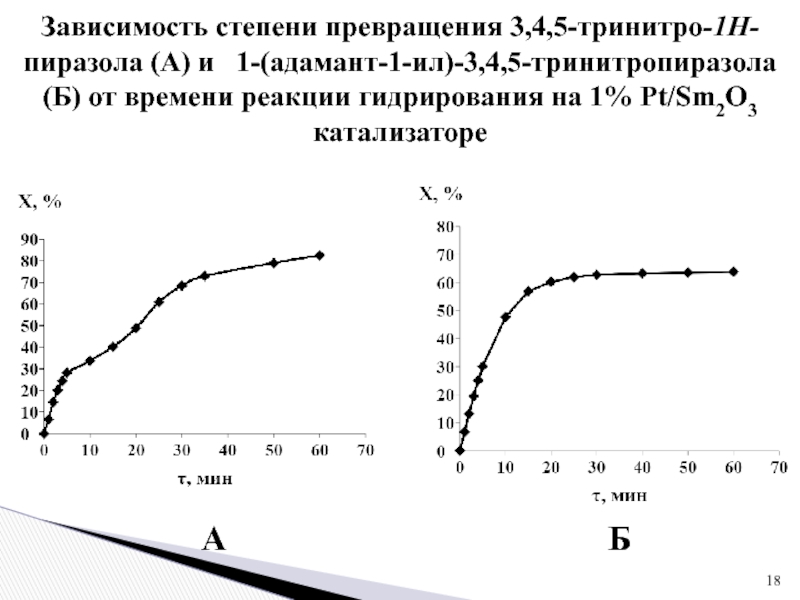
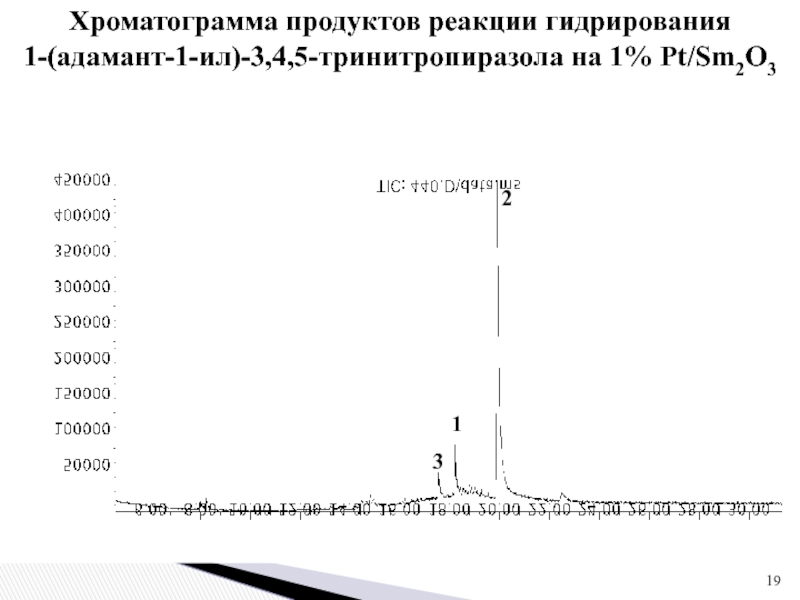
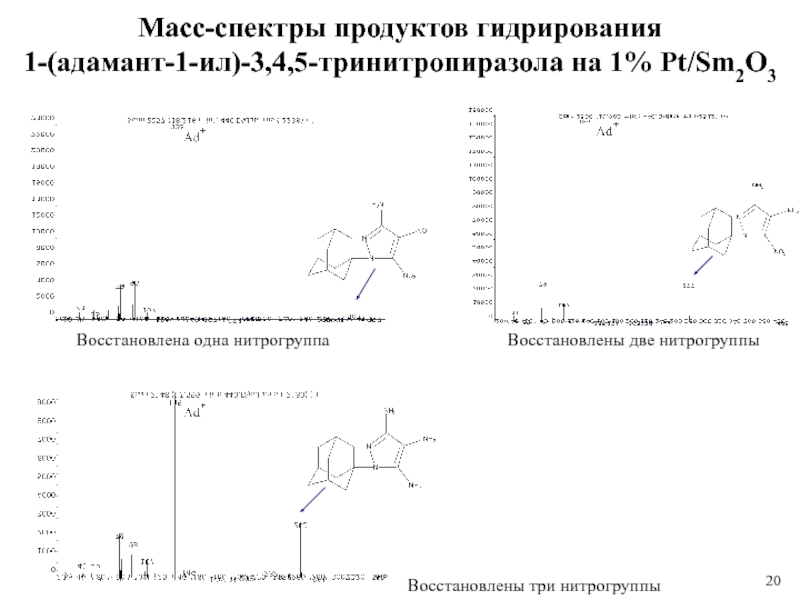
1 % платиновом катализаторе
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ВОЛЖСКИЙ ПОЛИТЕХНИЧЕСКИЙ
ИНСТИТУТ (ФИЛИАЛ)ФЕДЕРАЛЬНОГО ГОСУДАРСТВЕННОГО БЮДЖЕТНОГО ОБРАЗОВАТЕЛЬНОГО
УЧРЕЖДЕНИЯ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
КАФЕДРА "ХИМИЯ И ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ"
Выполнил: студент гр. ВХТ-401
Костенко Н.В.
Научный руководитель: Курунина Г. М.
Волжский, 2013