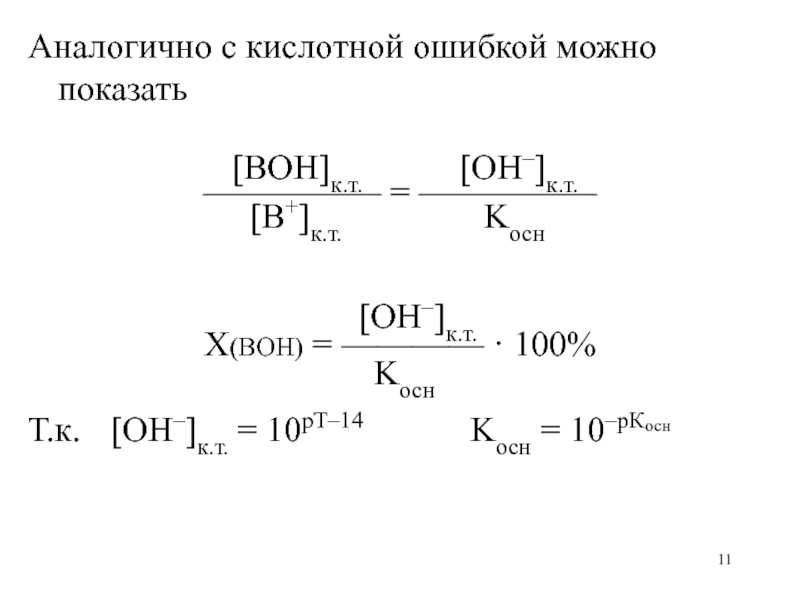
слабое основание
Водородная ошибка – отношение количества ионов водорода n(H+) в
конце титрования к первоначально взятому количеству вещества n(X)n(H+)к.т.
X(H+) = ———— · 100%
n(X)



![1
Индикаторные ошибки
кислотно-основного титрования [H+]к.т.· (V(X) + V(Т))X(H+) [H+]к.т.· (V(X) + V(Т))X(H+)](/img/thumbs/c7a561334825ad0133c59cb97a9bd88f-800x.jpg)

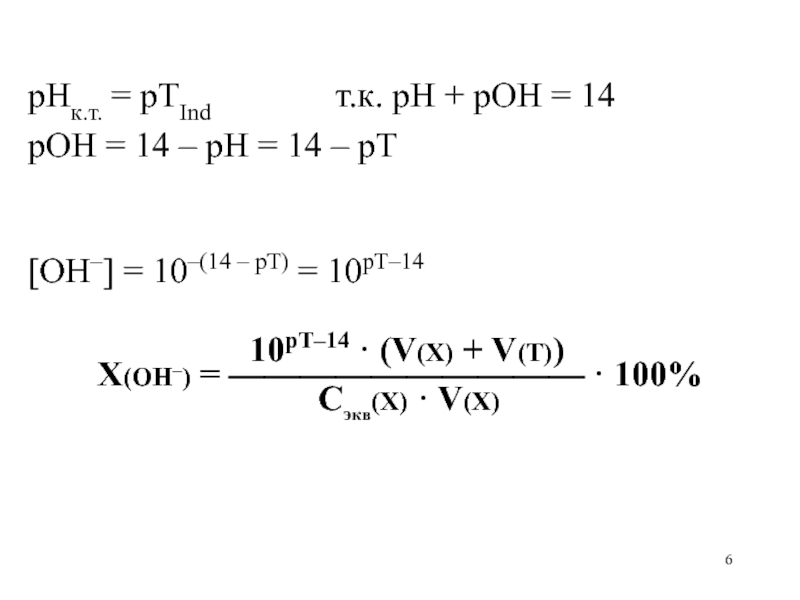

![1
Индикаторные ошибки
кислотно-основного титрования HAк.т. H+к.т. + A–к.т. [H+]к.т. · HAк.т. H+к.т. + A–к.т. [H+]к.т. · [A–]к.т. Kк-ты](/img/thumbs/29a440cd54ab9c0d1df62fbcfe532cfd-800x.jpg)
![1
Индикаторные ошибки
кислотно-основного титрования рНк.т. = рТInd[H+]к.т = 10–рН = 10–рТ рНк.т. = рТInd[H+]к.т = 10–рН = 10–рТ Kк-ты =](/img/thumbs/df10b9003ac90e37aac1ea8c40d7717a-800x.jpg)