Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 Курс Общая химия Лектор: проф. Майстренко Валерий Николаевич Башкирский
Содержание
- 1. 1 Курс Общая химия Лектор: проф. Майстренко Валерий Николаевич Башкирский
- 2. Лекция № 13Электронное строение атомов химических элементов
- 3. Правила заполнения электронных оболочек атомов 1.
- 4. Слайд 4
- 5. Слайд 5
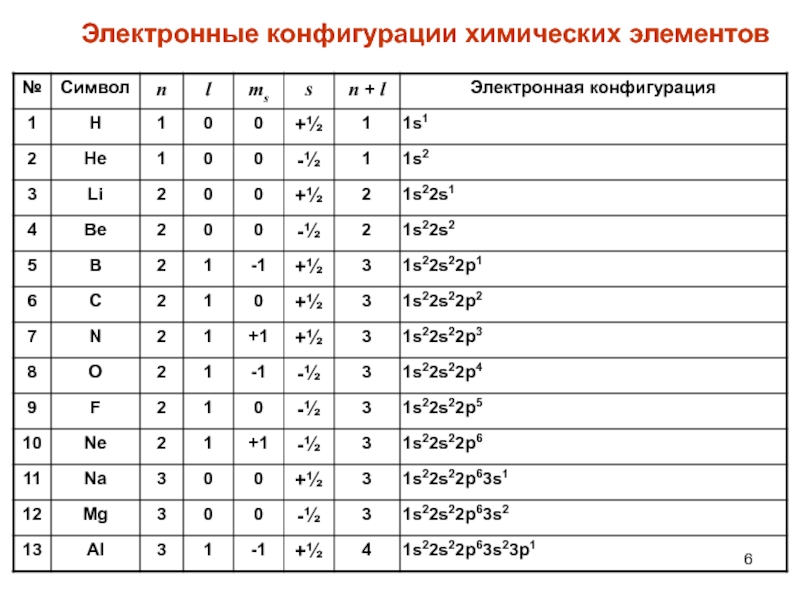
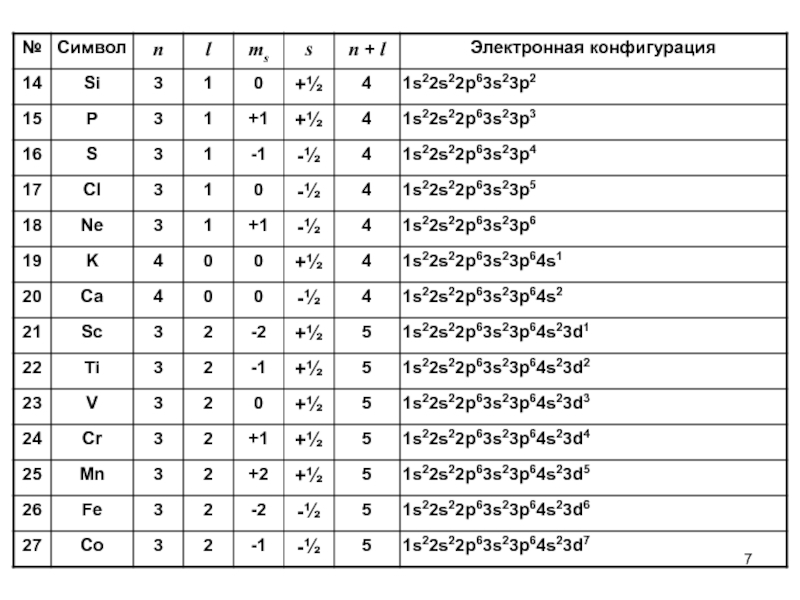
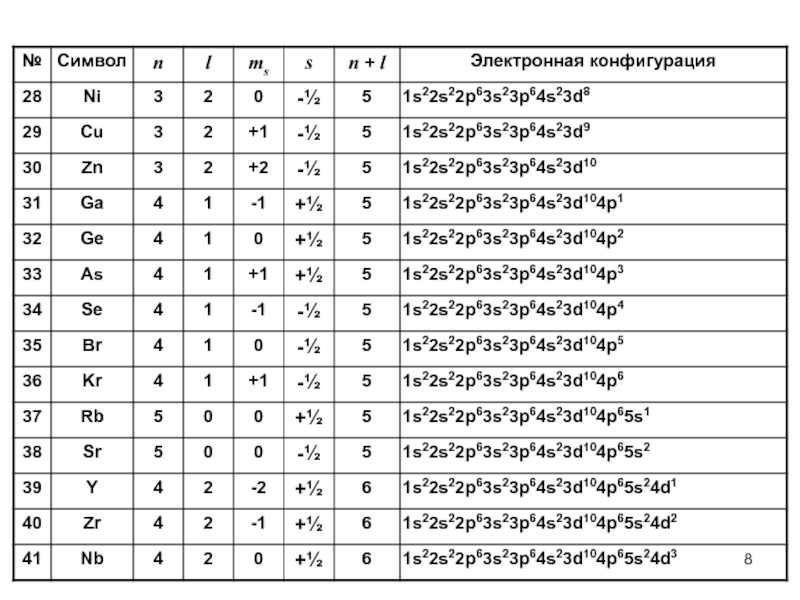
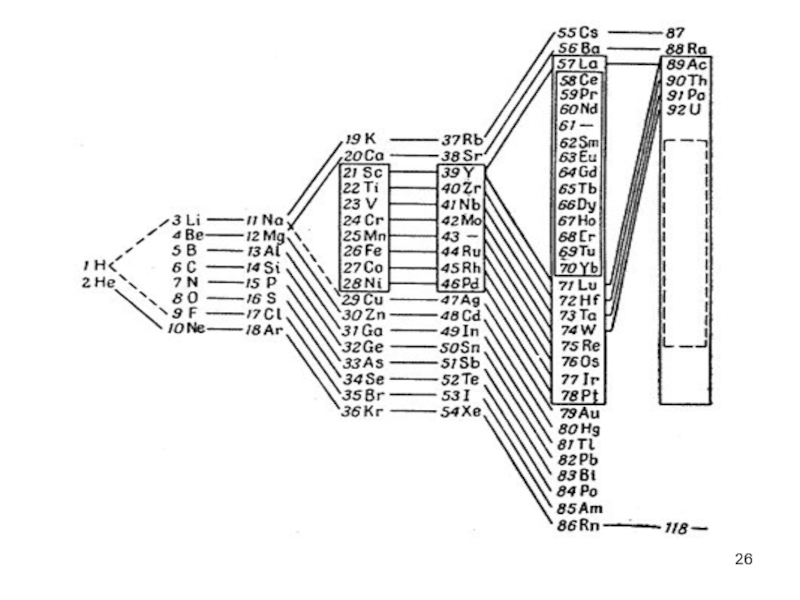
- 6. Электронные конфигурации химических элементов
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
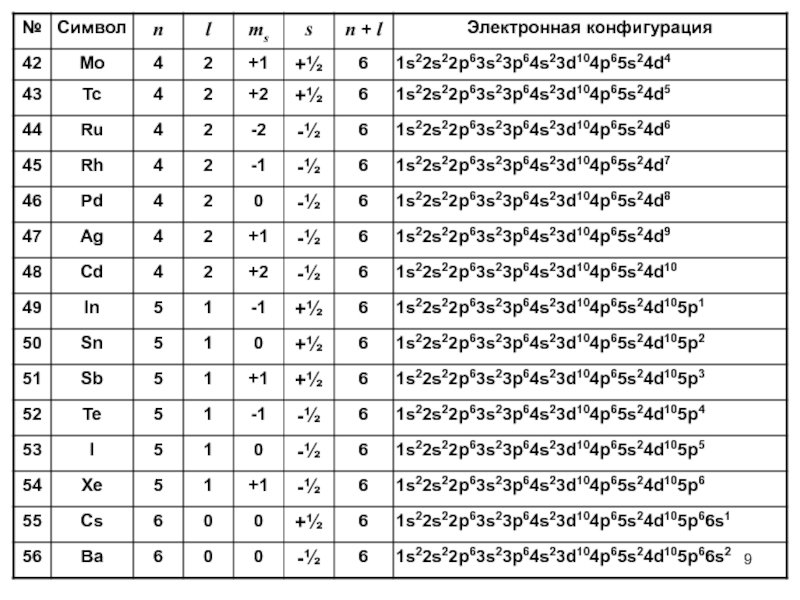
- 12. Периодический закон Д. И. Менделеева
- 13. В 1829 году немецкий
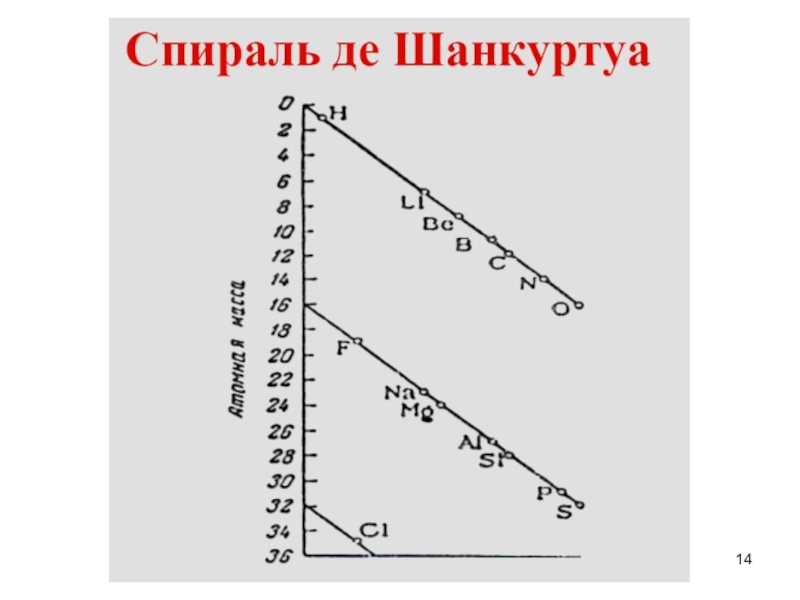
- 14. Слайд 14
- 15. Джон Ньюлендс сделал попытку
- 16. В 1864 году появилась первая
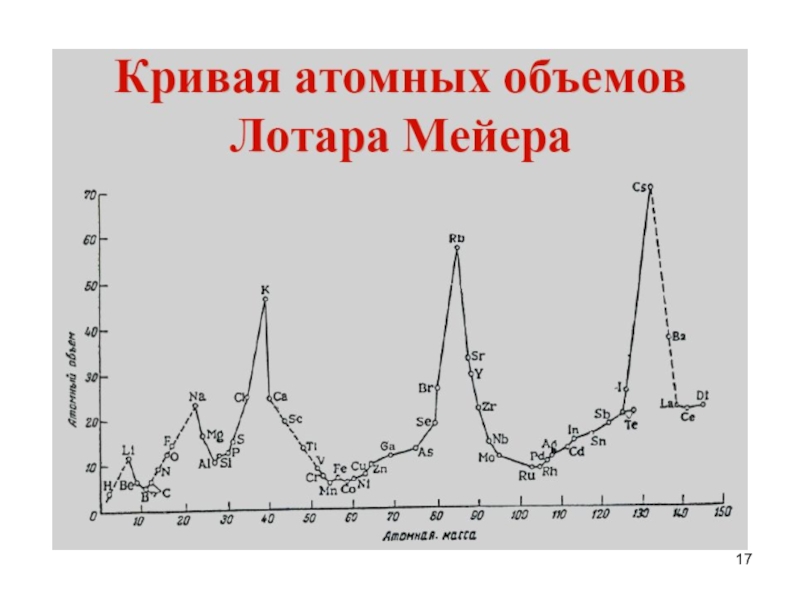
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
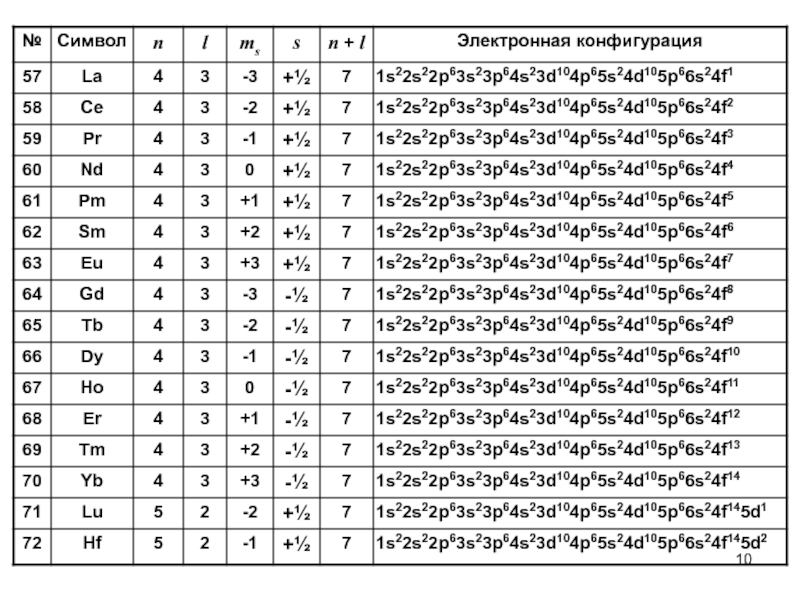
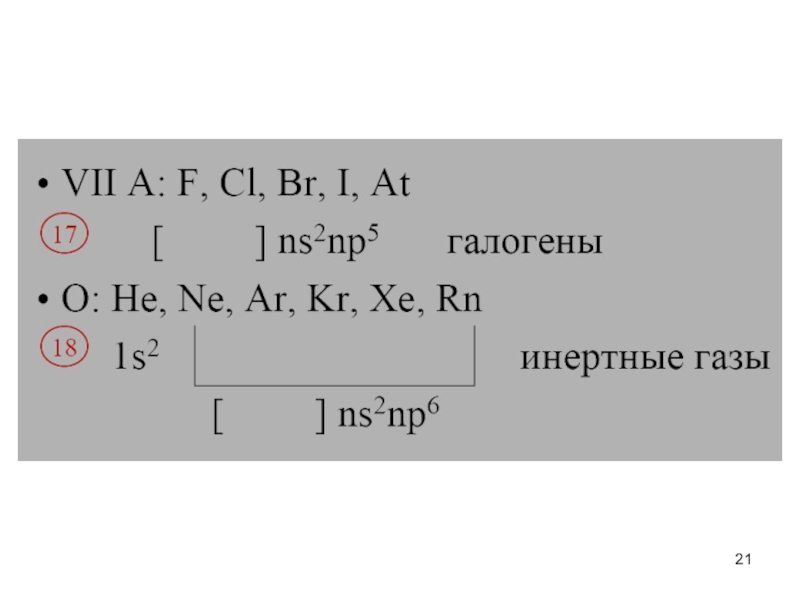
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
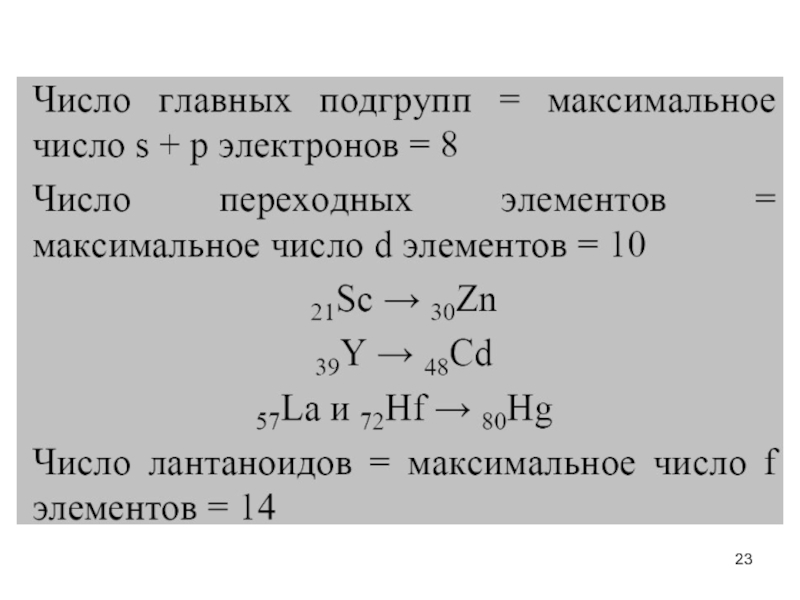
- 23. Слайд 23
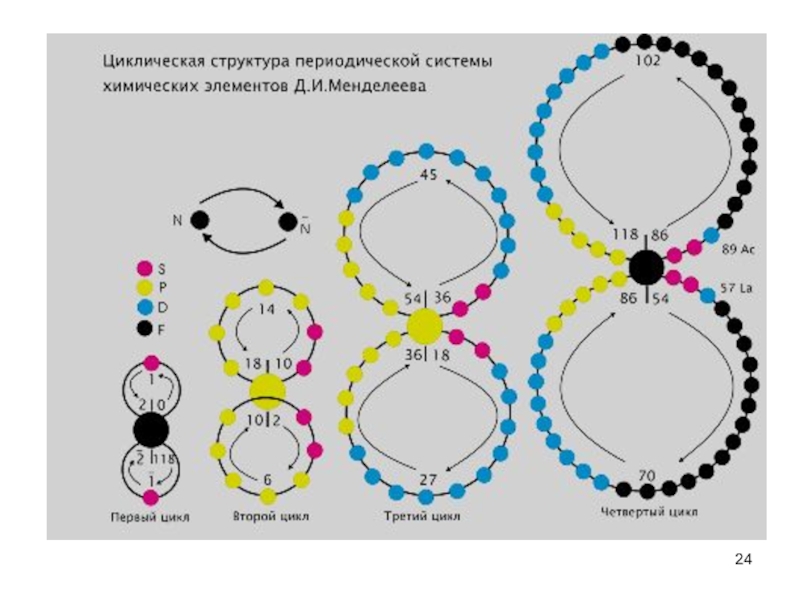
- 24. Слайд 24
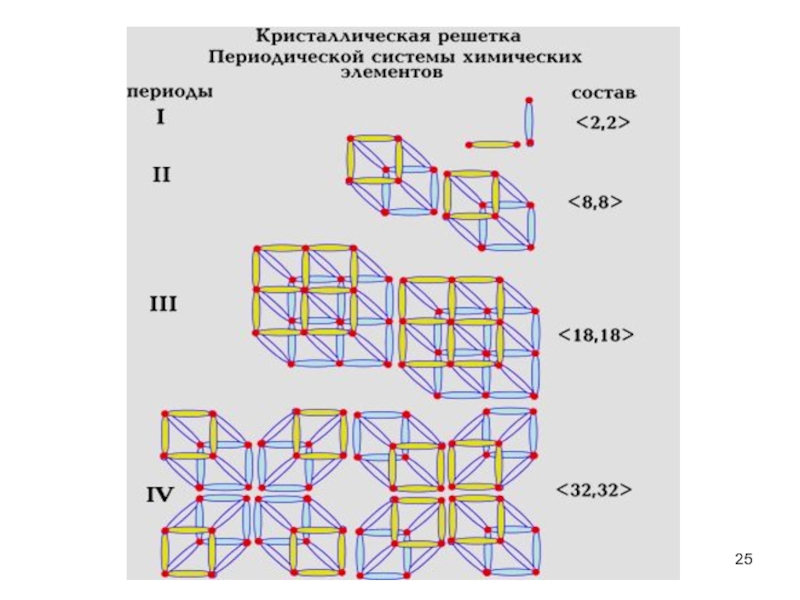
- 25. Слайд 25
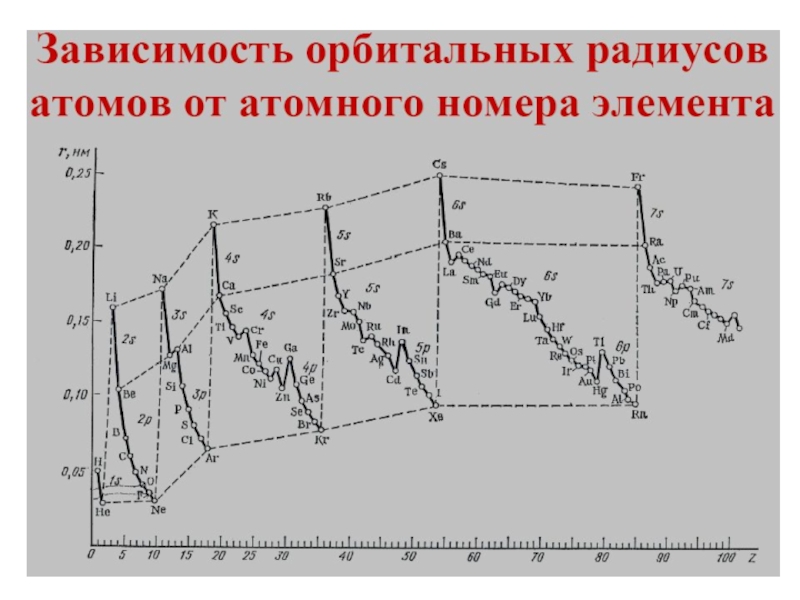
- 26. Слайд 26
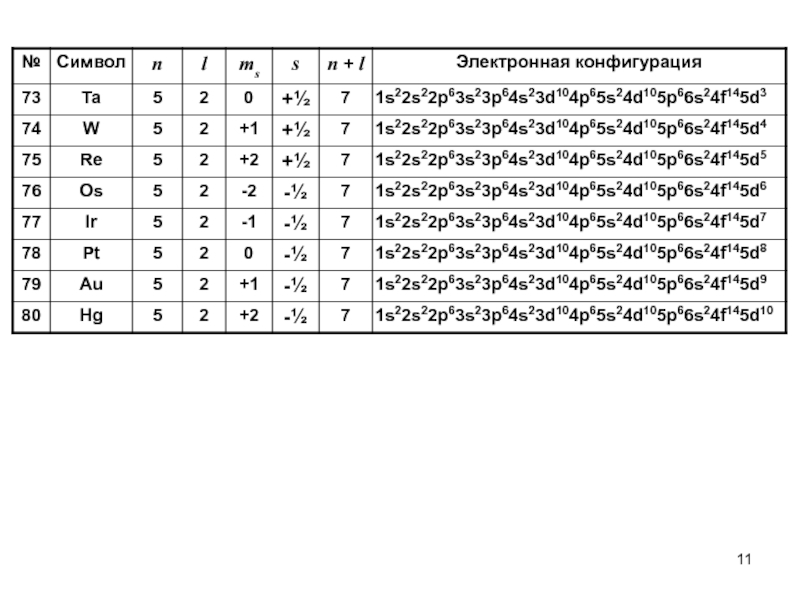
- 27. Слайд 27
- 28. Слайд 28
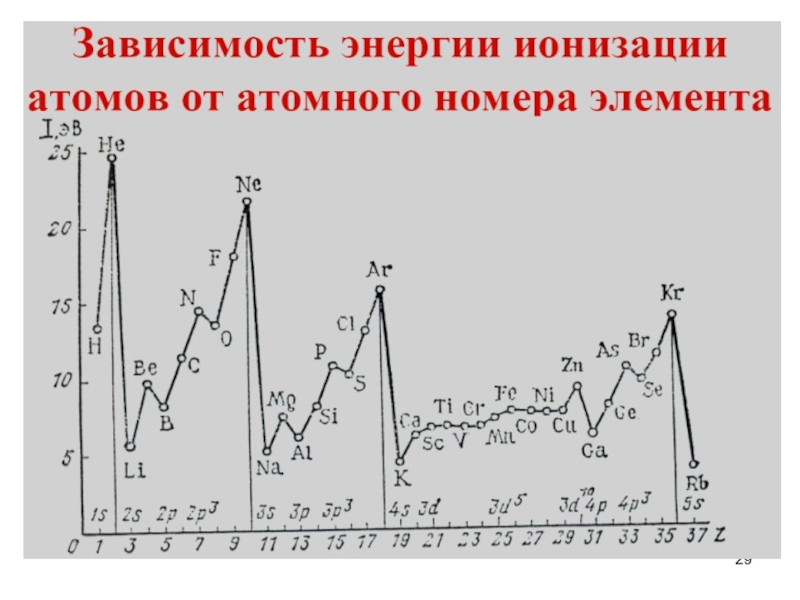
- 29. Слайд 29
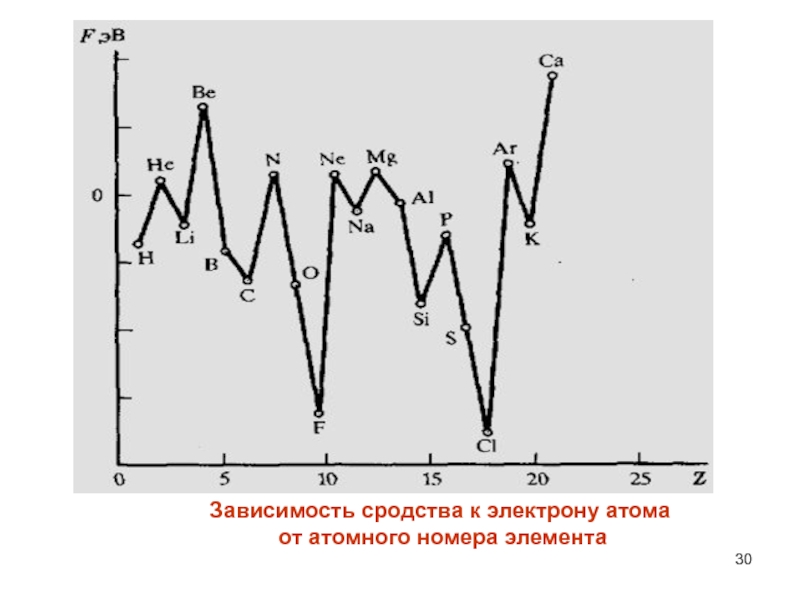
- 30. Зависимость сродства к электрону атома от атомного номера элемента
- 31. Электроотрицательность атомов Электроотрицательность () — фундаментальное
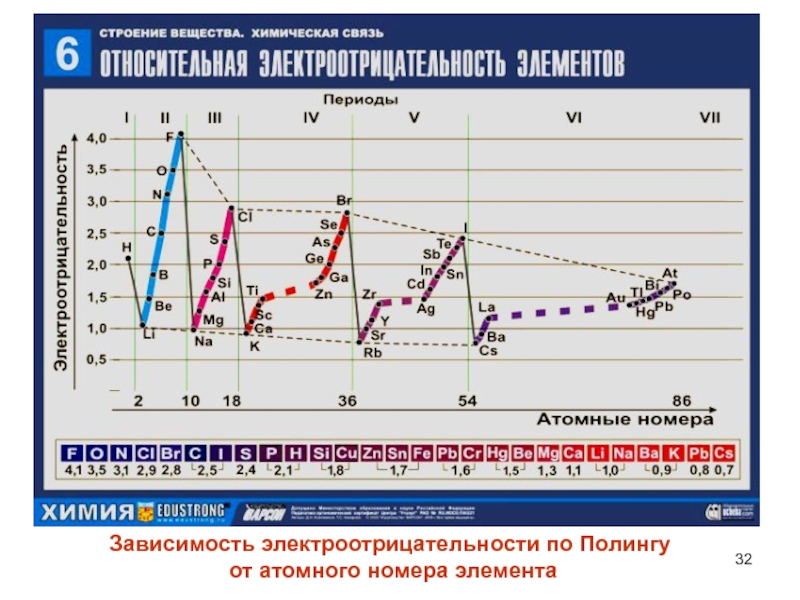
- 32. Зависимость электроотрицательности по Полингу от атомного номера элемента
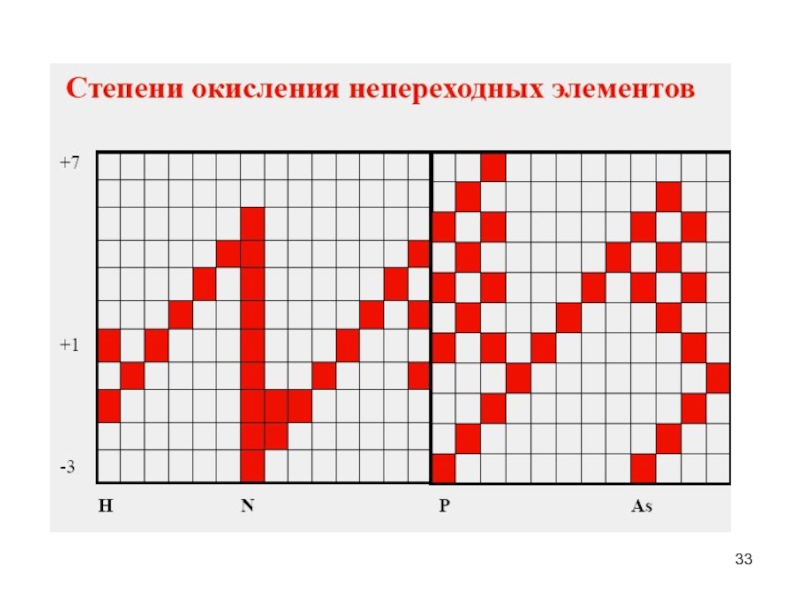
- 33. Слайд 33
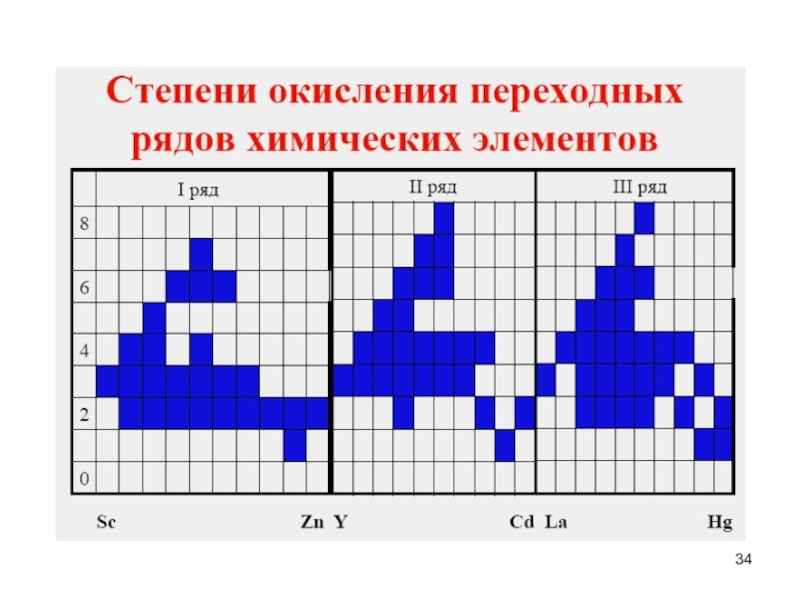
- 34. Слайд 34
- 35. Благодарю за внимание
- 36. Скачать презентанцию
Лекция № 13Электронное строение атомов химических элементов
Слайды и текст этой презентации
Слайд 1Курс «Общая химия»
Лектор: проф. Майстренко Валерий Николаевич
Башкирский государственный университет
Кафедра неорганической
химии
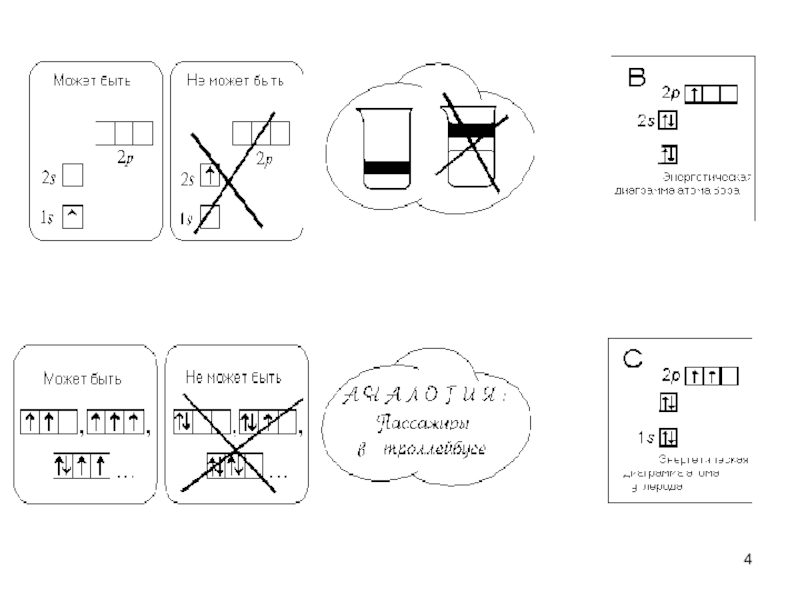
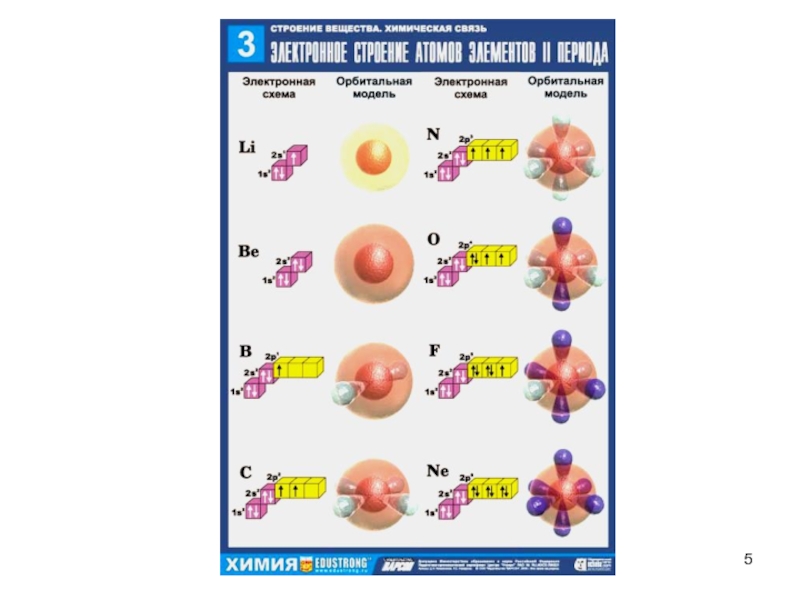
Слайд 3Правила заполнения электронных оболочек атомов
1. Принцип последовательного заполнения
низших атомных орбиталей; орбитали заполняются, начиная с имеющих самую низкую
энергию; орбиталь, содержащая два электрона полностью занята.2. Правило Клечковского - заполнение электронами орбита-лей в атоме происходит в порядке возрастания суммы глав-ного и орбитального квантовых чисел n + l. При одинаковой сумме раньше заполняется орбиталь с меньшим значением n.
3. Правило Хунда – спаривание электронов на орбиталях, имеющих одинаковую энергию, невозможно до тех пор, пока каждая орбиталь не будет иметь один электрон, т. е. суммар-ный спин электронов в атоме должен быть максимальным.
4. Принцип Паули – два электрона в атоме не могут иметь одинаковый набор квантовых чисел, т. е. каждая орбиталь может содержать максимум два электрона с различными спинами.
5. Максимальное число электронов для данного квантового числа n равно N = 2n2
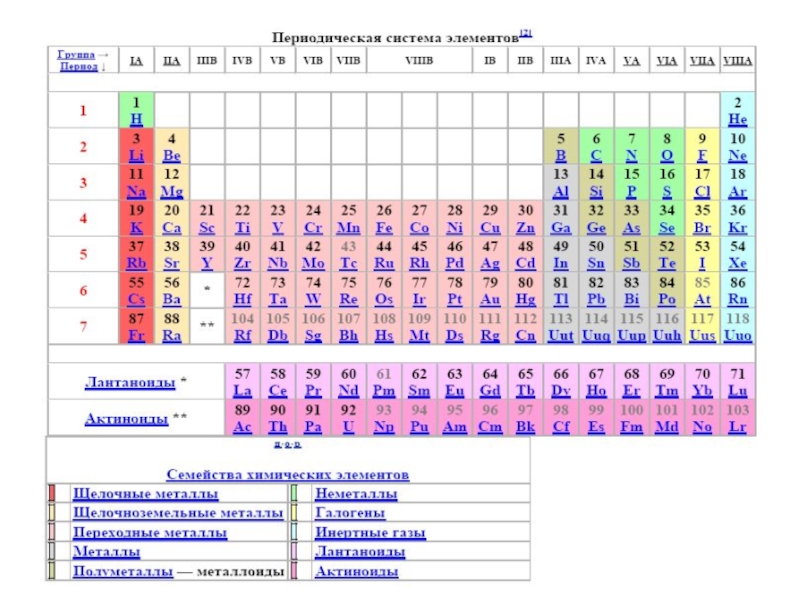
Слайд 12Периодический закон Д. И. Менделеева
Периодический закон Д.
И. Менделеева — фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов
в зависимости от зарядов ядер их атомов. Открыт в марте 1869 года при сопоставлении свойств известных в то время элементов и величин атомных масс. Термин «периодический закон» Д. И. Менделеев впервые употребил в ноябре 1870 года, а в октябре 1871 года дал формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуе-мых ими простых и сложных тел, находятся в периодической зависимости от их атомного веса». Графическим (табличным) выражением периодического закона является разработанная Менделеевым периодическая система элементов.Современная формулировка Периодического закона: «свой-ства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от зарядов ядер атомов элементов».
Слайд 13 В 1829 году немецкий химик Иоганн Вольфганг
Деберейнер предпринял первую попытку систематизации химических элементов. Он заметил, что
некоторые сходные по своим свойствам элементы можно объединить по три в группы, которые он назвал триадами Атомная масса среднего элемента триады близка к полусумме (среднему арифметическому) атомных масс двух крайних эле-ментов триады.
Слайд 15 Джон Ньюлендс сделал попытку сопоставить химические свойства
элементов с их атомными массами. Расположив элементы в порядке возрастания
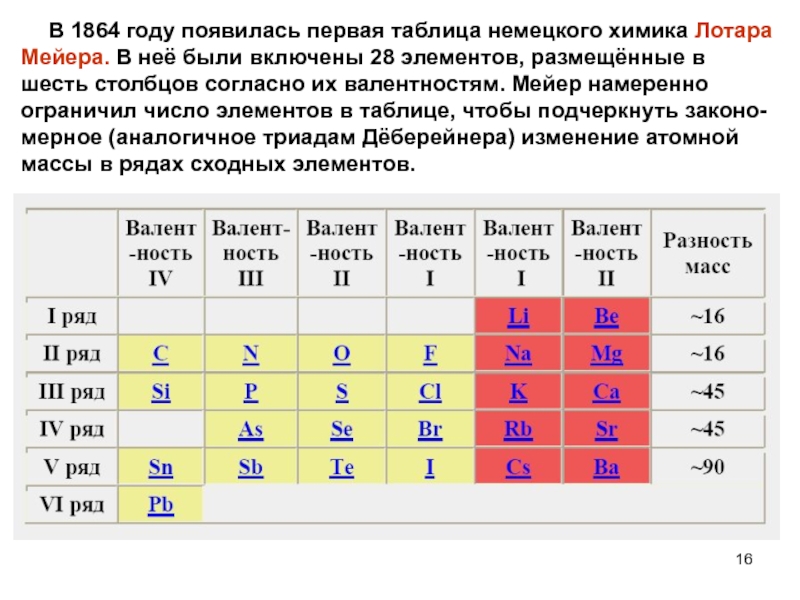
атомных масс, Ньюлендс заметил, что сходство в свойствах проявляется между каждым восьмым элементом. Найденную законо-мерность Ньюлендс назвал законом октав по аналогии с семью интерва-лами музыкальной гаммы.Слайд 16 В 1864 году появилась первая таблица немецкого химика
Лотара Мейера. В неё были включены 28 элементов, размещённые в
шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть законо-мерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах сходных элементов.Слайд 31Электроотрицательность атомов
Электроотрицательность () — фундаментальное химическое свойство атома,
количественная характеристика способности атома в молекуле притягивать к себе общие
электронные пары.Теоретическое определение электроотрицательности было предло-жено американским физиком Р. Малликеном. Исходя из положения о том, что способность атома в молекуле притягивать к себе электроны зависит от энергии ионизации атома и его сродства к электрону, он предложил соотношение для электроотрицательности атома
где IA и EA энергия ионизации атома и его сродство к электрону.
Лайнус Полинг ввел собственную шкалу электроотрицательностей, в которой максимальную имеет фтор (F = 4,1), а минимальную — цезий (Cs = 0,7 ).
Широко используют также шкалу Оллреда и Рокоу, в которой элек-троотрицательность рассчитывают по формуле
где Z - эффективный заряд ядра по Слэйтеру, r -атомный ковалентный радиус.