Слайд 1Лекция
«Иодометрия.
Перманганатометрия. Трилонометрия"
Кафедра общей и медицинской химии
Слайд 3Восстановитель – молекула, атом или ион, отдающий электроны, при этом
степень окисления его растет.
Окислитель – молекула, атом
или ион, принимающий
электроны,
при этом степень окисления
его уменьшается.
Окислительно-восстановительное титрование
Слайд 4 В 1888-1889 гг. Нернст изучал поведение электролитов
при пропускании электрического тока и открыл фундаментальный закон, известный как
уравнение Нернста.
Закон устанавливает зависимость между электродвижущей силой (разностью потенциалов) и концентрацией ионов и позволяет предсказать максимальный потенциал, который может быть получен в результате электрохимического взаимодействия.
Нобелевская премия по химии (1920)
«в признание его работ по термодинамике».
Уравнение Нернста.
Слайд 5Электродные потенциалы в водных растворах при 25оС и при парциальном
давлении газов, равном нормальному атмосферному давлению.
Окислительно-восстановительные потенциалы
Слайд 6 Пользуясь значениями ео, можно прогнозировать возможность протекания
и направление окислительно-восстановительной реакции.
F2 + 2e → 2F- е0 = 2.87 В
I2 +2e → 2I- е0 = 0.54 В
F2 + 2I- = I2 + 2F-
F2 + 2KI = I2 + 2KF
Из пары с большим е0 берем окислитель.
Из пары с меньшим е0– берем восстановитель.
Оставшиеся вещества есть продукты реакции.
Направление окислительно – восстановительных реакций
2I- φ0 =
0.54 В
S4O62- +2e → 2S2O32- φ0 = 0.17 В
I2 + S4O62- → 2S2O32- + 2I-
I2 +2Na2S2O3 → Na2 S4O6 + 2NaI
Иодометрия
Значение стандартного окислительного потенциала системы I2/2I- находится между сильными восстановителями и сильными окислителями, что позволяет использовать метод иодометрии для определения как восстановителей, так и окислителей. Меняется только способ титрования.
I2 +2Na2S2O3 → Na2 S4O6 + 2NaI
В качестве рабочих растворов используют растворы I2
и тиосульфата натрия - Na2S2O3 . Вспомогательный - раствор KI.
Слайд 8Электродные потенциалы в водных растворах при 25оС и при парциальном
давлении газов, равном нормальному атмосферному давлению.
Окислительно-восстановительные потенциалы
Слайд 9 Растворы тиосульфата обычно готовят из кристаллического Na2S2О3∙5Н2О, который
при хранении постепенно теряет часть кристаллизационной воды.
Важнейшими
факторами, определяющими устойчивость раствора тиосульфата, являются:
значение рН
присутствие микроорганизмов и примесей
концентрация раствора
присутствие атмосферного кислорода
воздействие прямого солнечного света.
Слайд 10 Приготовление и стандартизация раствора
иода.
Кристаллический иод мало растворим в воде (0,00133 моль/л), но его
растворимость существенно повышается в водном растворе иодида калия вследствие образования трииодит-иона (I3-):
I2 + I- = I3-
Трииодид-ион и молекулярный иод в окислительно-восстановительных реакциях выступают как реагенты практически равной окислительной способности . Растворы I2 в KI обычно называют для простоты растворами иода.
Слайд 11 В качестве индикатора в иодометрии используется раствор
крахмала в воде, который с I2 дает интенсивно синюю окраску.
В зависимости от титранта окраска в точке эквивалентности может появляться или исчезать.
При титровании раствора тиосульфата натрия раствором I2 в точке эквивалентности появляется интенсивно синяя окраска.
I2 +2Na2S2O3 → Na2 S4O6 + 2NaI
Слайд 12 При титровании раствора йода раствором тиосульфата
синяя окраска
исчезает.
Для исключения потерь I2 за счет адсорбции
крахмал добавляют перед концом титрования, когда раствор приобретает соломенно-желтую окраску. Раствор окрашивается в темно-синий цвет.
Продолжают титрование, добавляя по одной капле тиосульфата.
В точке эквивалентности раствор обесцвечивается.
I2 +2Na2S2O3 → Na2 S4O6 + 2NaI
Слайд 13Приборы для определения
йода в иодидах металлов.
Слайд 14Прямое титрование
используется для определения активных восстановителей.
I2 + 2Na2S2O3 =
2NaI + Na2S4O6
К определенному объему тиосульфата натрия
добавляем раствор йода (в присутствии крахмала), в точке эквивалентности появится синяя окраска.
Слайд 15
Растворами иода можно непосредственно титровать соединения As(III), Sb(III), Sn(II), сульфиты,
сульфиды, тиосульфаты, сероводород и некоторые другие восстановители.
Иодометрическое титрование арсенита протекает
по уравнению:
AsO2- + I2 + 2Н2О → НAsO42- + 2I- + 3H+.
Ацетон в щелочном растворе под действием I2 образует иодоформ
СН3СОСН3 + 3I2 + 4ОН- → СНI3 + СН3СОО- + 3I- + 3Н2О.
Тиомочевину можно титровать в кислом растворе, однако более хорошие результаты дает окисление в щелочной среде
СS(NН2)2 + 4I2 + 10ОН- → СО(NН2)2 + SО42- + 8I- + 5Н2О.
Определение заканчивается обратным титрованием иода в кислом растворе
Слайд 16 Метод заместителя
Иодометрическое определение окислителей основано на окислении иодид-иона
и тировании выделившегося иода тиосульфата натрия.
(например,
определение активного хлора в белильной извести).
CaOCl2 + 2HCl = CaCl2 + Н2О + Cl2
Cl2 + KI = 2KCl + I2
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
К определенному объему окислителя, добавляем произвольный избыток KI. Выделяется I2 в количестве эквивалентном окислителю. Выделившийся I2 титруем раствором Na2S2O3 до исчезновения синей окраски.
Слайд 17
Одной из наиболее важных реакций этого типа является реакция иодида
с дихроматом
Сr2О72- + 6I- + 14Н+ → 2Сr3+ + 3I2
+ 7Н2О.
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Эти реакции используется для определения хрома в сталях и других материалах с предварительным окислением Сr3+ до Сr(VI).
Одним из практически важных применений реакции является использование ее для иодометрического определения катионов, образующих малорастворимые хроматы (барий, свинец и др.). В этом методе анализируемый катион осаждают в виде хромата, который затем растворяют в кислоте:
2ВаСrО4 + 2Н+ → 2Ва2+ + Сr2О72- + Н2О
Дихромат в растворе определяют иодометрически по приведенной выше реакции.I
Слайд 18Определение железа
Ионы Fе3+ окисляют I- в кислом растворе:
2Fе3+ + 2I-
= 2Fe2+ + I2
Выделившийся I2 оттитровывают
тиосульфатом натрия:
I2 +2Na2S2O3 →
Na2S4O6 + 2NaI
Слайд 19Определение витамина С в чёрной смородине
Отмеряем 20 мл отжатого
сока чёрной смородины и разбавляем его водой до объёма 100
мл;
Добавляем 1 мл крахмального клейстера;
Добавляем по каплям 5 % р-ра йода до появления устойчивого синего окрашивания, не исчезающего в течении 10-15 сек.
Слайд 20 Обратное титрование
( используется для определения
малоактивных и летучих восстановителей).
I2 + Na2S = 2NaI + S0↓
К определенному объему Na2S добавляем фиксированный избыток йода. Часть йода вступает в реакцию, оставшийся йод определяем титрованием Na2S2O3.
Слайд 21Перманганатометрия
Метод химического титриметрического анализа, основанный на применении растворов перманганата калия
(KMnO4) для количественных объемных определений.
Преимущество перманганатометрии заключается в том,
что для нее отпадает необходимость в применении специального индикатора при установлении точки эквивалентности, так как раствор KMnO4 имеет характерный фиолетово-красный цвет.
Слайд 22
В большинстве случаев титрование восстановителей (например, Fe(II) и Mn(II), Mo(III)
и Ti(III), -C2O42-, AsO2-, NO2- , H2O2 ) стандартным раствором
KMnO4 проводится в кислой среде;
Окислительно-восстановительная реакция протекает тогда по схеме:
MnO4- + 8H+ + 5е ↔ Mn2+ + 4H2O
Исходные вещества:
H2C2O4, Na2C2O4
2KMnO4 + 5Na2С2O4 + 8H2SO4→2MnSO4 + K2SO4 + 5Na2SO4 +10CO2↑ + 8H2O
Слайд 23Некоторые вещества (например, сульфиты, сульфиды, тиосульфаты, гидразин) окисляются легче в
нейтральной или щелочной среде; в этом случае реакция идет по
схеме:
MnO4- + 4H+ + 3e = MnO2↓ + 2H2O
Слайд 24
Рабочим раствором в этом методе является
раствор KMnO4.
Например, нужно приготовить 1 л 0,1н. раствора KMnO4.
В 1
л такого раствора должно содержаться 0,1 моль -эквивалентов KMnO4, что соответствует 3,1610 г KMnO4.
Учитывая, что в сухом KMnO4 всегда есть примеси, на технических весах берут навеску чуть больше рассчитанной, например 3,3 г.
Кристаллы KMnO4 растворяются в воде довольно медленно, поэтому часть воды нагревают, горячей водой обрабатывают навеску перманганата калия при тщательном перемешивании в стакане или колбе.
Поскольку перманганат калия окисляет
резиновые и корковые пробки, бумагу,
нельзя допускать соприкосновения
раствора с ними.
Слайд 25
Хранить раствор KMnO4 следует в склянке
из темного стекла
либо в темном месте.
Охлажденный приготовленный раствор сливают в темную
посуду емкостью 1 л и туда же добавляют оставшуюся воду из мерного цилиндра, все тщательно перемешивают, закрывают плотно стеклянной пробкой и оставляют
в темном месте на 7-10 дней.
Слайд 26
Затем раствор фильтруют и устанавливают точную концентрацию, используя исходные
вещества:
H2C2O4, Na2C2O4
Слайд 27Для определения концентраций:
а) перекиси водорода Н2О2 (пергидроль) –
методом прямого
титрования
2KMnO4 + 5H2O2 + 3H2SO4 →2MnSO4 + 5O2↑ + K2SO4
+ 8H2O
Применение
Слайд 28б) Ионов Fe(II), Cr(III), TI(I), W(V), V(IV), Sb(III),
гидразина, других органических
восстановителей
методом прямого титрования
в) Окислителей - дихроматов, персульфатов, ванадатов, MnO2,
PbO2, Pb3O4 и др. Их предварительно восстанавливают с помощью Fe(II), избыток которого оттитровывают раствором KMnO4
методом обратного титрования
Слайд 29г) Восстановителей, медленно реагирующих с KMnO4 (иодиды, цианиды, тиоцианаты), а
также летучих, например НСООН, Н2S
методом обратного титрования
Суть метода обратного
титрования:
К определенному объему восстановителя добавляют фиксированный избыток КMnO4. Часть перманганата вступает в реакцию.
НСООК + 2КMnO4 + 3КOH → К2CO3 + 2К2MnO4 + 2Н2O
оставшийся КMnO4 оттитровывают раствором щавелевой кислоты.
2КMnO4 + 5Н2C2O4 + 3H2SO4 → 2MnSO4 + К2SO4+ 10CO2↑ + 8H2O
Слайд 30В медицине:
а) для контроля качества
пероксидов водорода, лактата и глюконата кальция, нитрита натрия,
левомицетина, фумарата железа.
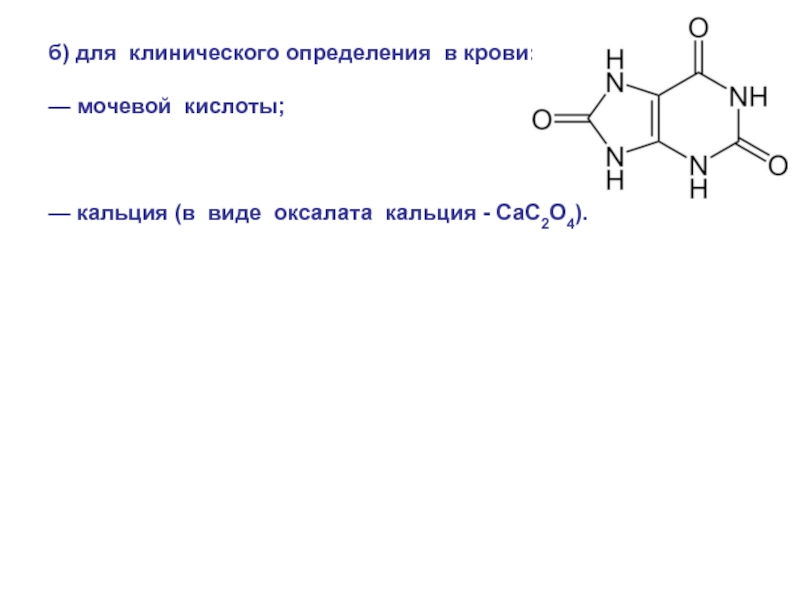
Слайд 31б) для клинического определения в крови:
— мочевой кислоты;
— кальция
(в виде оксалата кальция - CaC2O4).
Слайд 32Комплексоны (хелаты) - полидентатные лиганды – органические соединения, образующие комплексные
соединения с ионами металлов.
Трилонометрия
Происхождение термина хелат от греческого «клешня краба».
Комплексонометрия
Слайд 33Комплексонометрическое титрование:
Метод основан на образовании хорошо растворимых в воде и
слабо диссоциированных комплексных соединений при реакции большинства катионов с аминополикарбоновыми
кислотами
Рабочими растворами являются растворы аминополикарбоновых кислот, титр которых устанавливается по исходному веществу.
Исходными веществами являются растворы MgCI2, MgO, ZnO, CaCO3
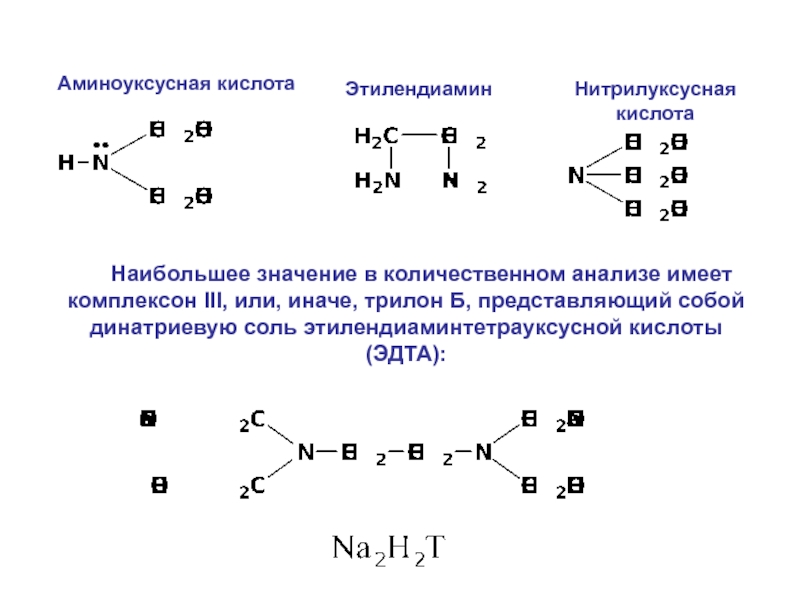
Слайд 34Аминоуксусная кислота
Нитрилуксусная кислота
Этилендиамин
Наибольшее значение в количественном анализе
имеет комплексон III, или, иначе, трилон Б, представляющий собой динатриевую
соль этилендиаминтетрауксусной кислоты (ЭДТА):
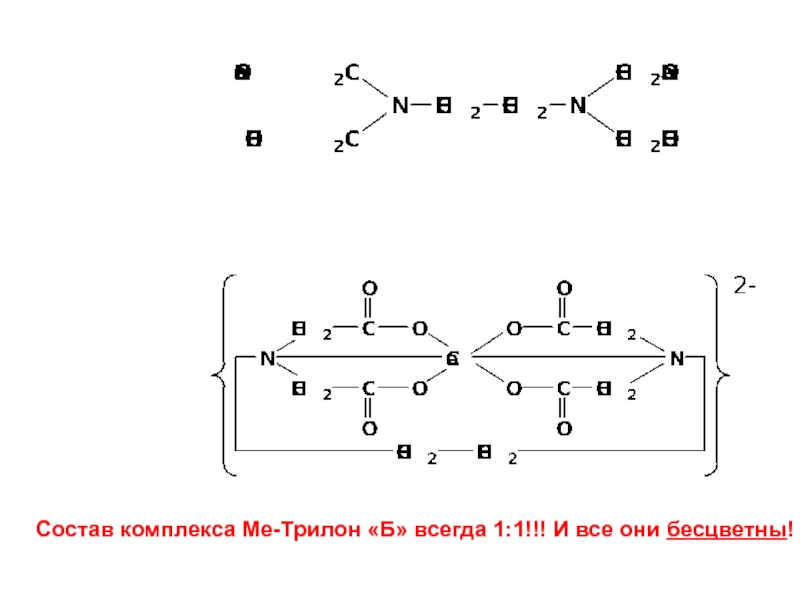
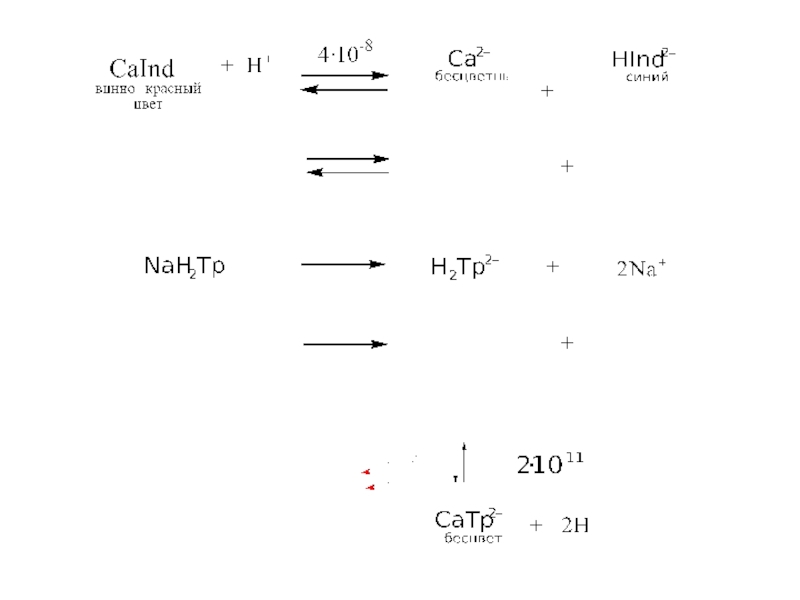
Слайд 35Состав комплекса Ме-Трилон «Б» всегда 1:1!!! И все они бесцветны!
Слайд 36Чем выше заряд иона Мех+, тем образующийся комплекс прочнее!
По возрастающей
степени устойчивости комплекса металл-ЭДТА
двухвалентные металлы располагаются в таком порядке:
Sr, Mg, Ca, Fe, Mn, Co, Zn, Cd, Pb, Cu, Hg, Ni.
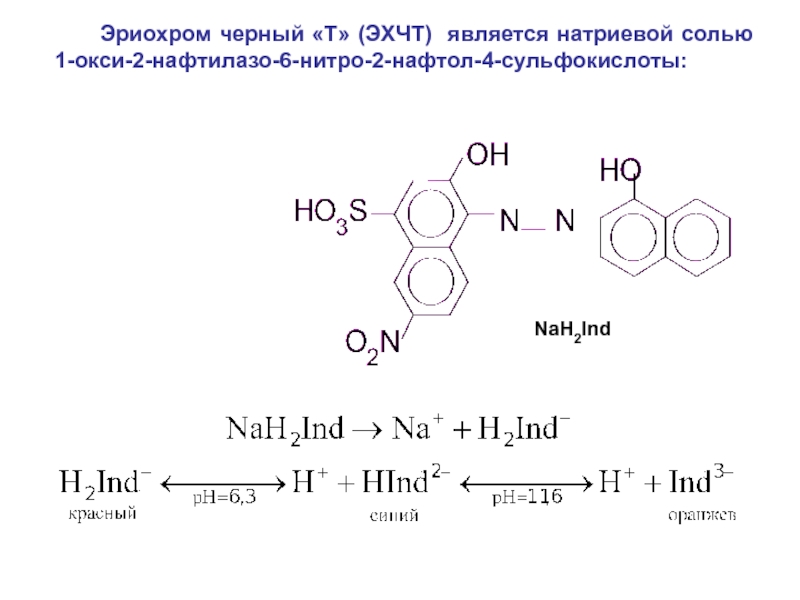
Слайд 37Индикаторы в трилонометрии (металлохромные):
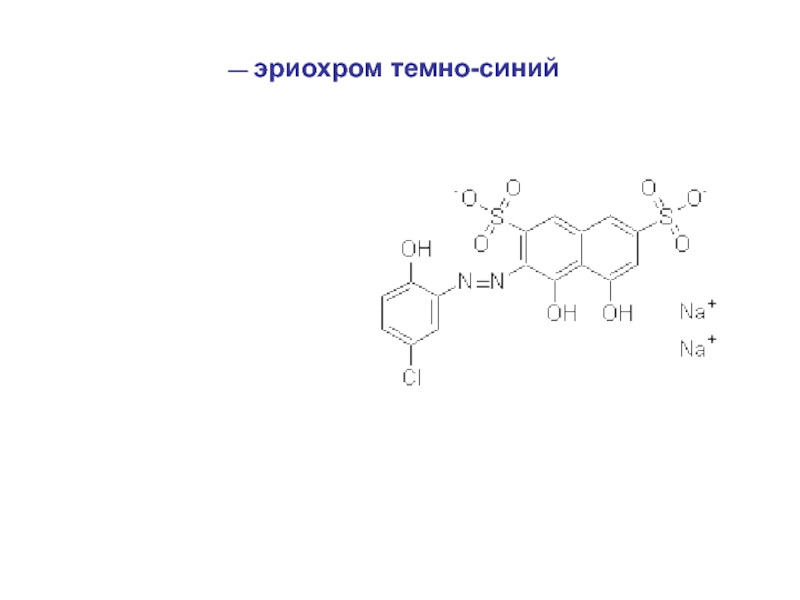
— эриохром черный Т (ЭХЧТ)
Слайд 41 Эриохром черный «Т» (ЭХЧТ) является натриевой солью
1-окси-2-нафтилазо-6-нитро-2-нафтол-4-сульфокислоты:
NaH2Ind
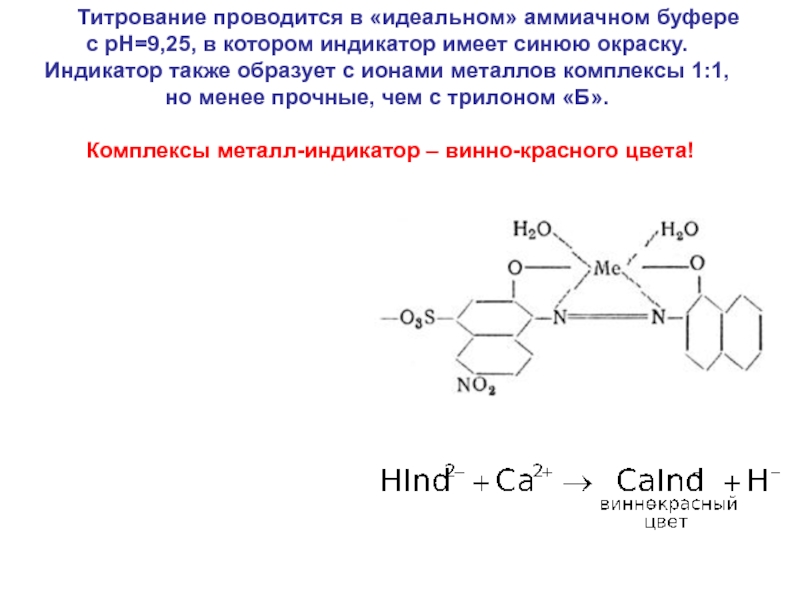
Слайд 42 Титрование проводится в «идеальном» аммиачном буфере с
рН=9,25, в котором индикатор имеет синюю окраску.
Индикатор также образует
с ионами металлов комплексы 1:1, но менее прочные, чем с трилоном «Б».
Комплексы металл-индикатор – винно-красного цвета!
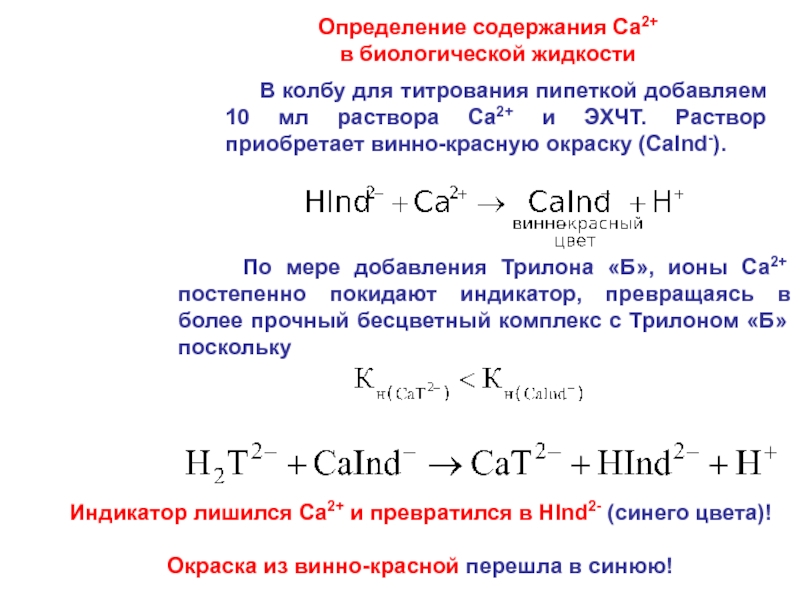
Слайд 43Определение содержания Ca2+
в биологической жидкости
В колбу
для титрования пипеткой добавляем 10 мл раствора Ca2+ и ЭХЧТ.
Раствор приобретает винно-красную окраску (CaInd-).
Индикатор лишился Ca2+ и превратился в HInd2- (синего цвета)!
Окраска из винно-красной перешла в синюю!
По мере добавления Трилона «Б», ионы Са2+ постепенно покидают индикатор, превращаясь в более прочный бесцветный комплекс с Трилоном «Б» поскольку
Слайд 46Применение:
1. Для определения жесткости воды.
Раствор с индикатором до начала титрования
В точке эквивалентности цвет раствора приобрел синюю окраску,
на этом титрование прекращают
Слайд 472. В медицине для определения в различных жидкостях и тканях
человеческого организма микроэлементов и содержания различных
катионов металлов в фармацевтических препаратах
Слайд 483. Комплексоны успешно применяются для растворения камней, образующихся в почках,
печени и желчном пузыре.
Такое применение комплексонов требует очень большой
осторожности, чтобы вместе с растворением камней не происходило разрушение минеральной основы костной и других тканей человеческого организма.
Слайд 495. При свинцовых и ртутных
отравлениях.
4. Для лечения лучевой
болезни.
Слайд 506. Для устранения жесткости воды
(уменьшения концентрации ионов Са 2+ и
Mg 2+
Слайд 51Методы осаждения
Ag+ + Cl- = AgCl↓
Ba2+ + SO42- = BaSO4
↓
3Ca2+ + 2PO43- = Ca3(PO4)2 ↓
Cu2+ + 2OH- = Cu(OH)2
↓
Для осаждения большинства ионов тяжелых металлов из сточных растворов часто применяется гидроксид кальция (гашеная известь). Если годовой объем очищаемой воды равен 1000 м3, а содержание в нем ионов никеля составляет 295 мг/дм3, то с учетом 10 %-го избытка реагента, необходимого для полного осаждения, расход гидроксида кальция составит ______ кг в год. Ar(Ni) = 59.)
Ni2+ + Ca(OH)2 = Ni(OH)2 ↓ + Ca2+