Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
2. Строение атома и периодический закон
Содержание
- 1. 2. Строение атома и периодический закон
- 2. 2.1 Открытие периодического закона
- 3. "Легко предположить, что ныне пока нет еще
- 4. 2.2 Предпосылки открытия строения атома1878 г. – опыты с катодными лучами
- 5. Опыты Перрена
- 6. Слайд 6
- 7. Слайд 7
- 8. А.Г. Столетов – доказал, что электроны есть во всех атомах
- 9. Слайд 9
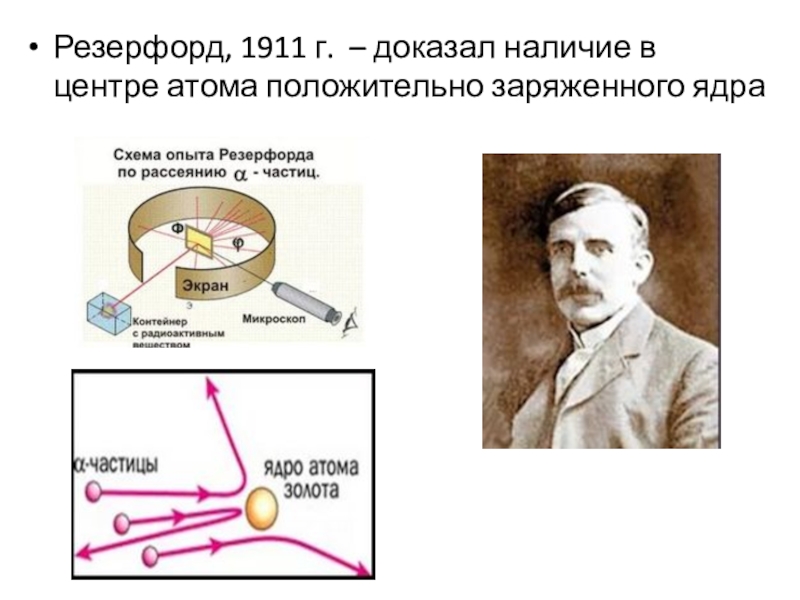
- 10. Резерфорд, 1911 г. – доказал наличие в центре атома положительно заряженного ядра
- 11. 2.3 Модели строения атомаТомсон, «Капельная» модель (арбуз),
- 12. Планетарная модель (Резерфорд, 1911)Недостатки модели: 1) Согласно
- 13. Нильс Бор, 1913 г. Постулаты Бора:1) электрон
- 14. Недостатки теории Н. Бора:1) не пригодна для
- 15. Луи де Бройль, 1924 (гипотеза):любая движущаяся частица
- 16. Слайд 16
- 17. Слайд 17
- 18. 2.5 Состав атомных ядер и атомовД.Д. Иваненко
- 19. Понятия и термины:Энергия, выделяющаяся при образовании ядра
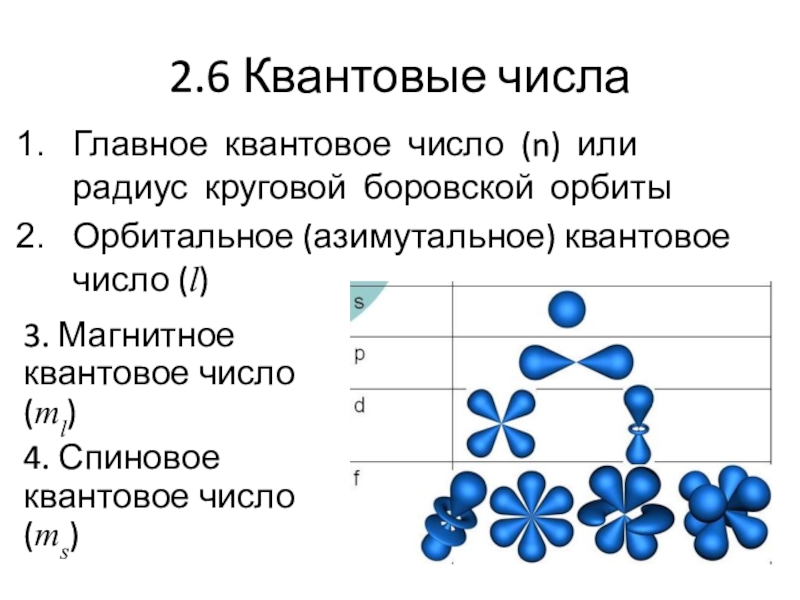
- 20. 2.6 Квантовые числаГлавное квантовое число (n) или
- 21. 2.7 Размещение электрона в атомеПринцип Паули: в
- 22. Правило Клечковского: заполнение электронных подуровней с увеличением
- 23. 2.8 Периодический закон в свете теории строения
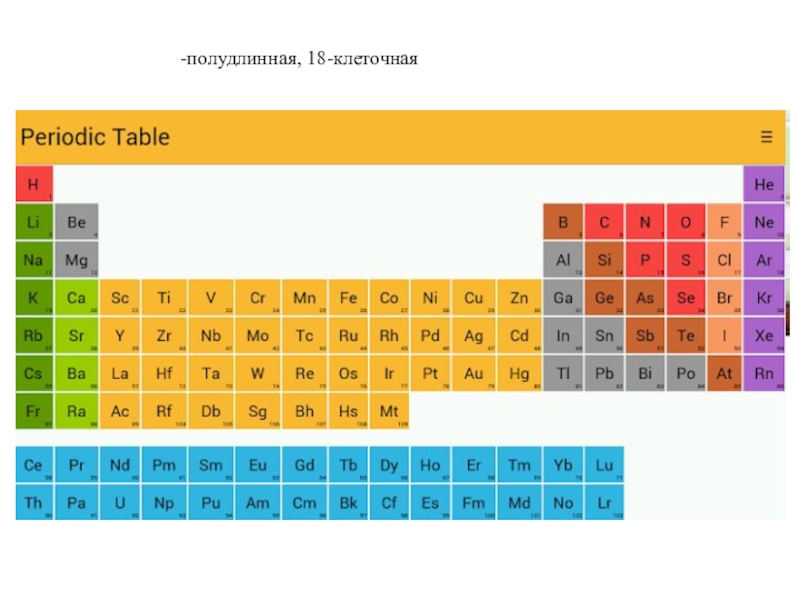
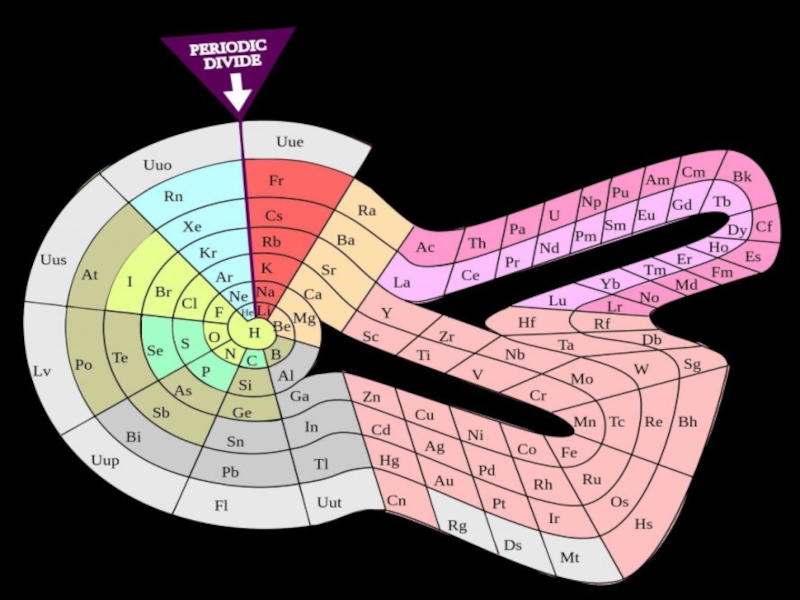
- 24. полудлинная, 18-клеточная
- 25. длинная, 32-клеточная
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. ПериодСовокупность элементов, первые представители которого имеют строение
- 30. ГруппаЭлементы, объединенные сходным электронным строением, называются группой.
- 31. Семейства элементовs-элементыp-элементыd-элементыf-элементы
- 32. 2.9 Свойства нейтральных атомов и их изменение
- 33. Слайд 33
- 34. Выводысвойства химических элементов, расположенных в порядке возрастания
- 35. Скачать презентанцию
2.1 Открытие периодического закона
Слайды и текст этой презентации
Слайд 3 "Легко предположить, что ныне пока нет еще возможности доказать… что
атомы простых тел суть сложные вещества, образованные сложением некоторых еще
меньших частей… Выставленная мною периодическая зависимость, по-видимому, подтверждает такое предчувствие"Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов.
Слайд 112.3 Модели строения атома
Томсон, «Капельная» модель (арбуз), 1903 г.
Положительный заряд
равномерно распределен в объеме атома и внутри него двигаются электроны,
подобно семечкам в арбузеСлайд 12Планетарная модель (Резерфорд, 1911)
Недостатки модели:
1) Согласно закону классической электродинамики
ускоренное движение электронов требует расхода энергии и соответственно расчетам через
10–8 с электрон должен упасть на ядро, атом перестанет существовать. Однако, атом очень устойчивая система.2) Изменение скорости электронов должно сопровождаться излучением, которое содержит все возможные длины волн (спектр сплошной), однако спектр излучения любого атома линейчатый.
Слайд 13Нильс Бор, 1913 г.
Постулаты Бора:
1) электрон в атоме может
вращаться вокруг ядра только по определенным стационарным орбитам. Каждой стационарной
орбите соответствует определенная энергия (энергетический уровень)2) если электрон движется по стационарной орбите, то он не выделяет и не поглощает энергии. Если электрон находится на первой стационарной орбите, его связь с ядром максимальна, а энергия минимальна и такой атом называется невозбужденным. Если атому сообщить энергию извне, то электрон перескакивает на более дальнюю орбиту и такой атом называется возбужденным;
3) при перескоке электрона с более отдаленной орбиты на более близкую орбиту, избыток энергии выделяется в виде света определенной частоты или определенной длины волны. При этом получаются спектры.
Слайд 14Недостатки теории Н. Бора:
1) не пригодна для объяснения строения сложных
атомов начиная с гелия;
2) для атома водорода не могла
объяснить тонкую структуру линейчатого спектра; 3) не могла предсказать поведение атома водорода в магнитном поле.
Слайд 15Луи де Бройль, 1924 (гипотеза):
любая движущаяся частица или предмет обладает
волновыми свойствами с частотой связанной с их движением.
2.4 Корпускулярно-волновой
дуализмСлайд 182.5 Состав атомных ядер и атомов
Д.Д. Иваненко и Е.Н. Гапон
(1932) - протонно-нейтронная теория строения ядра:
ядра всех атомов, кроме ядра
атома водорода, состоят из протонов и нейтронов;число нейтронов равно (A – Z);
силы, удерживающие протоны и нейтроны в ядре, называются ядерными;
В ядре сосредоточена почти вся масса атома;
свойства ядра определяются главным образом числом протонов и нейтронов.
Слайд 19Понятия и термины:
Энергия, выделяющаяся при образовании ядра из протонов и
нейтронов, называется энергией связи.
Энергия, которая выделяется при образовании одного
ядра, называется упаковочным эффектом. Сумма всех протонов называется зарядным числом и равна порядковому номеру элемента в периодической системе, т.е. порядковый номер выражает положительный заряд ядра атома. Сумма всех протонов и нейтронов в ядре называется массовым числом.
Электроны вращаются по стационарным орбитам. Орбиту электрона называют энергетическим уровнем или квантовым слоем.
Околоядерное пространство, в котором с наибольшей вероятностью может находиться электрон, называется атомной орбиталью (АО).
Слайд 202.6 Квантовые числа
Главное квантовое число (n) или радиус круговой боровской
орбиты
Орбитальное (азимутальное) квантовое число (l)
3. Магнитное квантовое число (ml)
4. Спиновое
квантовое число (ms)Слайд 212.7 Размещение электрона в атоме
Принцип Паули: в атоме не может
быть двух электронов, характеризующихся одинаковым набором всех четырех квантовых чисел.
Следствия
из него:максимальное число электронов на данном энергетическом уровне равно 2n2;
максимальное число электронов на данном энергетическом подуровне равно 2(2l + 1)
Слайд 22Правило Клечковского: заполнение электронных подуровней с увеличением порядкового номера атома
элемента происходит от меньшего значения (n + l) к большему
значению (n + l), а при равных значениях (n + l) заполняются сначала энергетические подуровни с меньшим значением nПравило Хунда: электроны в пределах энергетического подуровня располагаются сначала по одному, а затем если электронов больше чем орбиталей, то они заполняются уже двумя электронами или чтобы суммарный спин был максимальным.
Правило «проскока» электронов
+ Nb, Ru, Rh, Pt
Pd
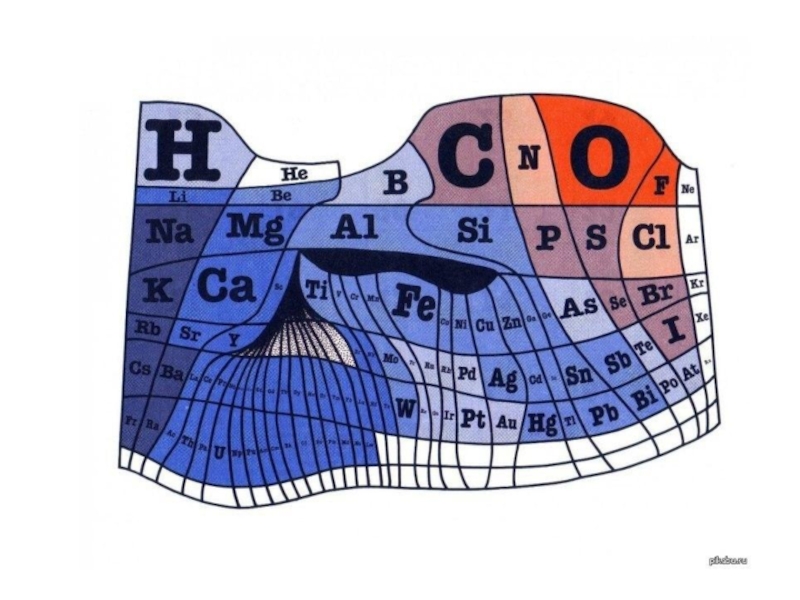
Слайд 232.8 Периодический закон в свете теории строения атома
Свойства химических элементов,
а также формы и свойства соединений элементов находятся в периодической
зависимости от заряда ядер их атомов.При последовательном увеличении зарядов атомных ядер периодически повторяется конфигурация электронных оболочек и, как следствие, периодически повторяются химические свойства элементов.
Формы таблицы:
короткая, 8-клеточная
Слайд 29Период
Совокупность элементов, первые представители которого имеют строение наружного слоя ns1,
последнего ns2np6, называется периодом.
Совокупность атомов с одинаковым числом электронных
слоев, называется периодом. Слайд 30Группа
Элементы, объединенные сходным электронным строением, называются группой.
Номер группы указывает
число электронов, которые могут участвовать в образовании химической связи.
Слайд 322.9 Свойства нейтральных атомов и их изменение по периодам и
группам
Металлические и неметаллические свойства
Радиус атома
Энергия ионизации (I)
Энергия сродства к электрону
(E)Электроотрицательность (ЭО)
ЭО = I + E.
Слайд 34Выводы
свойства химических элементов, расположенных в порядке возрастания заряда ядра, изменяются
периодически потому, что периодически повторяется сходное строение внешнего электронного слоя
атомов элементов;плавное изменение свойств элементов в пределах одного периода можно объяснить постепенным увеличением числа электронов на внешнем слое атомов;
завершение внешнего электронного слоя атома приводит к резкому скачку в свойствах, при переходе от галогена к инертному элементу; появление нового внешнего электронного слоя – причина резкого скачка в свойствах при переходе от инертного элемента к щелочному металлу;
свойства химических элементов, принадлежащих к одному семейству, сходны потому, что на внешнем электронном слое их атомов одинаковое число электронов.