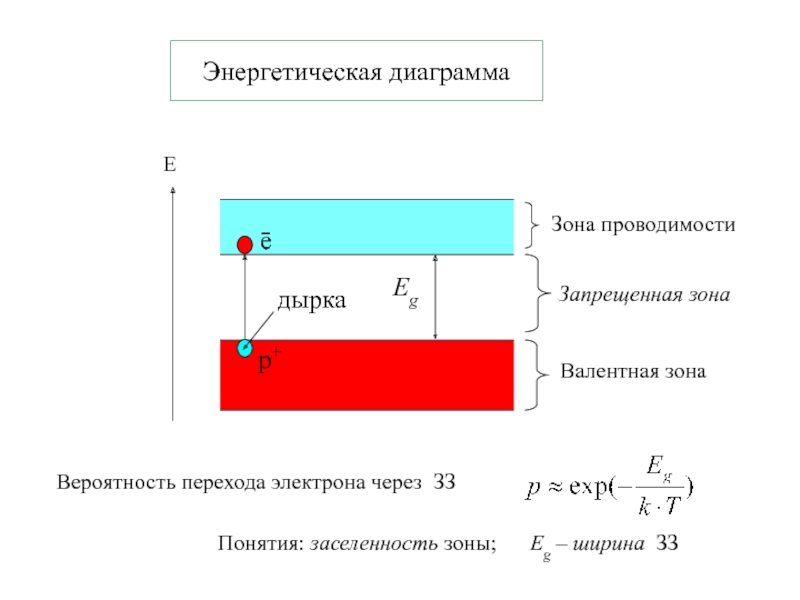
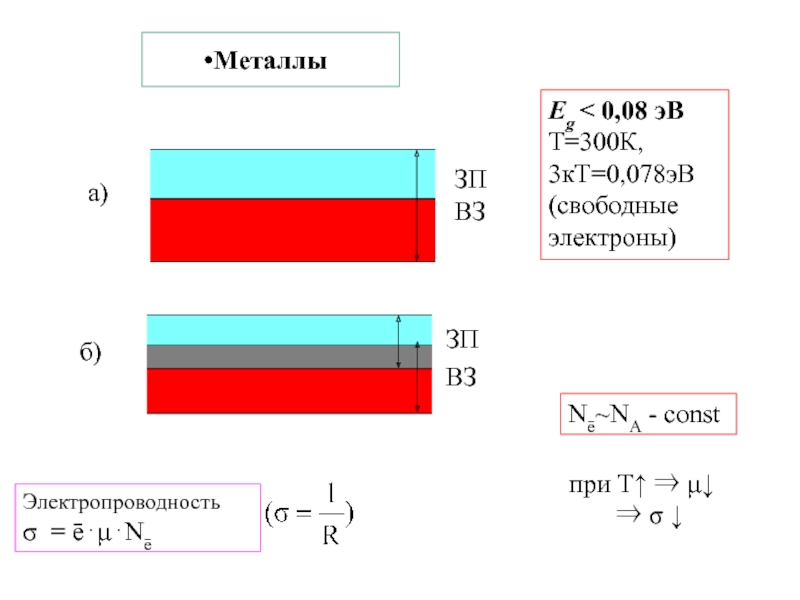
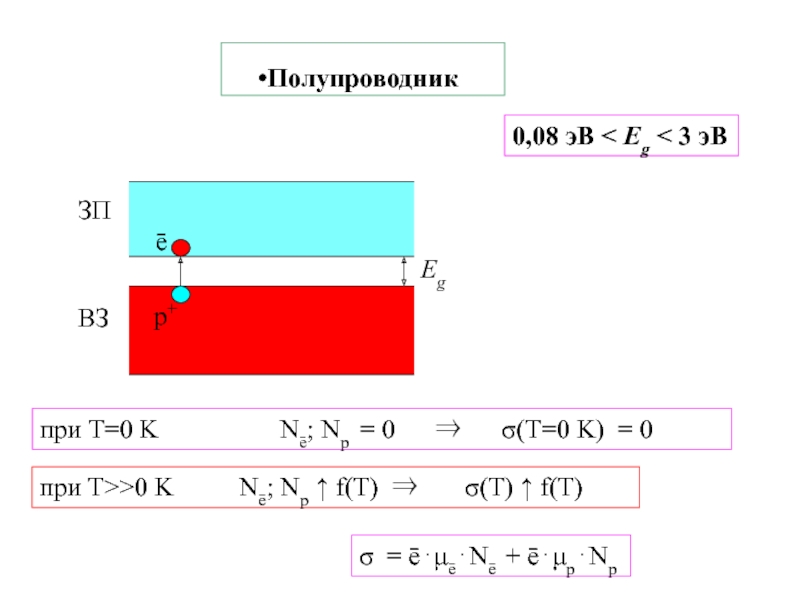
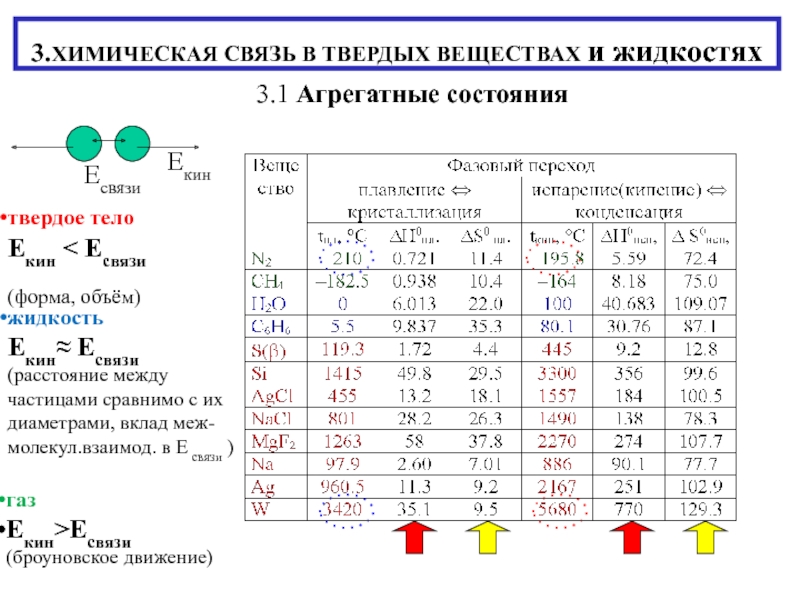
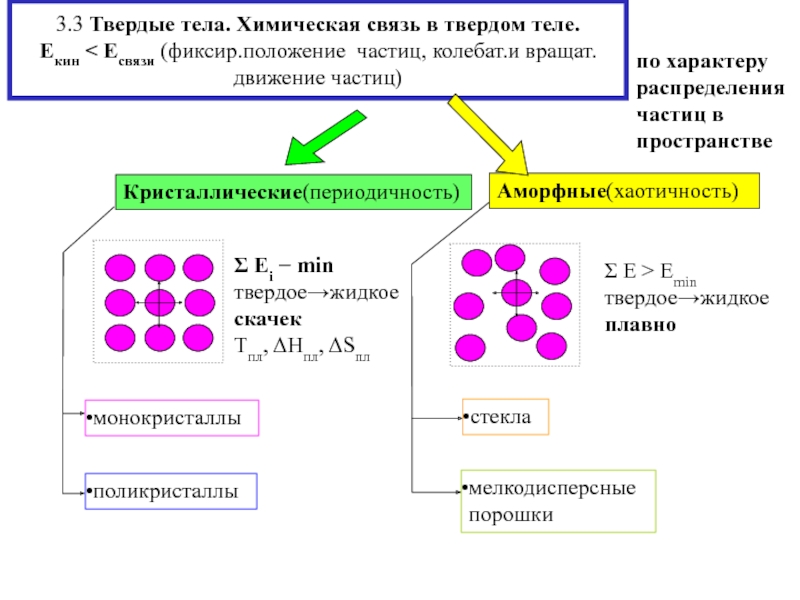
тело Екин Есвязи
(форма, объём)
жидкость
Екин Есвязи
(расстояние между
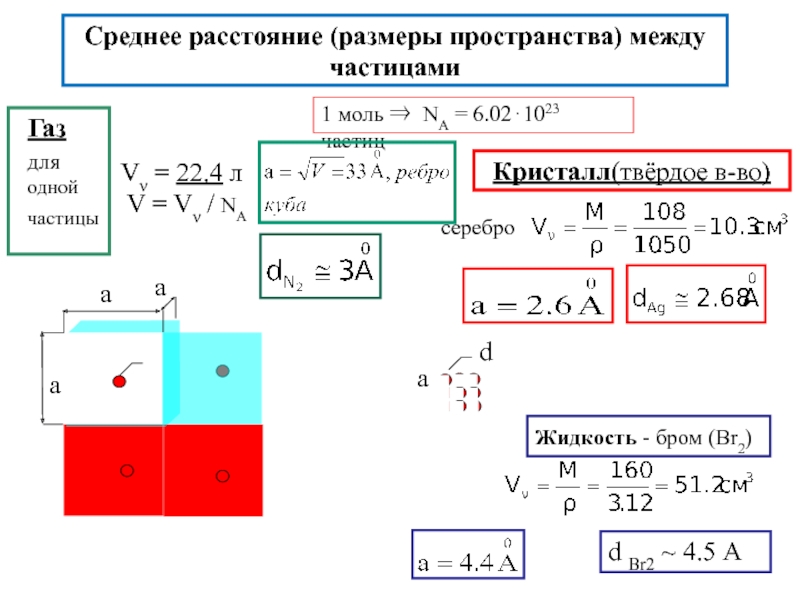
частицами сравнимо с их диаметрами, вклад меж- молекул.взаимод. в Е связи ) газ
Екин>Есвязи
(броуновское движение)
![3. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ и жидкостях Полярность связиДипольный момент(мера полярности связи) = l[Клм], Дебай (D)1 Полярность связиДипольный момент(мера полярности связи) = l[Клм], Дебай (D)1 D = 3,3310-30 Клм-заряд, l-длина](/img/thumbs/3671b1b503b90387c08c75a29a1e4b08-800x.jpg)

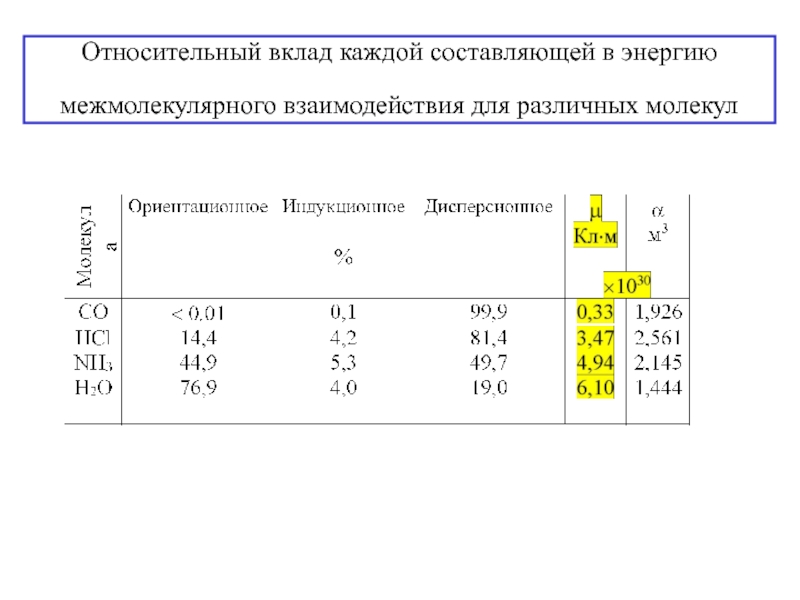
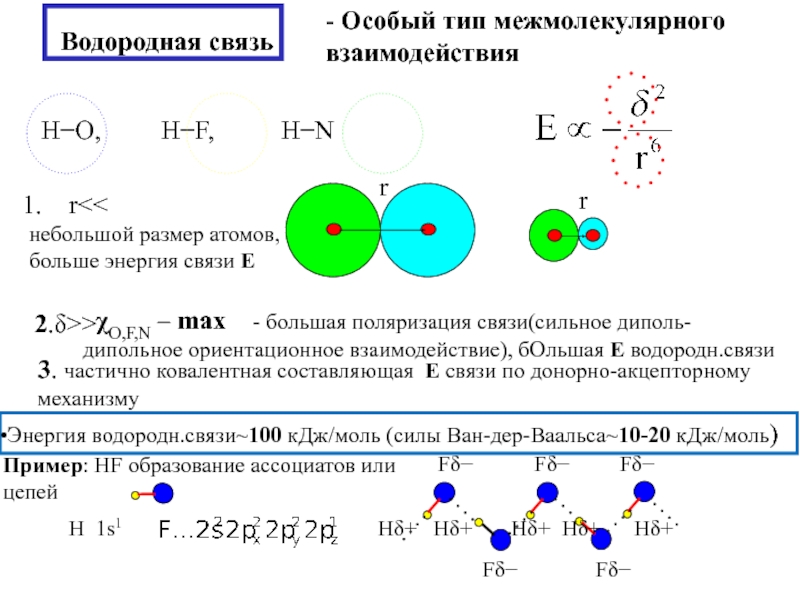
![3. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ и жидкостях Силы Ван-дер-Ваальса [без обмена электронами, межмолекулярное взаимодействие (притяжение) диполей]1. Ориентационный эффект Силы Ван-дер-Ваальса [без обмена электронами, межмолекулярное взаимодействие (притяжение) диполей]1. Ориентационный эффект (Кьезома) (взаимодействие(электростатическое притяжение) пост.диполь – пост.диполь)](/img/thumbs/e91deb1e175747e36b24263bab9ba0ac-800x.jpg)
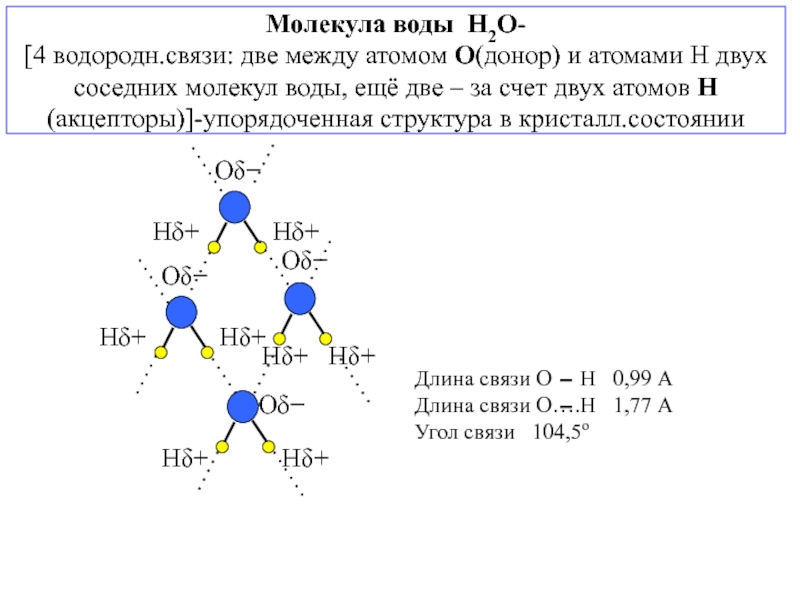
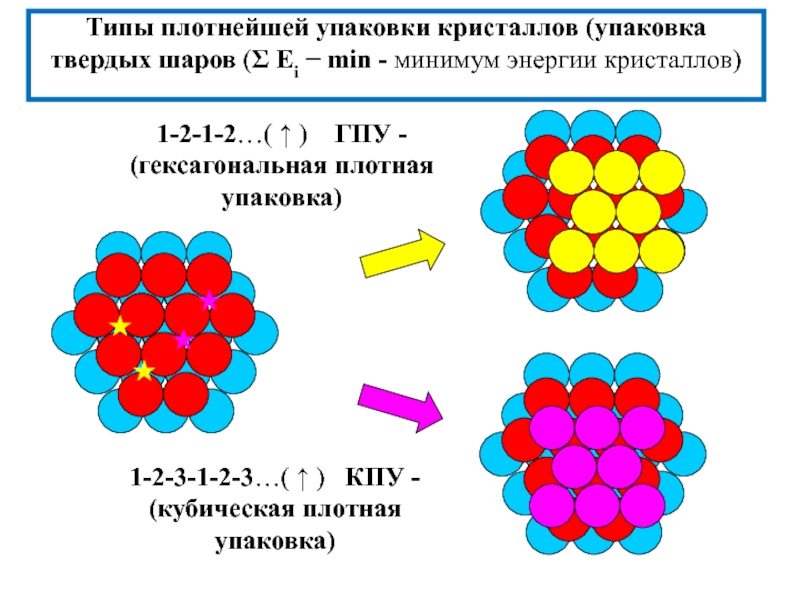
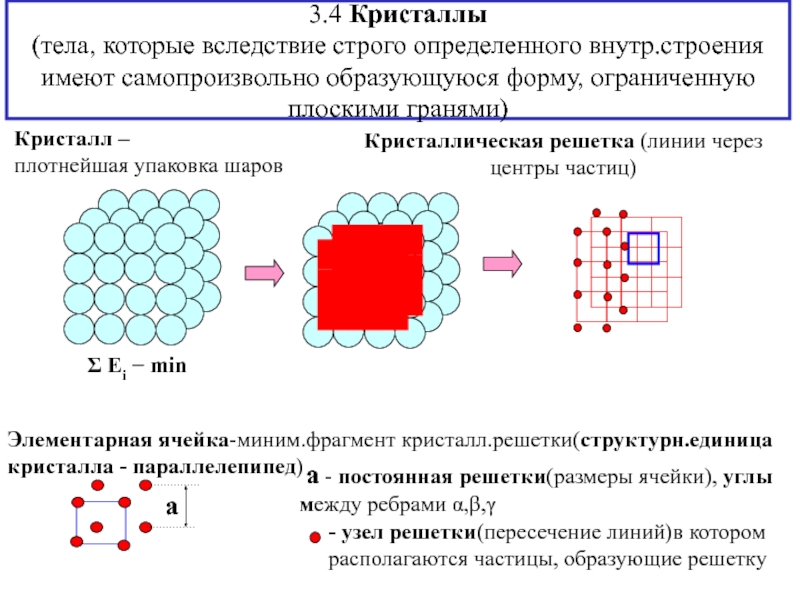
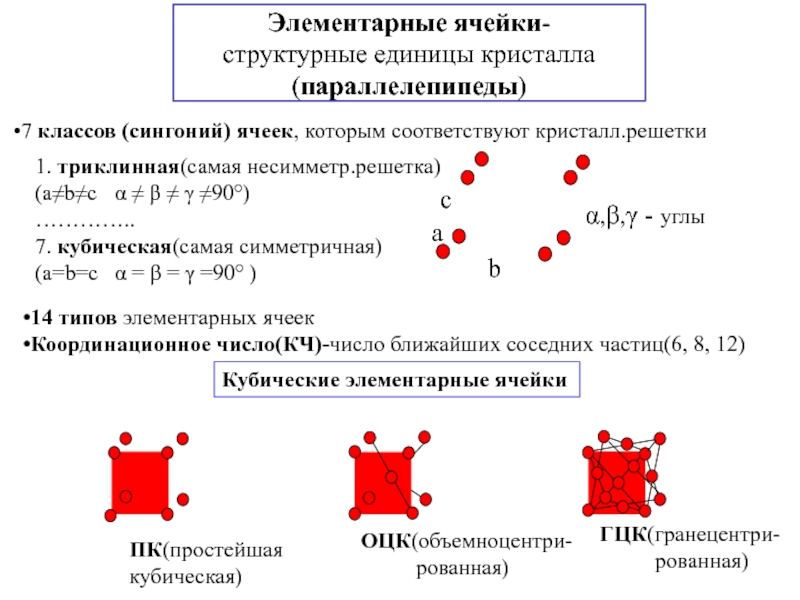
![3. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ и жидкостях Анизотропия свойств монокристалла; полиморфизм(аллотропические модификации)- зависимость физико-химических свойств кристалла от выбранного Анизотропия свойств монокристалла; полиморфизм(аллотропические модификации)- зависимость физико-химических свойств кристалла от выбранного в нем направления [кристаллографической ориентации(плоскости)]; -](/img/thumbs/50672c3d8eee9c1acf80083787c9151e-800x.jpg)