Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
5-лек-ХС.ppt
Содержание
- 1. 5-лек-ХС.ppt
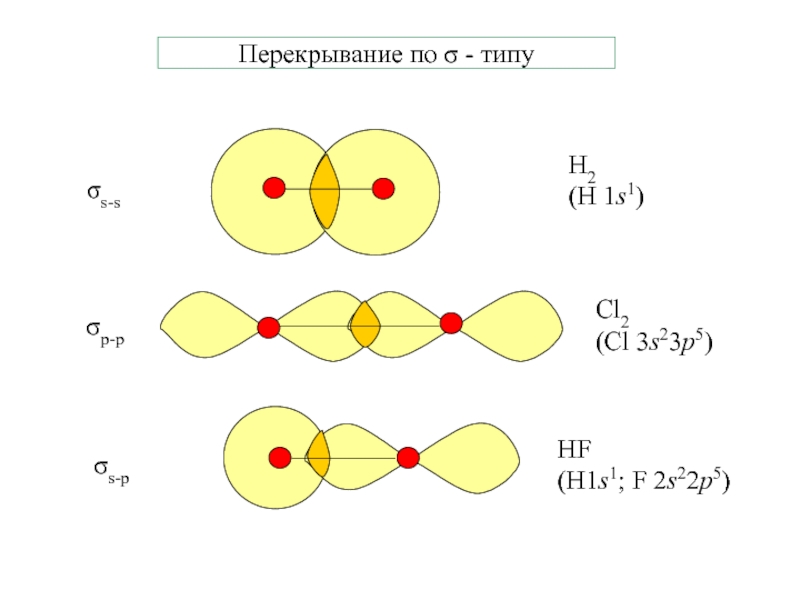
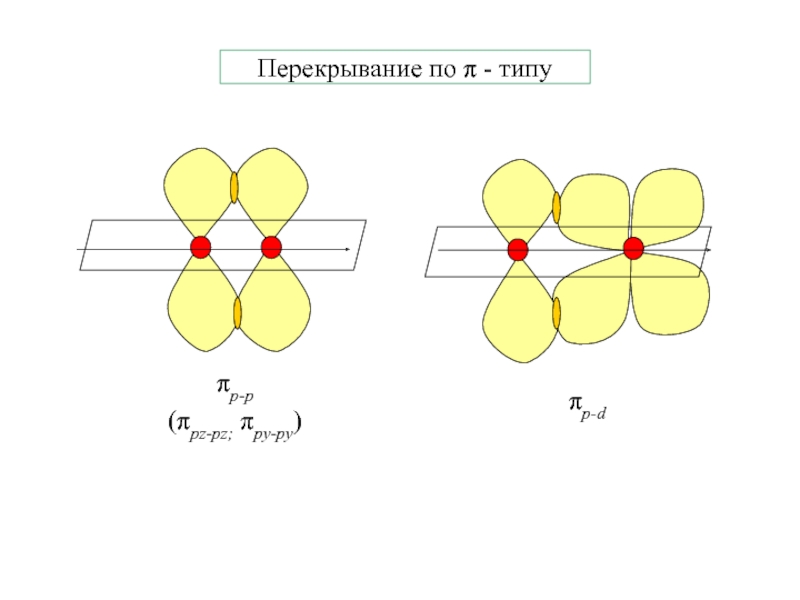
- 2. Перекрывание по π - типуπp-p(πpz-pz; πpy-py)πp-d
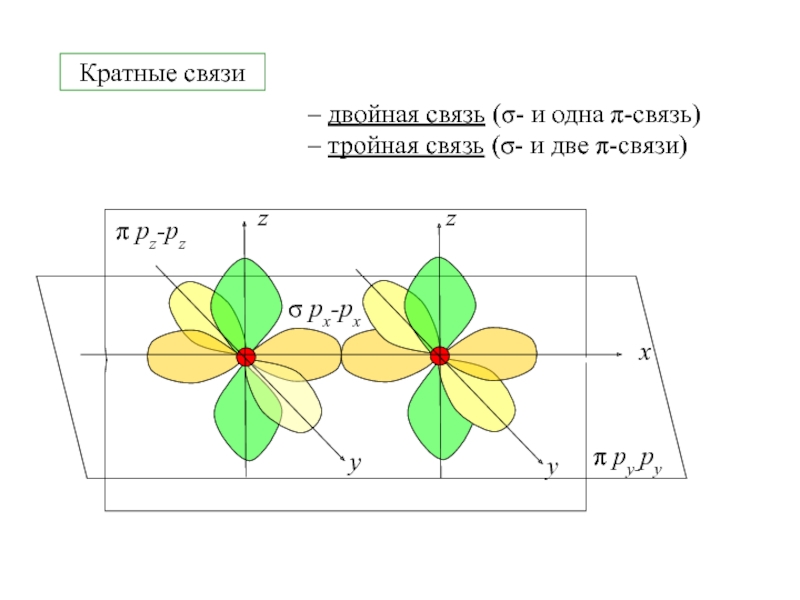
- 3. Кратные связи– двойная связь (σ- и одна
- 4. Примеры
- 5. 2.5 Геометрия простейших молекул (ВС). Гибридизация АОМолекулы H2O, H2S, H2SeH 1s1 O, S, Se ns2npx2py1pz1
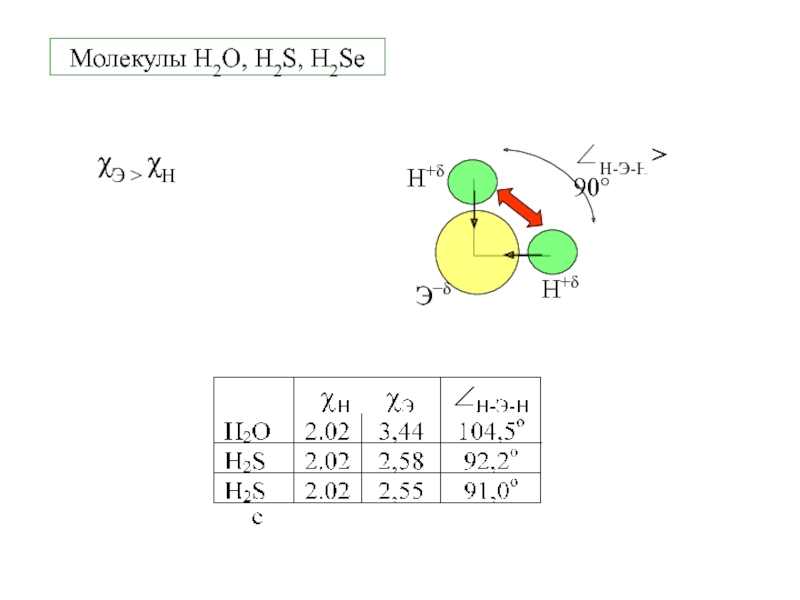
- 6. Молекулы H2O, H2S, H2SeχЭ > χН
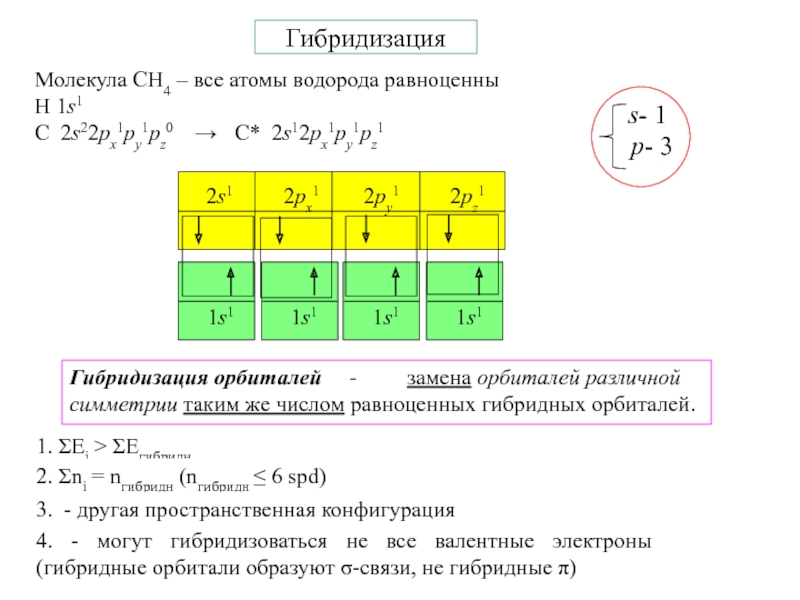
- 7. ГибридизацияМолекула СH4 – все атомы водорода равноценныH
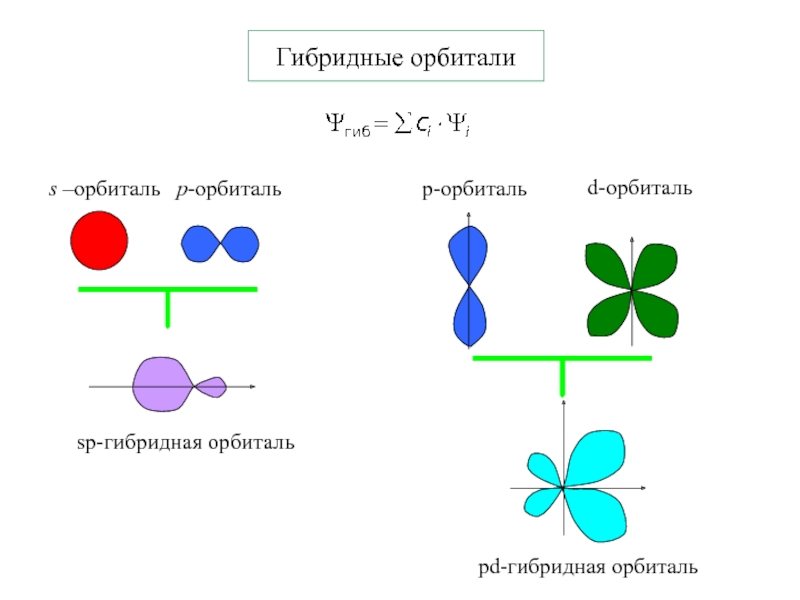
- 8. Гибридные орбитали
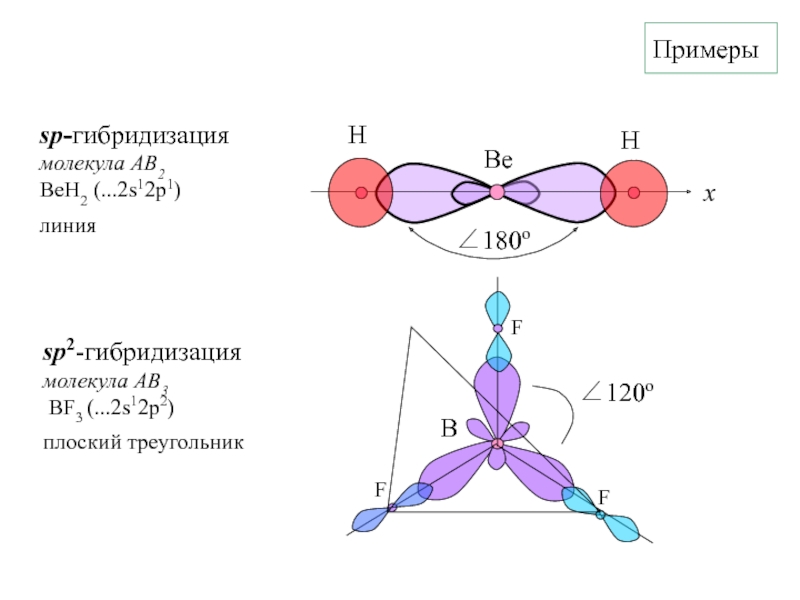
- 9. Примерыsp-гибридизациямолекула АВ2BeH2 (...2s12p1)линияsp2-гибридизация молекула АВ3 BF3 (...2s12p2)плоский треугольникB
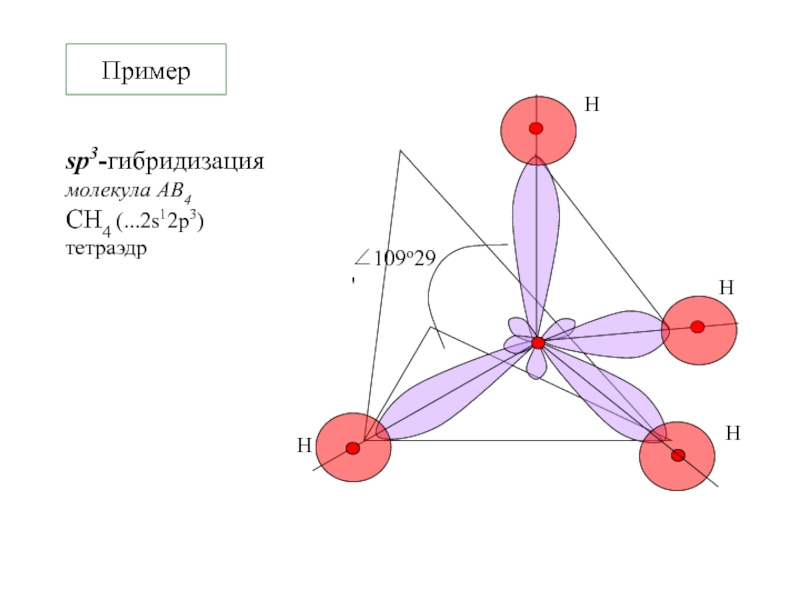
- 10. Примерsp3-гибридизация молекула АВ4СH4 (...2s12p3)тетраэдр
- 11. Примерdsp2-гибридизация молекулярный ион [CuCl4]-2 плоский квадрат Cu
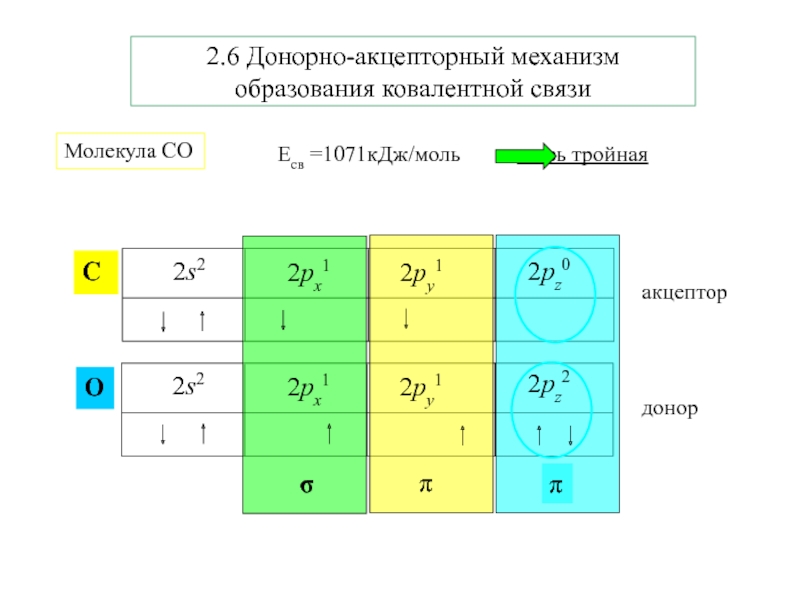
- 12. 2.6 Донорно-акцепторный механизм образования ковалентной связиМолекула СО
- 13. Ион [NH4]+ NH3 + H+ → [NH4]+четыре
- 14. 2.7 Метод молекулярных орбиталей (МО)1. Каждый электрон
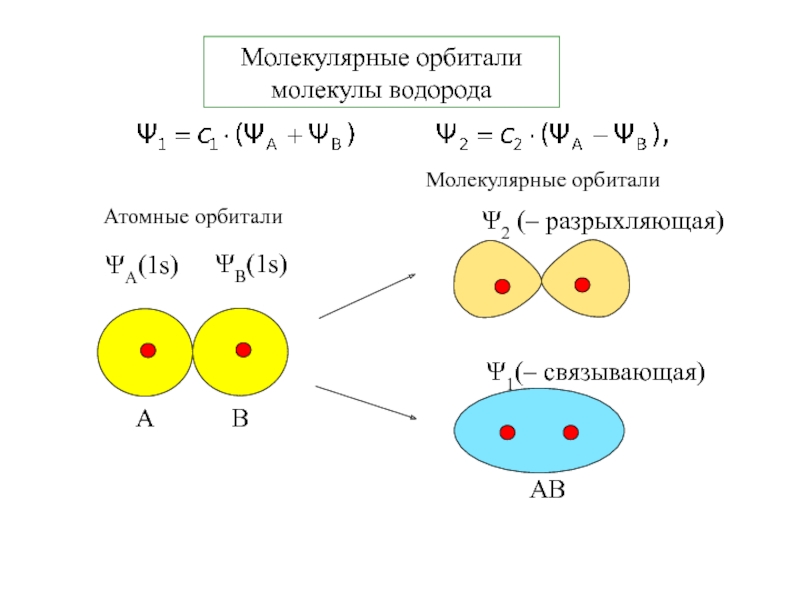
- 15. Молекулярные орбитали молекулы водорода
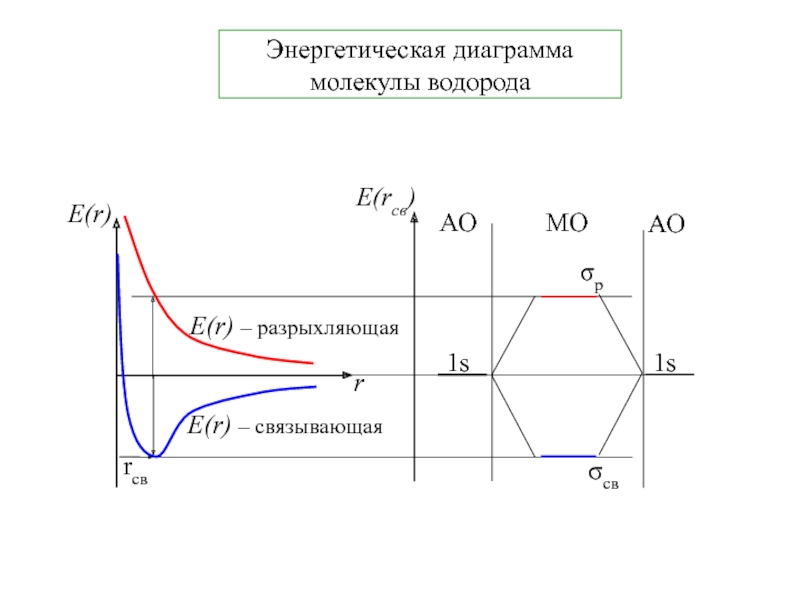
- 16. Энергетическая диаграмма молекулы водорода
- 17. Метод МО1. Выбираются АО, принимающие участие в
- 18. Энергетическая диаграмма молекулы NOпарамагнетикNO [σсв(s)]2 [σ(s) р]2[σсв(px)]2[πсв(py)]2[πсв(pz)]2[πр(py)]1
- 19. Скачать презентанцию
Слайды и текст этой презентации
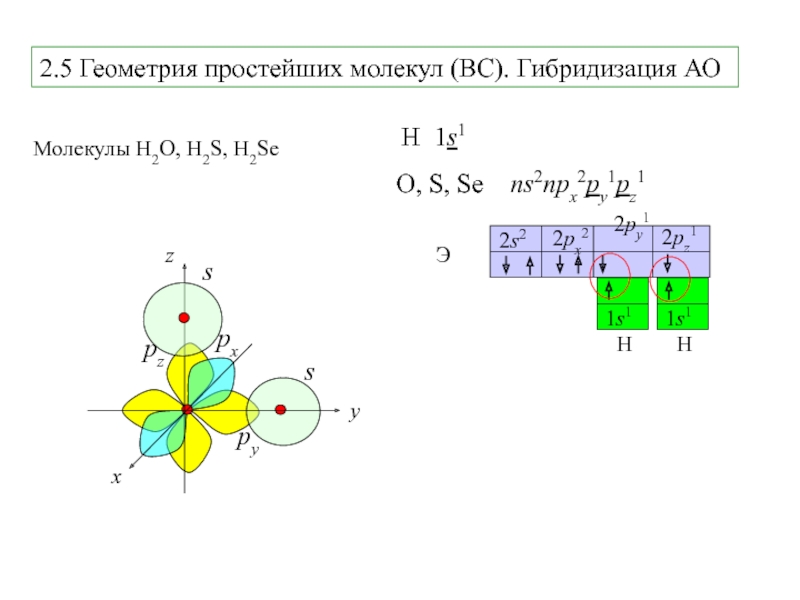
Слайд 52.5 Геометрия простейших молекул (ВС). Гибридизация АО
Молекулы H2O, H2S, H2Se
H
1s1
O, S, Se ns2npx2py1pz1
Слайд 7Гибридизация
Молекула СH4 – все атомы водорода равноценны
H 1s1
С 2s22px1py1pz0 → С*
2s12px1py1pz1
Гибридизация орбиталей - замена
орбиталей различной симметрии таким же числом равноценных гибридных орбиталей.1. ΣЕi > ΣЕгибридн
2. Σni = nгибридн (nгибридн ≤ 6 spd)
3. - другая пространственная конфигурация
4. - могут гибридизоваться не все валентные электроны (гибридные орбитали образуют σ-связи, не гибридные π)
Слайд 9Примеры
sp-гибридизация
молекула АВ2
BeH2 (...2s12p1)
линия
sp2-гибридизация
молекула АВ3
BF3 (...2s12p2)
плоский треугольник
B
Слайд 13Ион [NH4]+ NH3 + H+ → [NH4]+
четыре равноценных атома водорода
тетраэдрическая конфигурация → sp3-гибридные орбитали
N 2s22px12py12pz1 Н 1s1 Н+
1s0
Слайд 142.7 Метод молекулярных орбиталей (МО)
1. Каждый электрон в молекуле движется
в результирующем поле всех ядер и остальных электронов. Молекула рассматривается
как единая частица.2. Волновые функции описывают молекулярные орбитали. Линейная комбинация АО. МО многоцентровые.
3. Совокупность молекулярных орбиталей называется электронной конфигурацией молекулы.
Заполнение электронами молекулярных орбиталей осуществляется согласно
принципа минимума энергии,
принципа Паули,
правила Хунда.
Слайд 17Метод МО
1. Выбираются АО, принимающие участие в образовании химической связи
(валентные орбитали).
Для s- и p-элементов валентными орбиталями являются ns-
и np-электроны. 2. Взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи, при этом число образующихся МО равно числу АО.
ns-атомные орбитали образуют две σ-молекулярные оритали.
np-орбитали образуются две σ- и четыре π-молекулярные орбитали.
3. Точное значение энергий МО необходимо рассчитывать, можно пользоваться известными качественными схемами энергетических диаграмм молекул определенного типа.

![5-лек-ХС.ppt Примерdsp2-гибридизация молекулярный ион [CuCl4]-2 плоский квадрат Cu Примерdsp2-гибридизация молекулярный ион [CuCl4]-2 плоский квадрат Cu](/img/thumbs/cb2a52fb92e5dfbab3f58b905e9b834d-800x.jpg)
![5-лек-ХС.ppt Ион [NH4]+ NH3 + H+ → [NH4]+четыре равноценных атома водорода тетраэдрическая Ион [NH4]+ NH3 + H+ → [NH4]+четыре равноценных атома водорода тетраэдрическая конфигурация → sp3-гибридные орбитали N](/img/thumbs/d869e19d621af9b789740a30b8c0835e-800x.jpg)


![5-лек-ХС.ppt Энергетическая диаграмма молекулы NOпарамагнетикNO [σсв(s)]2 [σ(s) р]2[σсв(px)]2[πсв(py)]2[πсв(pz)]2[πр(py)]1 Энергетическая диаграмма молекулы NOпарамагнетикNO [σсв(s)]2 [σ(s) р]2[σсв(px)]2[πсв(py)]2[πсв(pz)]2[πр(py)]1](/img/thumbs/5ea5951abb0e661d8f61f693a14dfbdf-800x.jpg)



















