Слайд 1АДРЕСНАЯ ДОСТАВКА ЛЕКАРСТВЕННЫХ НАНОПРЕПАРАТОВ
В ПРИМЕНЕНИИ К МОДЕЛЯМ РАКА НА
ДОКЛИНИЧЕСКОМ
ЭТАПЕ ИССЛЕДОВАНИЙ
Выполнила: студентка 4 курса педиатрического факультета группы
2.4.01а Байрамукова Т.М. Руководитель кружка: д.м.н., Румянцева Ю.В.
Москва 2019
Министерство здравоохранения Российской Федерации Федеральное Государственное бюджетное образовательное учреждение высшего образования «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова»
СНК кафедры онкологии, гематологии и лучевой терапии педиатрического факультета
Слайд 2Нанотехнологии в медицине
Развитие нанотехнологий в медицине позволяет успешно реализовать качественно
новый уровень диагностики и лечения заболеваний, в том числе и
онкологических.
Проблема заболеваемости и смертности от злокачественных новообразований — одна из наиболее актуальных в современной медицине. Она затрагивает интересы всего человечества. По данным Всемирной Организации Здравоохранения, ежегодно в мире умирает от рака более 4 млн. человек
Слайд 3Стратегии терапии рака разрабатываются по двум направлениям:
оптимизация диагностических
протоколов для обнаружения опухолей на ранних стадиях;
разработка персонализированных средств
терапии для увеличения эффективности и селективности лечения.
Проводимые в последнее время исследования были направлены на рациональное внедрение обоих подходов, а их результаты внесли вклад в разработку нанопрепаратов, которые можно адресно доставлять к пораженным тканям в целях тераностики опухолей на доклинических моделях.
Эти модульные наносистемы достаточно гибки и позволяют объединить визуализацию и таргетирование лекарств для применения в онкологии. Они могут служить базой для дальнейшего усовершенствования методов лечения рака.
Слайд 4Нанопрепарат
— это терапевтический, диагностический или комбинированный (тераностический = терапевтический +
диагностический) агент, помещенный внутрь наночастицы (НЧ) или присоединенный к ней.
Слайд 5Задача наночастиц, несущих на своей поверхности лекарство, не «попасться в руки
иммунной системы человека»
НЧ способствует:
- лучшему биораспределению агента
- повышает его
эффективность
- понижает токсичность
В ходе работы были идентифицированы новые биомаркеры и изучено применение нанопрепаратов таргетированной доставки для визуализации рака (флуоресцентные НЧ) и
его терапии (содержащие лекарства липосомы) на моделях для доклинических исследований. В настоящем обзоре кратко описываются основные результаты этой работы.
Слайд 6Прицельная молекулярная визуализация метастатического колоректального рака
комплекс интегрина альфа-6 и
E-кадгерина, который присутствует на поверхности раковых клеток толстой кишки и
отсутствует у нормальных клеток толстой кишки
специфический лиганд к этому рецепторному комплексу (ангиопоэтинподобный белок 6) - фактор, в больших количествах вырабатываемый здоровой печенью и физиологически вовлеченный в метаболизм липидов
Данный комплекс рецептора и лиганда участвует во вторичном распространении опухолей
Слайд 7Пептиды-аналоги ангиопоэтинподобного белка 6
CGIYRLRS
CGVYSLRS (однобуквенный код аминокислот)
эти пептиды связывают комплекс
интегрин альфа-6/E-кадгерин благодаря способности конкурировать с ангиопоэтинподобным белком 6 при
связывании рецепторного комплекса (и таким образом ингибировать метастазирование в печень)
Они представляют собой потенциальное средство для идентификации клеток опухолей, которые вырабатывают как интегрин альфа-6, так и E-кадгерин
Слайд 8Нанопрепараты для визуализации рака
В данном исследовании были использованы кремниевые НЧ,
которые имеют подходящий токсикологический профиль и хорошую биосовместимость in vivo
в сочетании с легкостью выполнения манипуляций in vitro
Были созданы модульные наносистемы, чтобы получить визуализационную платформу, состоящую из флуоресцентных кремний-полиэтиденгликолевых (ПЭГ) НЧ, на поверхности которых присутствует пептид CGIYRLRS или CGVYSLRS.
Слайд 9Такие НЧ имеют ядро из диоксида кремния, к которому добавлены
один или несколько флуоресцентных красителей на основе алкоксисиланов; ядро заключено
в мицеллу сополимера Pluronic®F127.
Иными словами, они состоят из полиэтиленгликолевой оболочки, внутри которой находится ядро из диоксида кремния с добавлением красителя.
Полиэтиленгликоль снаружи работает как стандартный полимер для обеспечения малозаметности, способствуя стабильной дисперсии в физиологических условиях и препятствуя поглощению клетками фагоцитарной системы.
Слайд 10НЧ имеют диаметр ядра SPN 11 ± 3 нм и
гидродинамический диаметр 23 нм, они содержат краситель родамин В (Rhod),
цианин 5 (Cy5) (одноцветные) или оба (двухцветные)
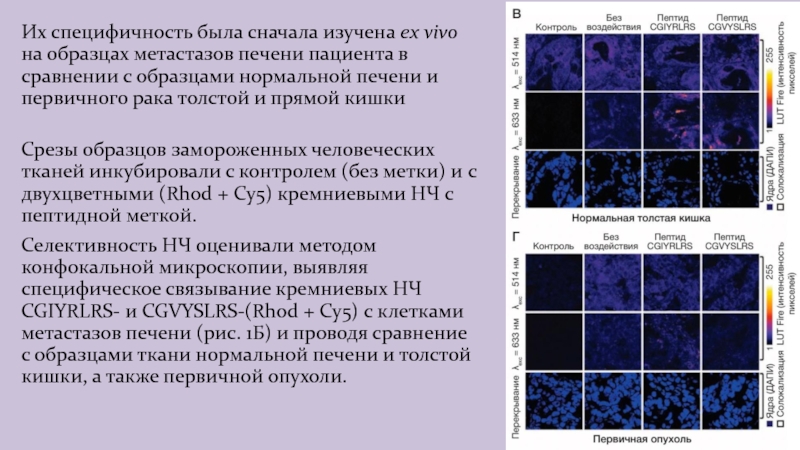
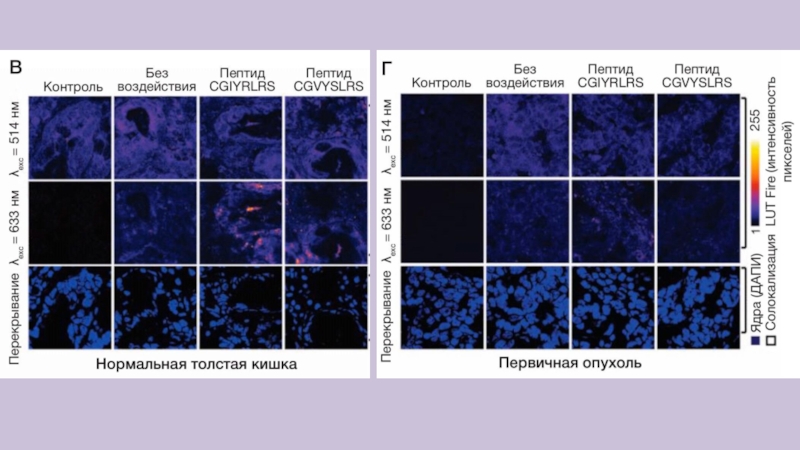
Слайд 11Их специфичность была сначала изучена ex vivo на образцах метастазов
печени пациента в сравнении с образцами нормальной печени и первичного
рака толстой и прямой кишки
Срезы образцов замороженных человеческих тканей инкубировали с контролем (без метки) и с двухцветными (Rhod + Cy5) кремниевыми НЧ с пептидной меткой.
Селективность НЧ оценивали методом конфокальной микроскопии, выявляя специфическое связывание кремниевых НЧ CGIYRLRS- и CGVYSLRS-(Rhod + Cy5) с клетками метастазов печени (рис. 1Б) и проводя сравнение с образцами ткани нормальной печени и толстой кишки, а также первичной опухоли.
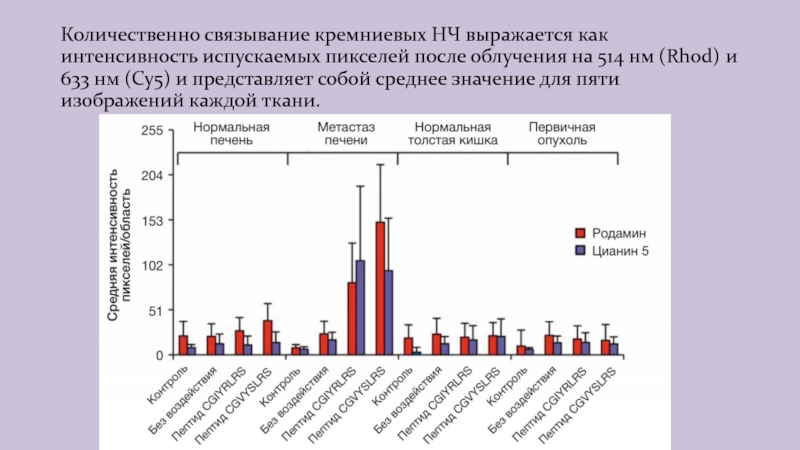
Слайд 14Количественно связывание кремниевых НЧ выражается как интенсивность испускаемых пикселей после
облучения на 514 нм (Rhod) и 633 нм (Cy5) и
представляет собой среднее значение для пяти изображений каждой ткани.
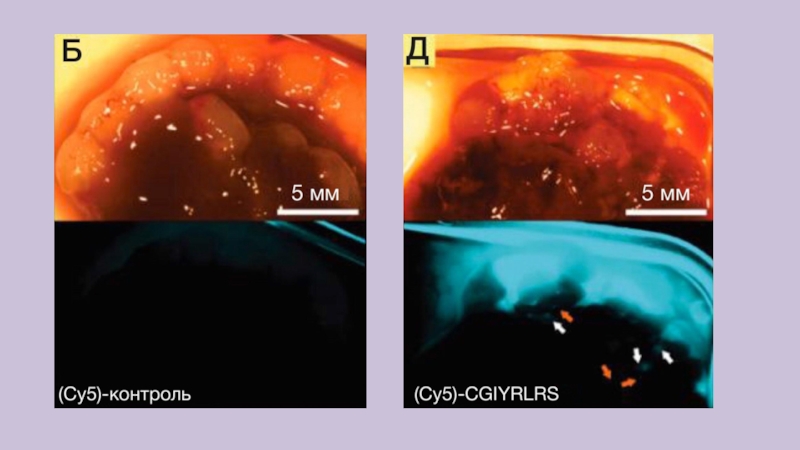
Слайд 15Кремниевые НЧ in vivo на модельных мышах с псевдо-метастатической опухолью
Мышам с диабетом без ожирения/тяжелым комбинированным иммунодефицитом, имеющим первичные опухоли
и множественные метастазы в печени, ввели одноцветные кремниевые НЧ (контроль (A, Rhod; Б, Cy5) или НЧ CGIYRLRS (Г, Rhod; Д, Cy5)), двухцветные НЧ (контроль (В) или НЧ CGIYRLRS (Е))
Через 16 ч мышей усыпили, а извлеченные органы сфотографировали на цифровую камеру высокого разрешения, подключенную к флуоресцентному стереомикроскопу.
Слайд 18Трехмерная реконструкция нескольких конфокальных микрофотографий показала, что меченые кремниевые НЧ
располагаются очень близко к кровеносным сосудам опухоли
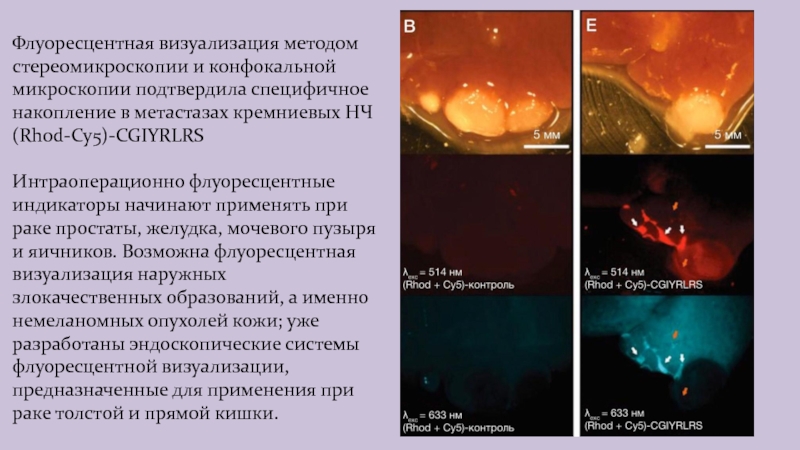
Слайд 19Флуоресцентная визуализация методом стереомикроскопии и конфокальной микроскопии подтвердила специфичное накопление
в метастазах кремниевых НЧ (Rhod-Cy5)-CGIYRLRS
Интраоперационно флуоресцентные индикаторы начинают применять
при раке простаты, желудка, мочевого пузыря и яичников. Возможна флуоресцентная визуализация наружных злокачественных образований, а именно немеланомных опухолей кожи; уже разработаны эндоскопические системы флуоресцентной визуализации, предназначенные для применения при раке толстой и прямой кишки.
Слайд 20Целевая доставка препарата при метастатической нейробластоме
В последние годы были
идентифицированы пептиды с уникальными функциями нацеливания для применения в лечении
опухолей.
Из них CPRECES и CNGRC(однобуквенный аминокислотный код) с высокой селективностью связываются с маркерами эндотелиальных/периваскулярных опухолей аминопептидазами
А (APA) и N (APN) соответственно, поэтому они оптимальны для применения в доставке препаратов in vivo через кровяное русло.
Эти два пептида использовали в первом исследовании, целью которого была доклиническая оценка осуществимости доставки нанопрепаратов направленного действия для доксорубицина на моделях нейробластомы первой стадии
Слайд 21Были получены синтетические версии обоих пептидов путем слияния человеческого фактора
некроза опухолей с коротким линкером KY и последующего присоединения к
полиэтиленгликолевым стелс-липосомам, в состав которых входят:
Дистеароилфосфатидилэтаноламинполиэтилен
гликоль
гидрогенизированный соевый фосфатидилхолин
холестерин
В такие стелс-липосомы (SL) был инкапсулирован доксорубицин (DXR) для получения наносистем направленного действия CPRECES-SL[DXR] и CNGRC-SL[DXR] соответственно, имеющих размеры 90–115 нм, инкапсуляцию препарата с выходом 95% и показатель связывания пептидов 4 мкг/мкмоль для каждой липосомы.
Слайд 22Терапевтическая эффективность нацеленных на аминопептидазу N (APN) и A (APA)
липосомных препаратов на модельных мышах с нейробластомой
Для проведения фармакокинетических
исследований такие стелс-липосомы были снабжены двойной меткой, что позволило продемонстрировать достаточную стабильность и продолжительное время циркуляции (до 24 ч). Оценку эффективности этих композиций, как в виде одиночных агентов, так и в составе комбинированных препаратов (COMBO), провели на ортотопических моделях, полученных в результате имплантации человеческих клеток нейробластомы в левый надпочечник мышей.
Введение CPRECES-SL[DXR], CNGRC-SL[DXR] или COMBO обеспечивало достоверное увеличение продолжительности жизни по сравнению с введением свободного препарата
Слайд 23Оценка способности препаратов направленного действия увеличивать продолжительность жизни мышей с
опухолями
Слайд 24Оценка способности препаратов направленного действия увеличивать продолжительность жизни мышей с
опухолями
Слайд 25(A). Карты поглощения глюкозы (белые стрелки: первичная опухоль; черные стрелки:
метастазы). Количество (Б) и объем метастазов (В) после лечения.
Слайд 26Выводы
Весьма актуальна проблема ранней диагностики опухолей и эффективного лечения, которое
имело бы максимальный противоопухолевый эффект, но не затрагивало нормальные ткани.
Появление нанопрепаратов может радикально изменить подход к визуализации и лечению рака при условии, что мы идентифицируем обладающие подходящими свойствами биомаркеры.
В действительности, несмотря на то что разработка наноматериалов стремительно развивается, по-прежнему необходимы мишени с более высокой селективностью, чтобы сделать возможным применение ориентированных на пациента методов.
В этойработе обнаружен ряд мишеней и компонентов направленного действия лекарств, которые были проверены доклинически и могут быть использованы для дальнейшей разработки клинических методов.
Слайд 27МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ ДЛЯ ПЕРСОНАЛИЗИРОВАННОЙ ОЦЕНКИ И ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ДОСТАВКИ
НАНОФОРМУЛЯЦИЙ
ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ
Слайд 28
Магнитно-резонансная томография (МРТ) широко используется для диагностики онкологических заболеваний, а
также для исследования доставки препаратов на магнитных наноносителях.
Накопление наночастиц
в опухоли высоко вариабельно в популяции и зависит от биологических факторов, которые во многом остаются неизученными. В последние годы было высказано предположение о возможности использования МРТ для предсказания ответа на терапию наноформулированными препаратами на основе скрининговых данных о накоплении в опухоли магнитно-контрастных диагностикумов.
В статье обсуждаются преимущества и недостатки методов, позволяющих стратифицировать опухоли по степени накопления наночастиц.
Слайд 29Основными направлениями в области диагностики и лечения злокачественных новообразований являются:
внедрение высокоинформативных методов диагностики онкопатологии;
разработка новых препаратов и способов
их доставки в опухоль;
переход к персонализированной медицине.
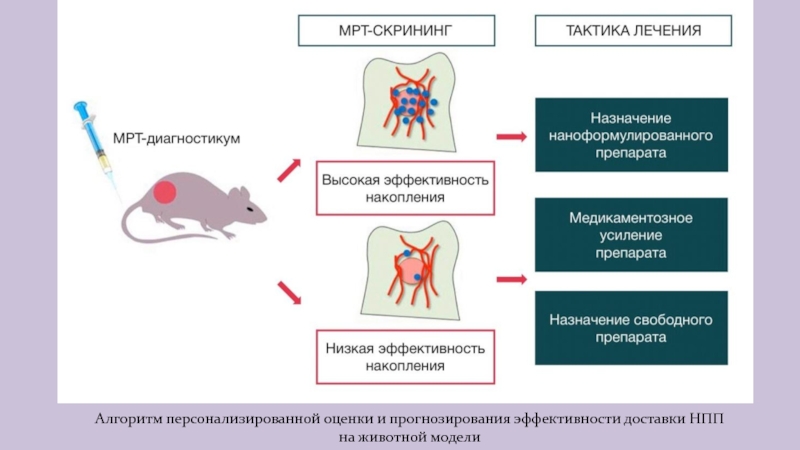
Слайд 30Алгоритм персонализированной оценки и прогнозирования эффективности доставки НПП
на животной модели
Слайд 31Необходимость индивидуального прогноза
С точки зрения эффективности лечения, НПП следует назначать
тогда, когда EPR-эффект (повышенная проницаемость кровеносных сосудов и сниженный лимфатический
дренаж) обеспечивает аккумуляцию необходимой концентрации действующего вещества в опухоли.
Доставка в опухоль может быть улучшена путем:
повышения артериального давления при введении ангиотензина II или коллагеназа-опосредованного разрушения опухолевого матрикса
использования НЧ с адресной доставкой
С фармаэкономической точки зрения, при одинаковой эффективности противоопухолевого препарата в наноформуляции и без нее предпочтение должно отдаваться последнему, так как его себестоимость на несколько порядков ниже (например, стоимость 20 мг доксорубицина составляет 540 р., доксила — 42 300 р.).
Слайд 32Исследования прогностических факторов эффективности доставки противоопухолевых препаратов
На сегодняшний день
в мировой практике отсутствуют клинические алгоритмы индивидуальной оценки EPR- эффекта
и связанной с ним эффективности применения НПП. Однако в последние годы за рубежом запущены доклинические и клинические испытания, направленные на решение указанной проблемы. Далее будут разобраны некоторые из них.
Слайд 33Возможность использования магнитных частиц (ферумокситола) для определения эффективности лечения противоопухолевыми
нанопрепаратами
В 2017 г. вышли первые результаты клинического исследования, в котором
для оценки эффективности наноформулированного иринотекана у 13 пациентов с солидными опухолями использовали МРТ-данные о доставке в опухоль МНЧ (ферумокситола).
Было показано, что высокие уровни накопления ферумокситола через 1–24 ч после введения коррелировали с уменьшением опухолевых очагов на фоне терапии.
Недостаток - значительная разница в физических свойствах диагностических и терапевтических НЧ (в частности, их размер составлял 23 нм и 110 нм соответственно).
Проведение интравитальной микроскопии (ИВМ) для оценки фармакокинетики ферумокситола и PGLA-ПЭГ показало различия в скорости и локусах накопления двух типов НЧ с различным размером.
Слайд 34Корреляция между накоплением в опухоли меченых ПЭГ-модифицированных липосом и эффективностью
терапии
В исследовании оценивали корреляцию между накоплением в опухоли 64Cu-меченых
HER2- направленных ПЭГ-модифицированных липосом, содержащих доксорубицин, и эффективностью терапии у 19 пациентов с HER2-позитивным метастатическим раком молочной железы.
Детекцию радиоактивно меченных НЧ проводили методом позитронно-эмиссионной и компьютерной томографии. Высокий уровень накопления меченых частиц коррелировал с положительным ответом на терапию.
Но изначально данное исследование было направлено на оценку эффективности лечения рака молочной железы липосомным доксорубицином с трастузумабом в сочетании с циклофосфамидом.
В связи с этим представляется затруднительной интерпретация вклада сопутствующих факторов в результаты эксперимента. Кроме того, объективно оценить применимость подхода не позволяло испытание лишь одной опухолевой модели.
Слайд 35Эффективность использования наноформуляций доксорубицина, меченных радиоактивным технецием
На животной модели
была показана корреляция интенсивности сигнала в опухоли по данным однофотонной
эмиссионной КТ с накоплением препарата в экстрагированных опухолях. Эффективность данного подхода нашла подтверждение в клиническом испытании, где (99m)Tc-меченый липосомный доксорубицин вводили 35 пациентам с мезотелиомой.
Накопление препарата в опухоли коррелировало с ответом на лечение. Однако технические сложности, связанные с использованием радиоактивных материалов, а также отсутствие необходимого оснащения в большинстве лечебно-профилактических учреждений ограничивают трансляционный потенциал данного подхода.
Слайд 36Проблемы и перспективы использования МРТ
в прогностических алгоритмах
противоопухолевой терапии
Концептуальные проблемы и технические ограничения, стоящие на пути создания технологии
персонализированной оценки и прогнозирования эффективности доставки НПП:
в качестве диагностических и терапевтических препаратов используют НЧ различной природы;
не исследована возможность того, что введение первой (диагностической) дозы наноформуляции может оказывать влияние на введение второй (терапевтической) дозы;
не исследованы временные изменения EPR-эффекта в одной и той же опухоли, что может определять различия в накоплении первой и второй дозы НЧ;
в большинстве случаев исследования выполнены ретроспективно на небольшой выборке с использованием одного типа опухоли;
исследования не связаны с прямой оценкой EPR- эффекта, а потому не позволяют исключить влияние сопутствующих факторов (например, сопутствующей противоопухолевой терапии).
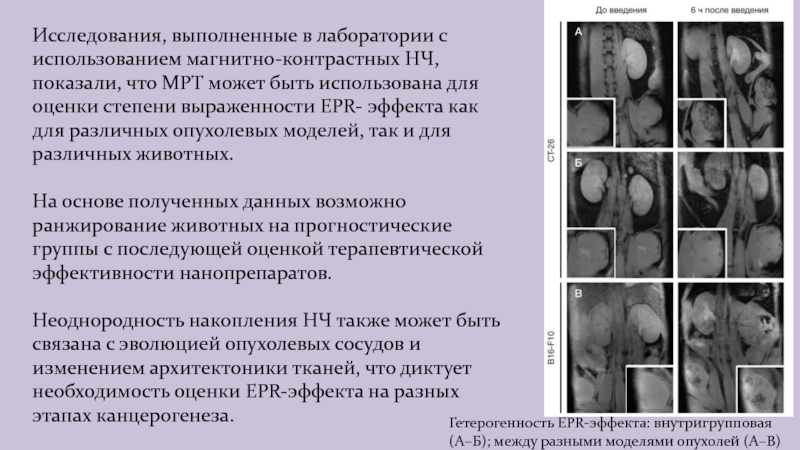
Слайд 37Гетерогенность EPR-эффекта: внутригрупповая (А–Б); между разными моделями опухолей (А–В)
Исследования,
выполненные в лаборатории с использованием магнитно-контрастных НЧ, показали, что МРТ
может быть использована для оценки степени выраженности EPR- эффекта как для различных опухолевых моделей, так и для различных животных.
На основе полученных данных возможно ранжирование животных на прогностические группы с последующей оценкой терапевтической эффективности нанопрепаратов.
Неоднородность накопления НЧ также может быть связана с эволюцией опухолевых сосудов и изменением архитектоники тканей, что диктует необходимость оценки EPR-эффекта на разных этапах канцерогенеза.
Слайд 38Выводы
Концепция использования неинвазивных методов и МНЧ для создания индивидуальных терапевтических
алгоритмов в онкологии представляется перспективной и реалистичной.
Использование современных методов
исследования механизмов, определяющих степень накопления НЧ в опухоли, а также валидация МРТ как скринингового метода на животных моделях послужат основой для последующего внедрения в клиническую практику технологии персонализированной оценки и прогнозирования эффективности доставки НПП.
Слайд 39Литература
1)Вестник РГМУ (Научный медицинский журнал РНИМУ им. Н.И.
Пирогова, Ноябрь-Декабрь 2018/06
Адресная доставка лекарственных нанопрепаратов в применении к моделям
рака на доклиническом этапе исследований
С. Марчио, Ф. Буссолино
Магнитно-резонансная томография для персонализированной оценки и прогнозирования эффективности доставки наноформуляций противоопухолевых препаратов
В.А. Науменко, А.С. Гаранина, С.С. Водопьянов, А.А. Никитин, А.О. Преловская, Е.И. Демихов, М.А. Абакумов, А.Г. Мажуга, В.П. Чехонин
2)Овчинников П.Е., Межелевская Т.А. Нанопрепараты в лечении злокачественных новообразований// https://nauchforum.ru/archive/MNF_nature/8(26)