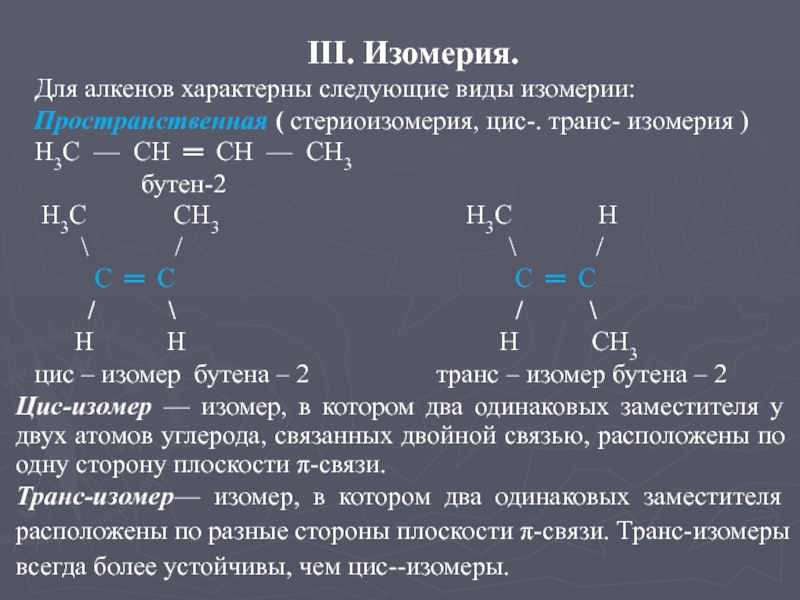
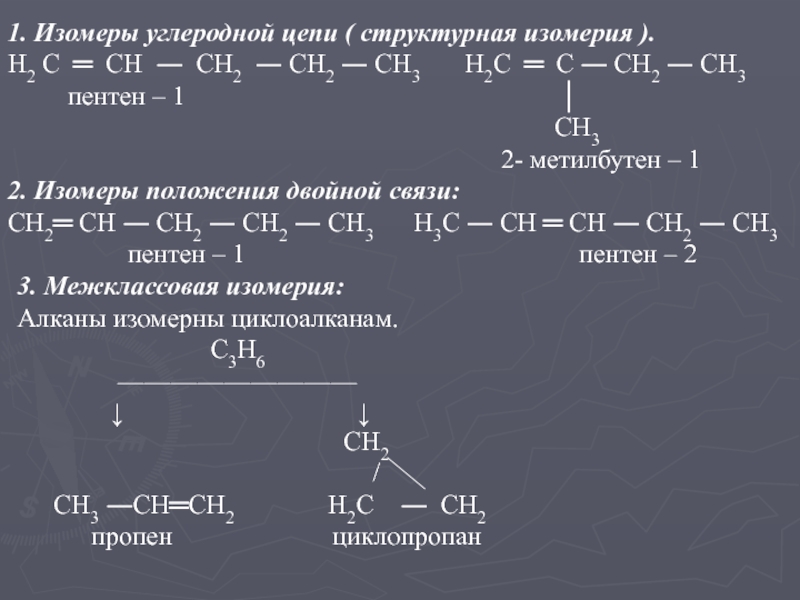
имеют одну двойную связь.
Общая формула: CnH2n.
Атомы углерода находятся в состоянии sp2 – гибридизации, валентный угол равен 120˚.
Длина двойной связи 0,133 нм. Двойная связь состоит из π и δ связей.
Энергия = 606 кДж/моль ( энергия π-связи 259 кДж/моль, δ-связи 347 кДж/ моль ).
Суффикс, характерный для алкенов, ен.