Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
АЛКИНЫ
Содержание
- 1. АЛКИНЫ
- 2. Цель урока: Продолжить формирование представлений учащихся
- 3. Задачи: Обучающие:- обобщение и систематизация знаний по теме «Алкины»;-
- 4. Сегодня на уроке вы узнаете:Понятие о непредельных
- 5. Понятие об алкинахАлкины – углеводороды, содержащие в
- 6. Характеристика тройной связиВид гибридизации –
- 7. Схема образования sp -гибридных орбиталей
- 8. Схема образования sp -гибридных орбиталей
- 9. Номенклатура алкинов. (Согласно международной номенклатуре названия
- 10. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12Этин ПропинБутинПентинГексинГептин
- 11. Изомерия алкиновСтруктурная изомерия1. Изомерия положения тройной связи
- 12. Выполните упражнение:Назовите вещество.Составьте к нему три изомера разных видов изомерии. Назовите изомеры.
- 13. Физические свойстваТемпературы кипения и плавления алкинов, так
- 14. Ацетилен получают в промышленности двумя способами:1. Термический
- 15. Химические свойства алкиновХимические свойства ацетилена и его
- 16. Реакции присоединения1. Галогенирование Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды
- 17. 2. Гидрогалогенирование.3. Гидрирование.4. Гидратация.
- 18. ОкислениеАцетилен и его гомологи окисляются перманганатом калия
- 19. Горение ацетиленаПри сгорании (полном окислении) ацетилена выделяется
- 20. Реакции замещенияПри взаимодействии ацетилена (или RCCH) с
- 21. Реакция полимеризации1. Димеризация под действием водного раствора
- 22. Применение алкинов
- 23. Домашнее задание
- 24. СПАСИБОЗАРАБОТУ.
- 25. Скачать презентанцию
Цель урока: Продолжить формирование представлений учащихся об изомерии и номенклатуре органических веществ, умений составлять структурные формулы веществ, давать им названия на примере алкинов, изучить химические свойства и способы получения алкинов,
Слайды и текст этой презентации
Слайд 2Цель урока: Продолжить формирование представлений учащихся об изомерии и номенклатуре органических
Слайд 3Задачи:
Обучающие:- обобщение и систематизация знаний по теме «Алкины»;- выявление уровня усвоения
основных понятий, правил; проверка умений решать задачи на вывод МФ (молекулярной формулы)
органических веществ.Развивающие: - развивать умение рационально планировать свою деятельность, продолжить формирование умений применять приемы сравнения, систематизации, составления уравнений химических реакций;- развивать монологическую речь.
Воспитательные:- воспитывать у студентов интерес к учению;- стремление добиваться успехов в учебе за счет добросовестного отношения к своему труду.
Слайд 4Сегодня на уроке вы узнаете:
Понятие о непредельных углеводородах.
Характеристика тройной связи.
Изомерия
и номенклатура алкинов.
Физические свойства.
Получение алкинов.
Свойства алкинов.
Применение алкинов.
Слайд 5Понятие об алкинах
Алкины – углеводороды, содержащие в молекуле одну тройную
связь между атомами углерода, а качественный и количественный состав выражается
общей формулойСnН2n - 2, где n ≥ 2.
Алкины относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
Слайд 6Характеристика
тройной связи
Вид гибридизации – sp
Валентный
угол – 180
Длина связи
С = С – 0,12 нмСтроение ─ линейное
Вид связи – ковалентная полярная
По типу перекрывания – δ и 2 π
Слайд 9 Номенклатура алкинов.
(Согласно международной номенклатуре названия
ацетиленовых углеводородов производят от
соответствующего алкана с заменой
суффикса –ан на –ин.)
Слайд 10Гомологический
ряд алкинов
C2H2
C3H4
C4H6
C5H8
C6H10
C7H12
Этин
Пропин
Бутин
Пентин
Гексин
Гептин
Слайд 11Изомерия алкинов
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С4Н6):
СН
ССН2СН3
СН3СССН3бутин-1 бутин-2
2. Изомерия углеродного скелета (начиная с С5Н8):
СН ССН2СН2СН3 СН ССНСН3
СН3
пентин-1 3-метилбутин-1
3. Межклассовая изомерия с алкадиенами и циклоалкенами, (начиная с С4Н8):
СН = СН
СН С–СН2–СН3 СН2=СН–СН=СН2
СН2 –СН2
бутин-1 бутадиен-1,3 циклобутен
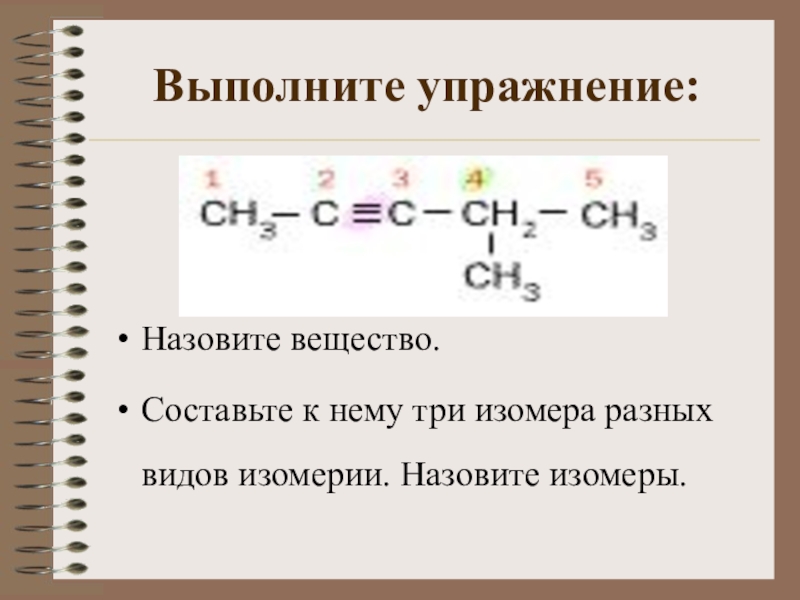
Слайд 12Выполните упражнение:
Назовите вещество.
Составьте к нему три изомера разных видов изомерии.
Назовите изомеры.
Слайд 13Физические свойства
Температуры кипения и плавления алкинов, так же как и
алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический
запах. Они лучше растворяются в воде, чем алканы и алкены.Слайд 14Ацетилен получают в промышленности двумя способами:
1. Термический крекинг метана:
1500С
2СН4 С2Н2 + 3Н2
2. Гидролиз карбида кальция:
CaC2 + 2H2O C2H2 + Ca(OH)2
Получение алкинов
Слайд 15Химические свойства алкинов
Химические свойства ацетилена и его гомологов в основном
определяются наличием в их молекулах тройной связи. Наиболее характерны для
алкинов реакции присоединения.Слайд 16Реакции присоединения
1. Галогенирование
Обесцвечивание бромной воды является качественной реакцией
на все непредельные углеводороды
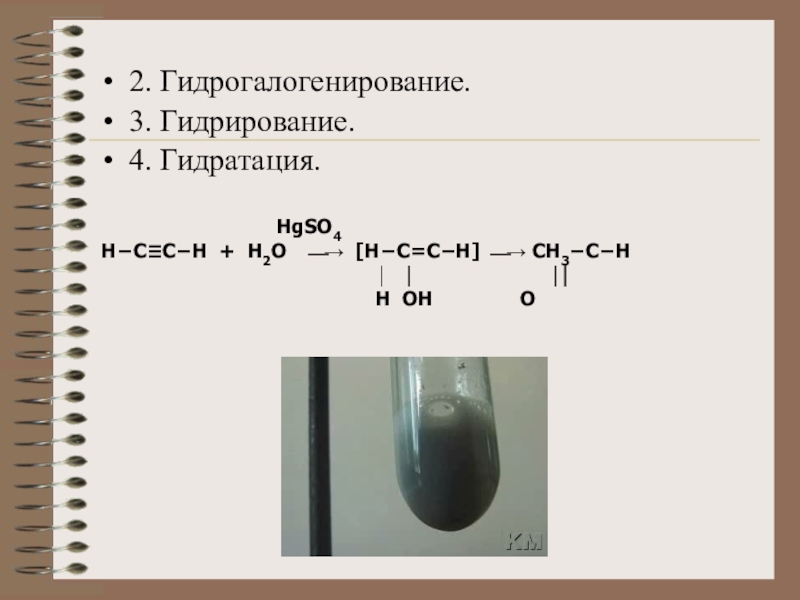
Слайд 172. Гидрогалогенирование.
3. Гидрирование.
4. Гидратация.
HgSO4
НCCH +
H2O [HC=CH] CH3CH
H OH O
Слайд 18Окисление
Ацетилен и его гомологи окисляются перманганатом калия с
расщеплением тройной связи
и образованием карбоновых кислот:
RCCR’ + 3[O] + H2O RCOOH
+ R’COOHАлкины обесцвечивают раствор KMnO4, что используется
для их качественного определения.
Слайд 19Горение ацетилена
При сгорании (полном окислении) ацетилена выделяется большое количества тепла:
HCCH
+ 2О2 2СО2 + Н2О + Q
Слайд 20Реакции замещения
При взаимодействии ацетилена (или RCCH) с аммиачными
растворами оксида серебра
выпадают осадки нерастворимых ацетиленидов:
HCCH + 2[Ag(NH3)2]OH AgCCAg +
4NH3 + 2H2O Качественная реакция на
концевую тройную связь
Слайд 21Реакция полимеризации
1. Димеризация под действием водного раствора CuCl и NH4Cl:
НCCH + НCCH Н2C=CHCCH
(винилацетилен)2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
С, 600 С
3НCCH С6H6 (бензол)















![АЛКИНЫ ОкислениеАцетилен и его гомологи окисляются перманганатом калия срасщеплением тройной связи и ОкислениеАцетилен и его гомологи окисляются перманганатом калия срасщеплением тройной связи и образованием карбоновых кислот:RCCR’ + 3[O] +](/img/tmb/7/634192/bc09bc2dc5bda314f88e20c1a3960d25-800x.jpg)

![АЛКИНЫ Реакции замещенияПри взаимодействии ацетилена (или RCCH) с аммиачнымирастворами оксида серебра выпадают Реакции замещенияПри взаимодействии ацетилена (или RCCH) с аммиачнымирастворами оксида серебра выпадают осадки нерастворимых ацетиленидов:HCCH + 2[Ag(NH3)2]OH ](/img/tmb/7/634192/410da1f0363771d93153bf34dcf83910-800x.jpg)






















