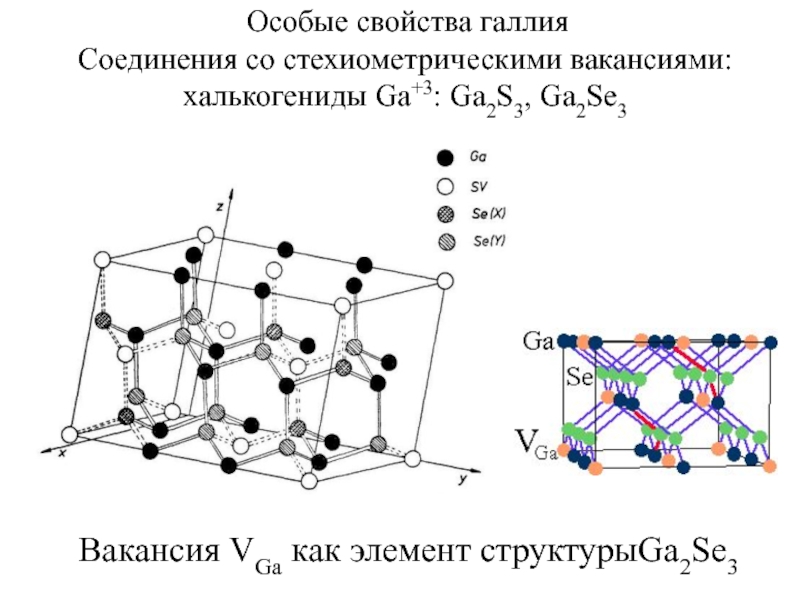
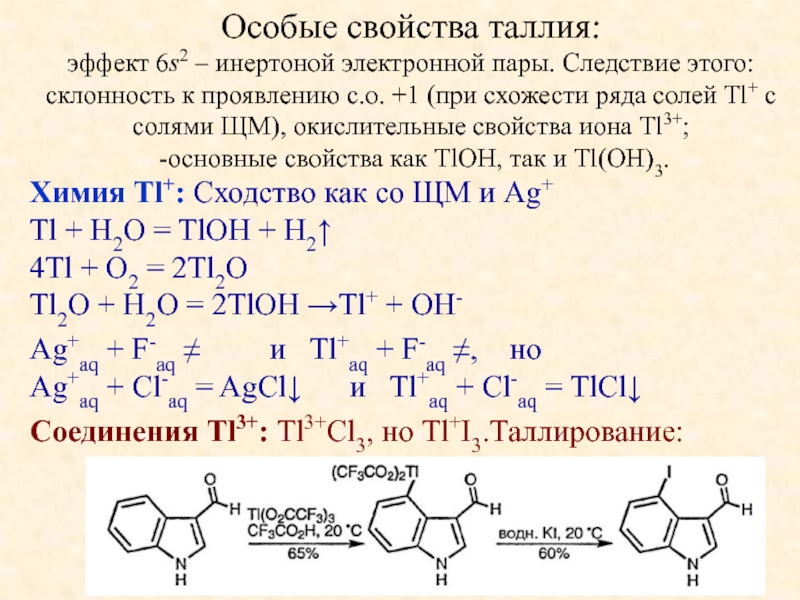
веществ.
- Устойчивость только двух С.О.: +3 и +1. Устойчивость С.О.=+3
убывает – в пользу С.О.=+1 убывает от Al к Tl и убывает при повышении температуры. Например,2Al + 3I2 = AlI3 (горение, ~700С)
Но T,C
2Al распл. + AlI3 газ = 3 AlI газ
От Al к In и, далее, к In С.О = +1 достигается при меньших T и для Tl равновесие (1) почти необратимо
Tl + Cl2 = 2TlCl
и
TlCl + Cl2 = TlCl3 – только при избытке хлора