Слайд 1Атомно-молекулярное учение
Лекция 1
Слайд 2Основные понятия химии
Атом –это электронейтральная микросистема, состоящая из положительно заряженного
ядра и электронов.
Химический элемент – это совокупность атомов с одинаковым
зарядом ядра.
Изотопы – это атомы одного элемента, ядра которых содержат разное число нейтронов.
Молекула – наименьшая частица вещества, определяющая его свойства.
Слайд 3Основные понятия химии
Простое вещество – это вещество, состоящие из атомов
одного элемента.
Аллотропия – способность атомов одного элемента образовывать одно или
несколько простых веществ.
Сложное вещество - это вещество, состоящие из атомов нескольких элементов.
Моль – это количество вещества, содержащее 6,02·1023 структурных единиц (молекул, атомов, ионов и т.д.)
Слайд 4Основные понятия химии
Валентность – это способность атома данного элемента присоединять
к себе определённое число атомов других элементов.
Различают стехиометрическую, структурную (координационное
число) и электронную валентность.
Слайд 5Стехиометрическая валентность
Стехиометрическая валентность (Встех.) определяется по элементному составу вещества.
Встех.
- это число взаимодействий атома элемента с атомами других элементов
(в формульной единице вещества), когда в качестве единицы измерения принято взаимодействие атома водорода.
Например: Н2О Встех.(О) = 2
Н2О2 Встех.(О) = 1
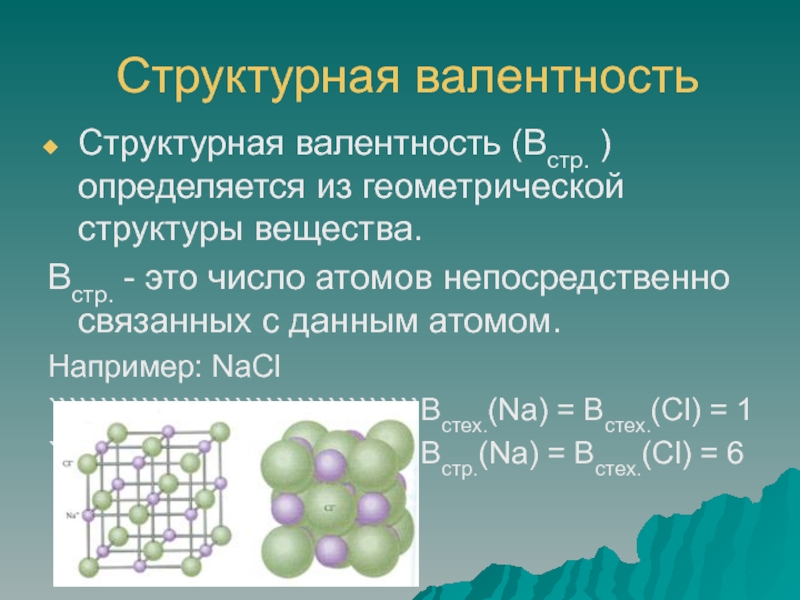
Слайд 6Структурная валентность
Структурная валентность (Встр. ) определяется из геометрической структуры вещества.
Встр.
- это число атомов непосредственно связанных с данным атомом.
Например: NaCl
````````````````````````````````````Встех.(Na)
= Встех.(Cl) = 1
````````````````````````````````````Встр.(Na) = Встех.(Cl) = 6
Слайд 7Электронная валентность
Электронная валентность (Вэл.) определяется из электронного строения молекулы.
Вэл. -
это число электронных пар, участвующих в образовании химических связей.
Например: СО
Встех.(С) = Встех.(О) = 2
Число связей в молекуле: СΞО
Вэл.(С) = Вэл.(О) = 3
Слайд 8Эквивалент
Эквивалент – это реальная или условная частица вещества, которая в
данной кислотно-основной реакции способна присоединять или вытеснять 1 катион водорода
(Н+), а в окислительно-восстановительной реакции отдавать или принимать 1 электрон.
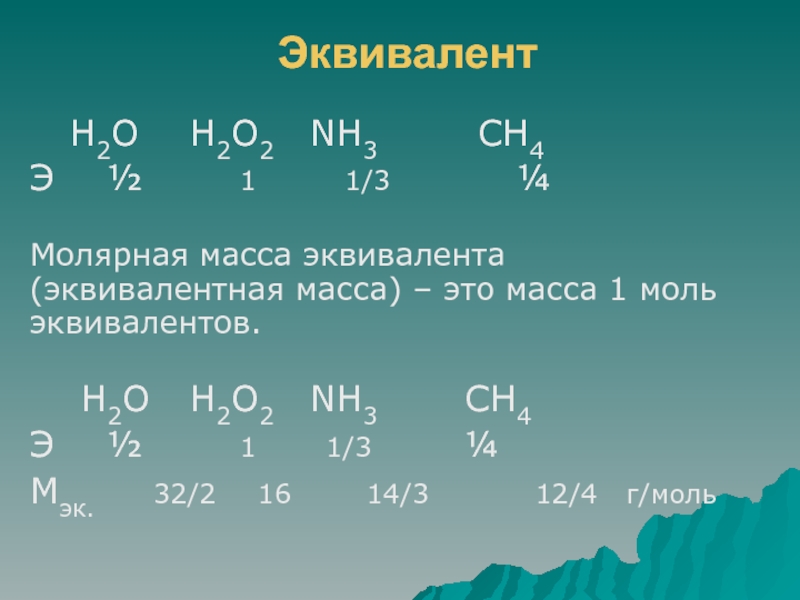
Слайд 9Эквивалент
H2O H2O2 NH3 CH4
Э ½
1 1/3 ¼
Молярная масса эквивалента
(эквивалентная масса) – это масса 1 моль эквивалентов.
H2O H2O2 NH3 CH4
Э ½ 1 1/3 ¼
Мэк. 32/2 16 14/3 12/4 г/моль
Слайд 10Расчет эквивалентных масс
Мэк.(элемента) = А/Встех
Мэк.(кислоты) = М/n(H+),
где n(H+) –
число замещённых катионов H+
Мэк.(основания) = М/n(ОH-), где
n(ОH-) – число
замещённых ОH--групп
Мэк.(соли, оксида) = М/∑Встех.,
где ∑Встех– число атомов элемента в формуле умноженное на валентность.
Слайд 11Основные законы химии
Различают
фундаментальные и
частные (стехиометрические законы).
Слайд 12Фундаментальные законы
Закон сохранения массы – энергии:
в изолированной системе сумма
масс и энергий постоянна:
Е = mс2.
Н2(г) + 1/2О2 =
Н2О + 241 кДж
m = Е/с2 = 241000/91016 = 2,710-12 кг
Закон сохранения заряда
Периодический закон
Слайд 13Стехиометрические законы
Закон эквивалентов (1792 -1794 г., Рихтер):
массы реагирующих без
остатка веществ относятся друг к другу как их эквивалентные массы.
Слайд 14Стехиометрические законы
Закон постоянства состава (1801 -1808 г., Пруст):
любое химически
чистое соединение, не зависимо от способа его получения, имеет один
и тот же постоянный состав.
Дальтониды – соединения постоянного состава.
Бертоллиды – соединения переменного состава.
Слайд 15Стехиометрические законы
Закон Авогадро (1811 г.)
в равных объёмах различных
газов при одинаковых условиях содержится одинаковое число структурных единиц (молекул,
атомов, ионов …).
Слайд 16Стехиометрические законы
1 моль любого газа при н.у. содержит 6,02·1023
структурных единиц.
NА = 6,02·1023 моль-1.
1 моль любого газа при н.у.
занимает объём 22,4 л.
Vm = 22,4 л/моль.
Отношение молярных масс двух газов при одинаковых условиях есть величина постоянная, называемая относительной плотность одного газа по другому:
М1/М2 = D
Слайд 17Стехиометрические законы
Закон удельных теплоёмкостей (1829 г, Дюлонг, Пти):
произведение удельной
теплоёмкости (суд.) простого вещества в твёрдом состоянии на его атомную
массу (А) является величиной приблизительно постоянной равной 26 Дж/К·моль.
Суд.·А ≈ 26 Дж/К·моль.
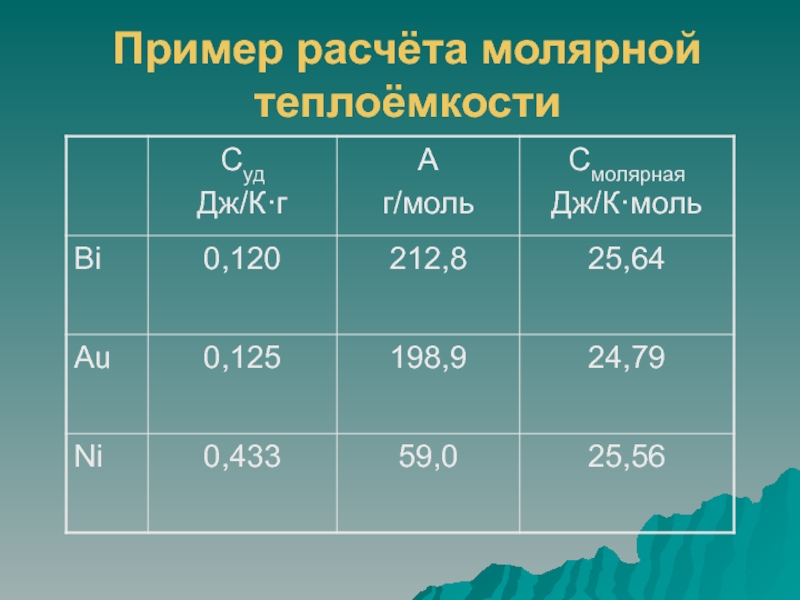
Слайд 18Пример расчёта молярной теплоёмкости
Слайд 19Уравнение Клапейрона-Менделеева
PV = nRT
где: Р – давление, Па;
V –
объём, м3;
n – количество вещества, моль;
R - универсальная газовая постоянная,
равная 8,31 Дж/К·моль;
Т – температура, К.