Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
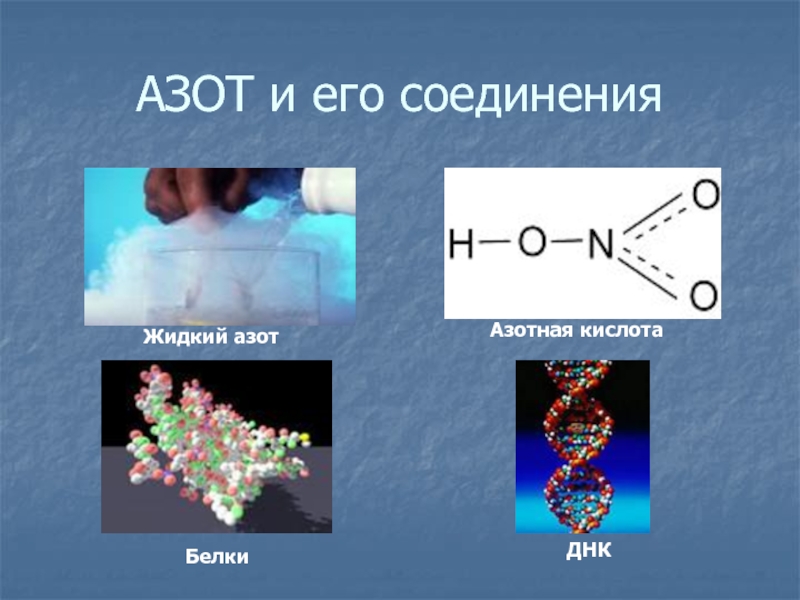
АЗОТ и его соединения
Содержание
- 1. АЗОТ и его соединения
- 2. Строение молекулы азотаКНСТройная связь:σ+2πЕ связи = 1000 кДж/мольSp – гибридизацияЛинейная геометрия
- 3. Химические свойства азотаАзот – окислитель с металлами
- 4. Способы получения азотаВ промышленности – испарение сжиженного
- 5. Аммиак: физические свойстваNH3 – бесцветный газ с
- 6. Способы получения аммиакаВ промышленности – процесс ГабераN2
- 7. Строение молекулы аммиакаКПСSp3 – гибридизация атома азотаТригонально-пирамидальная структура молекулыНеподелённая пара е- у атома азота Донорные свойства
- 8. Химические свойства аммиакаВосстановительные:Горение:2NH3 + 3O2 → N2
- 9. Применение аммиакаАммиачная селитраКраскидля волосПроизводствоазотной кислотыСредства для чистки стёкол
- 10. Оксид азота (Ι) «веселящий газ»Получение:NH4NO3 → N2O
- 11. Оксид азота (ΙΙ)Получение:4NH3 + 5O2 → 4NО
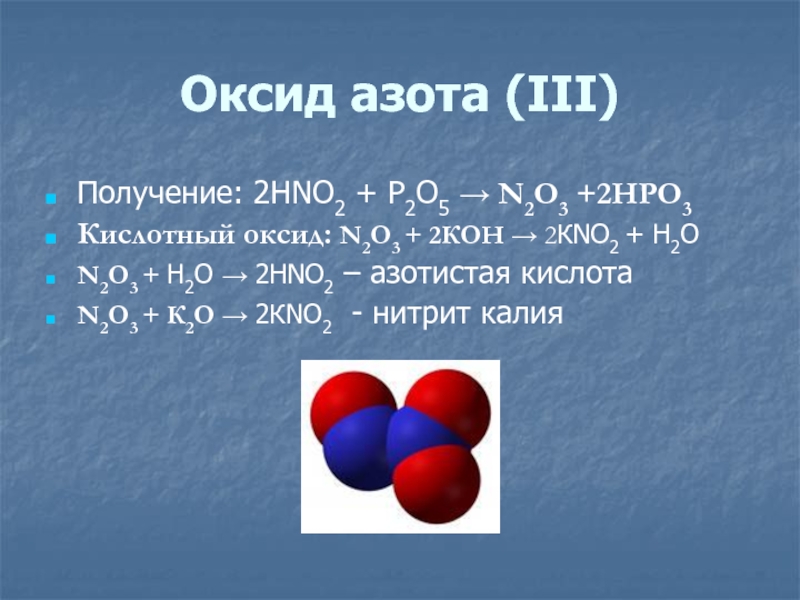
- 12. Оксид азота (ΙΙΙ)Получение: 2HNO2 + P2O5 →
- 13. Оксид азота (ΙV)Бурый газ с удушливым запахом,Ядовит,
- 14. Оксид азота (V)Получение: 2HNO3 + P2O5 →
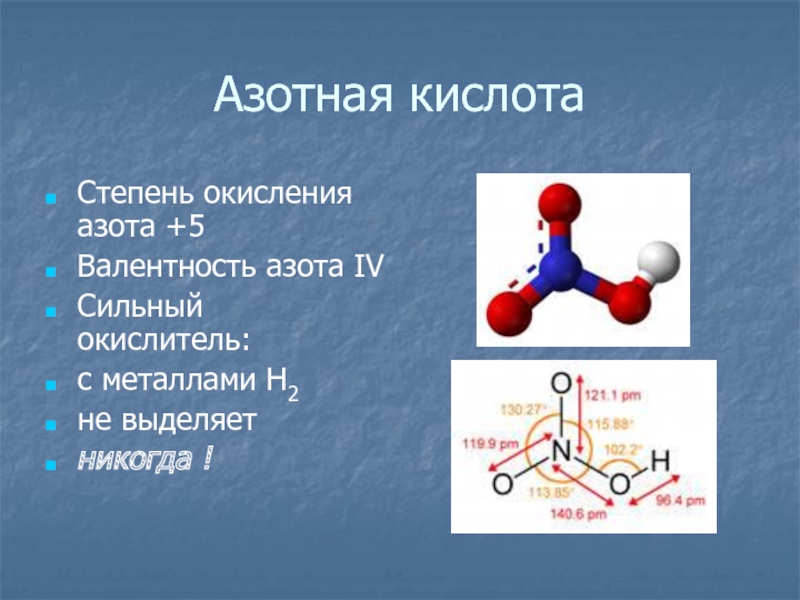
- 15. Азотная кислотаСтепень окисления азота +5Валентность азота ΙVСильный окислитель:с металлами Н2не выделяетникогда !
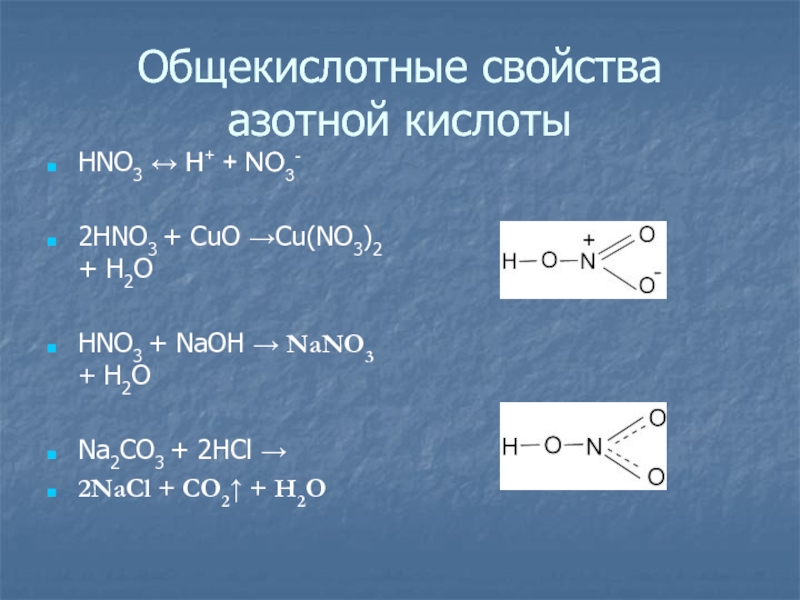
- 16. Общекислотные свойства азотной кислотыHNO3 ↔ H+ +
- 17. Окислительные свойства азотной кислотыКонцентрированнойw > 50%Cu +
- 18. Окислительные свойства азотной кислотыРАЗБАВЛЕННОЙ3Cu + 8HNO3→3Cu(NO3)2+2NO↑ +
- 19. Применение азотной кислоты
- 20. Скачать презентанцию
Строение молекулы азотаКНСТройная связь:σ+2πЕ связи = 1000 кДж/мольSp – гибридизацияЛинейная геометрия
Слайды и текст этой презентации
Слайд 2Строение молекулы азота
КНС
Тройная связь:
σ+2π
Е связи = 1000 кДж/моль
Sp – гибридизация
Линейная
геометрия
Слайд 3Химические свойства азота
Азот – окислитель с металлами и водородом:
N2 +
6 Li → 2 Li3N – нитрид лития
N2 +
3Н2 → 2NH3 – аммиакАзот – восстановитель с кислородом:
N2 + О2 → 2NO – монооксид азота
Слайд 4Способы получения азота
В промышленности – испарение сжиженного воздуха
(первым улетучивается азот)
В
лаборатории – нагревание нитрита аммония:
NH4NO2 -t→ N2 + 2H2O
Слайд 5Аммиак: физические свойства
NH3 – бесцветный газ с резким запахом, легче
воздуха
Dвозд.(NH3) =17/29
Хорошо растворим в воде:
800 V NH3 - 1 V
H2OПДК 0,2мг/м3
Сосудорасширяющее действие
При превышении ПДК – токсический отёк лёгких
Слайд 6Способы получения аммиака
В промышленности – процесс Габера
N2 + 3H2 ↔
2NH3
5000, 350 атм,
kT – Fe
Удаление продукта из сферы реакции
В
лаборатории –1) (NH4)2SO4 + Ca(OH)2 → CaSO4 + 2NH3↑ + 2H2O
2) Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3↑
3) NH4Cl →NH3 + HCl
4) 4Ca + 9HNO3 (разб) → NH3 ↑ + 4Сa(NO3)2 + 3H2O
Фриц Габер
немецкий химик
Слайд 7Строение молекулы аммиака
КПС
Sp3 – гибридизация атома азота
Тригонально-пирамидальная структура молекулы
Неподелённая пара
е- у атома азота
Донорные свойства
Слайд 8Химические свойства аммиака
Восстановительные:
Горение:
2NH3 + 3O2 → N2 + 3H2O
Каталитическое окисление:
4NH3
+ 5O2 → 4NО + 6H2O (kt – Pt)
Восстанавливает металлы
из оксидов:2NH3 + 3CuO → N2 + 3H2O+3Cu
Реагирует с окислителями:
2NH3 + 3Br2→ N2 +6HBr
Основные:
NH3 + HOH ↔NH4OH –гидроксид аммония – нашатырный спирт
NH3 + HCl↔NH4Cl
Кислотные (жидкий аммиак):
2NH3 + 2Na↔2NaNH2 + H2 – амид натрия
Комплексообразование:
Cu(OH)2 +4 NH3→
Cu(NH3)4 (OH)2 – гидроксид тетраамминомеди (ΙΙ)
Слайд 9Применение аммиака
Аммиачная селитра
Краски
для волос
Производство
азотной кислоты
Средства
для чистки стёкол
Слайд 10Оксид азота (Ι)
«веселящий газ»
Получение:
NH4NO3 → N2O + 2H2O (до 1400)
Свойства:
Термически
неустойчив:
2N2O →2N2 + О2
Тлеющая лучинка вспыхивает, как в кислороде
Слабый окислитель:
N2O
+ Н2 → N2 + Н2ОБезразличный оксид
Слайд 11Оксид азота (ΙΙ)
Получение:
4NH3 + 5O2 → 4NО + 6H2O (kt
– Pt)
Бесцветный газ, на воздухе «буреет» вследствие окисления:
2NО + О2
→ 2N О2Безразличный
(несолеобразующий)
оксид
Слайд 12Оксид азота (ΙΙΙ)
Получение: 2HNO2 + P2O5 → N2O3 +2HPO3
Кислотный оксид:
N2O3 + 2КОН → 2КNO2 + Н2О
N2O3 + Н2О →
2HNO2 – азотистая кислотаN2O3 + К2О → 2КNO2 - нитрит калия
Слайд 13Оксид азота (ΙV)
Бурый газ с удушливым запахом,
Ядовит, тяжелее воздуха, хорошо
растворим в воде
Сильный окислитель:
NO2 + C → NO + CO
Окисляется
очень сильными окислителями:2 NO2 +O3 → N2O5 + O2
Кислотный оксид, но соответствующей кислоты не имеет:
2 NO2 + 2 Н2О → HNO2 + HNO3
2 NO2 + 2 КОН → КNO2 + КNO3
+ Н2О
4 NO2 + 4 КОН +О2 → 4 КNO3 + 2Н2О
Слайд 14Оксид азота (V)
Получение: 2HNO3 + P2O5 → N2O5 +2HPO3
Голубоватые кристаллы
Кислотный
оксид: N2O5 + 2КОН → 2КNO3+ Н2О
N2O5 + Н2О →
2HNO3 – азотная кислотаN2O5 + К2О → 2КNO3 - нитрат калия
Слайд 15Азотная кислота
Степень окисления азота +5
Валентность азота ΙV
Сильный окислитель:
с металлами Н2
не
выделяет
никогда !
Слайд 16Общекислотные свойства
азотной кислоты
HNO3 ↔ H+ + NO3-
2HNO3 + CuO →Cu(NO3)2
+ H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + 2HCl
→2NaCl + CO2↑ + H2O
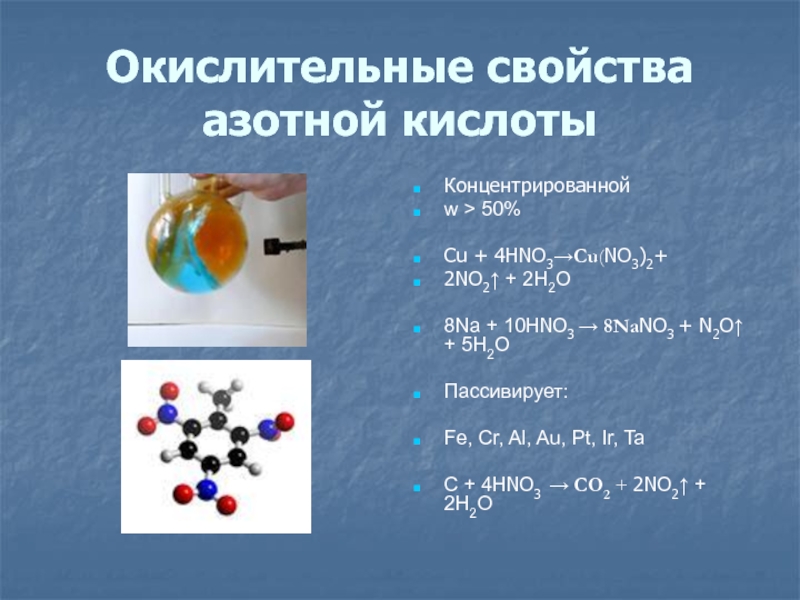
Слайд 17Окислительные свойства
азотной кислоты
Концентрированной
w > 50%
Cu + 4HNO3→Cu(NO3)2+
2NO2↑ + 2H2O
8Na +
10HNO3 → 8NaNO3 + N2O↑ + 5H2O
Пассивирует:
Fe, Cr, Al, Au,
Pt, Ir, TaС + 4HNO3 → СO2 + 2NO2↑ + 2H2O