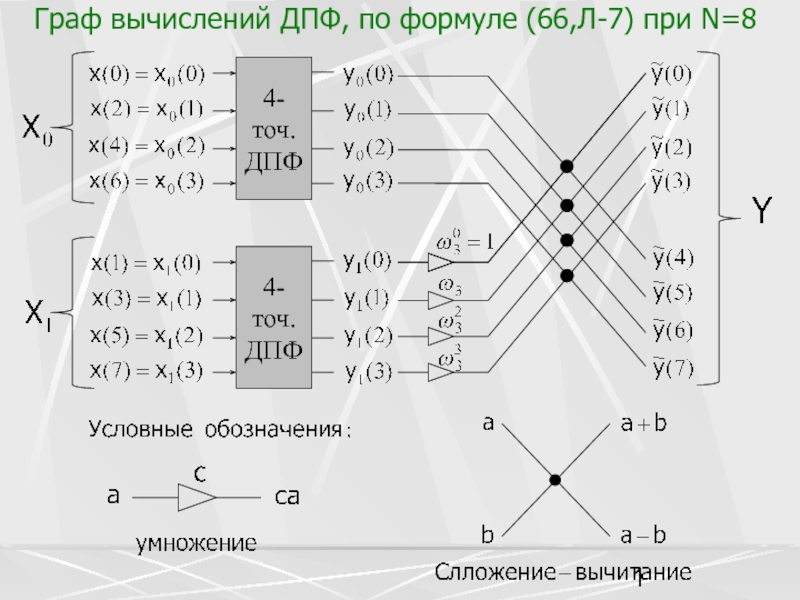
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Балтийский федеральный университет им. И. Канта Институт живых систем ХИМИЯ
Содержание
- 1. Балтийский федеральный университет им. И. Канта Институт живых систем ХИМИЯ
- 2. ПЛАН ЛЕКЦИИ Химия элементов VI-группы. 1.
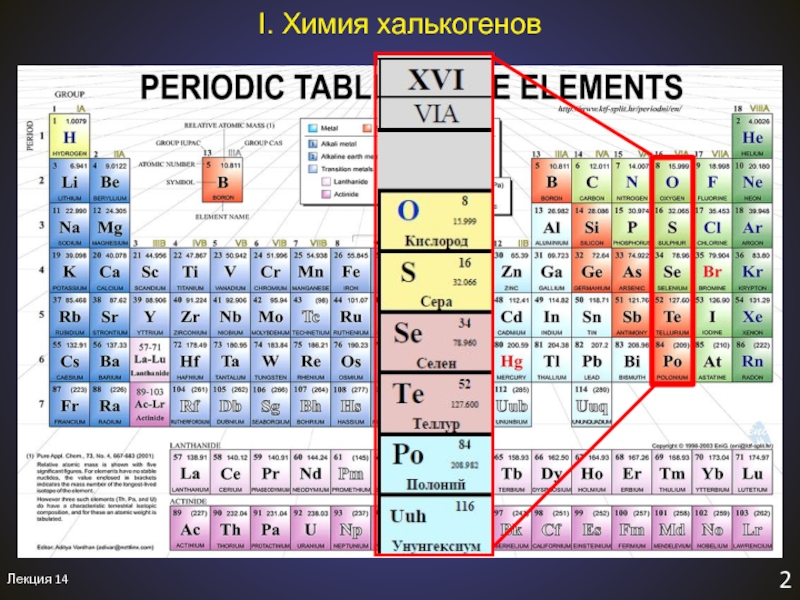
- 3. ЛиверморийPolonium - ПольшаХалькогены – «рождающие руду»χαλκος -
- 4. Лекция 143I. Халькогены. Общая характеристика1. Общая характеристика
- 5. Лекция 144II. Химия халькогенов. Общая характеристика1.1. Строение
- 6. Лекция 1451.2. Физико-химические свойства простых веществII. Химия
- 7. Лекция 1461.2. Физико-химические свойства простых веществII. Химия
- 8. Лекция 147Полиморфизм – явление существования одного соединенияв
- 9. Лекция 1481.2. Физико-химические свойства простых веществII. Химия
- 10. Лекция 1491.2. Физико-химические свойства простых веществII. Химия
- 11. Лекция 1410II. Химия халькогенов. Общая характеристика1.3. Химические
- 12. Лекция 311В). Кислотные свойства растворов халькогеноводородов (S,
- 13. 2 период: очень маленький размер атомов, отсутствие
- 14. Лекция 3131.4. Различия в химических свойствах халькогеновII.
- 15. Лекция 14141.4. Различия в химических свойствах халькогеновII.
- 16. Лекция 14151.5. Химические свойства простых веществII. Химия
- 17. Лекция 14161.6. Нахождение в природеII. Химия халькогенов.
- 18. Лекция 14171.6. Нахождение в природеII. Химия халькогенов.
- 19. Лекция 14181.6. Нахождение в природеII. Химия халькогенов.
- 20. Лекция 14191.6. ПолучениеII. Химия халькогенов. Общая характеристика
- 21. Лекция 1420O3: впервые получен Шёнбейном в 1840
- 22. Лекция 14211.6. ПолучениеII. Химия халькогенов. Общая характеристикаS8
- 23. Лекция 14221.6. ПолучениеII. Химия халькогенов. Общая характеристикаSe:
- 24. Получение SeЛекция 1
- 25. Получение TeЛекция 1
- 26. Получение Se и TeЛекция 1
- 27. Лекция 3231.6. ПолучениеII. Химия халькогенов. Общая характеристикаPo:
- 28. Лекция 14241.7. ПрименениеII. Химия галогенов. Общая характеристикаO:
- 29. Лекция 1425II. Химия халькогенов. Водородные соединения1.1. Халькогеноводороды.A.
- 30. Лекция 1426II. Химия халькогенов. Водородные соединенияБ. Физико-химические
- 31. H2S 1. Промышленный методы: побочный продукт очистки нефти, природных
- 32. Лекция 1428В. Химические свойства.I. Химия халькогенов. Водородные
- 33. Лекция 1429В. Химические свойства (продолжение).II. Химия халькогенов.
- 34. Лекция 1430II. Химия халькогенов. Сульфиды.1.2. СульфидыА. ПолучениеFe
- 35. Лекция 1431II. Химия халькогенов. Сульфиды.1.2. СульфидыЗадача 1.Рассчитайте
- 36. Лекция 1432II. Химия халькогенов. Сульфиды.В. ГидролизОбратимый гидролиз:Na2S
- 37. Лекция 1433II. Химия халькогенов. Водородные соединения1.3. Сульфаны
- 38. Лекция 1434II. Химия халькогенов. Водородные соединения.1.4. Пероксид
- 39. Лекция 1435II. Химия халькогенов. Пероксид водорода.Б. Получение.Промышленные
- 40. Лекция 1436II. Химия халькогенов. Пероксид водорода.В. Химические
- 41. Лекция 1537II. Химия халькогенов. Кислородные соединенияКислородные соединения1.1.
- 42. Лекция 337Б. ПолучениеII. Химия халькогенов. Оксиды ЭO2tt
- 43. Лекция 238В. Химические свойства1). Взаимодействие с водой:SO2
- 44. Лекция 339Строение сульфит- и гидросульфит-ионовII. Химия халькогенов. Оксиды ЭO2S+IV [Ne]3s23p0 акцепторO-II [He]2s22p6 донорO-IIнезавершённый тетраэдртаутомерные формы
- 45. Лекция 340В. Химические свойства (продолжение)3). Восстановительные свойства:II.
- 46. Лекция 341II. Химия халькогенов. Кислородные соединения1.2. Оксиды
- 47. Лекция 342II. Химия халькогенов. Оксиды ЭO3Б. Получение1.
- 48. Лекция 343II. Химия халькогенов. Оксиды ЭO3В. Химические
- 49. Лекция 344II. Химия халькогенов. Оксиды ЭO3В. Химические
- 50. Лекция 345II. Химия халькогенов. Кислородные соединения2. Кислоты
- 51. Лекция 346II. Химия халькогенов. Кислоты H2ЭO4Б. Получение
- 52. Лекция 347II. Химия халькогенов. Кислоты H2ЭO4Б. Получение
- 53. Лекция 348II. Химия халькогенов. Кислоты H2ЭO4Б. Получение
- 54. Лекция 349II. Химия халькогенов. Кислоты H2ЭO4Г. Химические
- 55. Лекция 350II. Химия халькогенов. Кислоты H2ЭO4Г. Химические
- 56. Лекция 351II. Химия халькогенов. Кислородные соединения3. Дисерная
- 57. Лекция 152Б. ПолучениеII. Химия халькогенов. Кислородные соединенияДисерная
- 58. Лекция 353II. Химия халькогенов. Кислородные соединения3. Тиосерная
- 59. Лекция 354II. Химия халькогенов. ТиосульфатыВ. Химические свойства1).
- 60. Лекция 354II. Химия халькогенов. ТиосульфатыВ. Химические свойства4).
- 61. Лекция 355II. Химия халькогенов. Кислородные соединения4. Политионовые
- 62. Лекция 156II. Химия халькогенов. ПолитионатыБ. ПолучениеH2Sx +
- 63. Лекция 257II. Химия халькогенов. ПолитионатыВ. Химические свойстваNa2S2O6
- 64. Лекция 358II. Химия халькогенов. Кислородные соединения.5. ПероксокислотыА.
- 65. Лекция 359II. Химия халькогенов. Пероксокислоты.Б. Получениекатод:
- 66. Лекция 360II. Химия халькогенов. Пероксокислоты.В. Химические свойства3).
- 67. Лекция 361II. Химия халькогенов. ПероксокислотыВ. Химические свойства
- 68. Лекция 1431II. Химия халькогенов. Сульфиды.1.2. СульфидыЗадача 1.Рассчитайте
- 69. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Балтийский федеральный университет им. И. Канта
Институт живых систем
ХИМИЯ ЭЛЕМЕНТОВ
Халькогены
(VI)
группа
Слайд 2ПЛАН ЛЕКЦИИ
Химия элементов VI-группы.
1. Общая характеристика халькогенов.
Свойства простых веществ.
2. Соединения халькогенов с водородом. Сульфиды.
3. Кислородные соединения
серы, селена и теллура.1
Лекция 3
Слайд 3Ливерморий
Polonium - Польша
Халькогены – «рождающие руду»
χαλκος - руда
γεννάω - рождать
ύξός
– кислый
γεννάω - рождать
sērum - сыворотка
Σεληνη - Луна
Tellus - Земля
Лекция
142
I. Химия халькогенов
Слайд 4Лекция 14
3
I. Халькогены. Общая характеристика
1. Общая характеристика элементов
1.1. Строение
атома (электронное).
1.2 . Физико-химические свойства простых веществ.
1.3. Химические свойства, общие
для всех элементов группы.1.4. Различия в химических свойствах элементов одной группы.
1.5. Химические свойства простых веществ (отношение к H2O, H3O+, OH-, O2, Hal2).
1.6. Распространённость в природе. История открытия. Методы получения.
1.7. Применение.
Слайд 5Лекция 14
4
II. Химия халькогенов. Общая характеристика
1.1. Строение атома (валентные подуровни).
XVI
O, S, Se, Te, Po
ns2np4
Степени окисления: все от -2 до
+6 (кроме O). Устойчивые – чётные.Простые вещества – достаточно сильные окислители!
Простые вещества – неметаллы (кроме Po и Lv)!
До завершения подуровня не хватает склонность отдавать электроны
двух электронов
Характерные степени окисления:
O: -II, -I, 0, (+II)
S: -II, 0, +IV, +VI
Se: -II, 0, +IV, +VI
Te: -II, 0, +II, +IV, +VI
Po: 0, +II, +IV
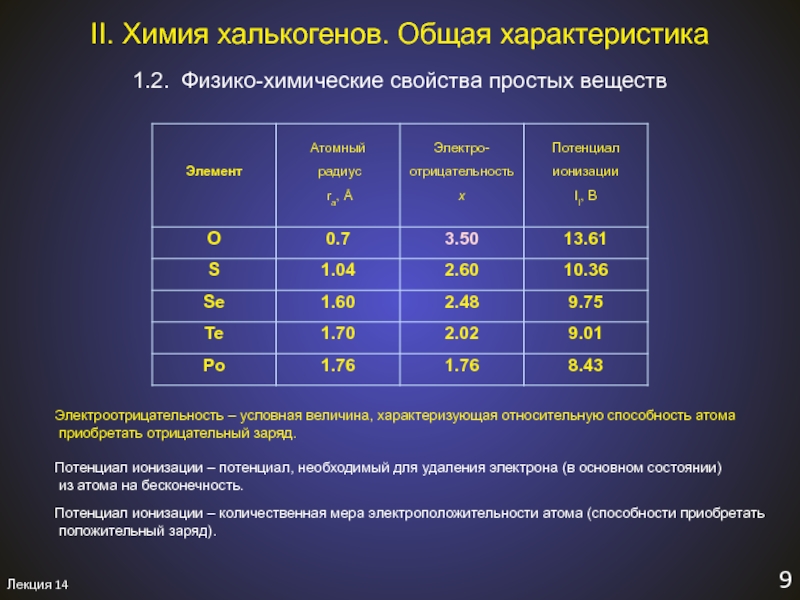
Слайд 6Лекция 14
5
1.2. Физико-химические свойства простых веществ
II. Химия халькогенов. Общая характеристика
S8
tпл
= 119.3 oC
d = 2.07 г/см3
O2
tк = -182.98 oC
d =
1.429 г/см3Se
tпл = 217 oC
d = 4.79 г/см3
Te
tпл = 449.8 oC
d = 6.25 г/см3
Po
tпл = 254 oC
d = 9.32 г/см3
Период полураспада – 102 года.
Слайд 7Лекция 14
6
1.2. Физико-химические свойства простых веществ
II. Химия халькогенов. Общая характеристика
Aллотропия
и полиморфизм
Аллотропия – явление существования химического элемента
в виде нескольких простых
веществ (соединений).O2
O3
кислород
озон
Аллотропные модификации - разные соединения, разные вещества.
Обладают разными физико-химическими и химическими свойствами.
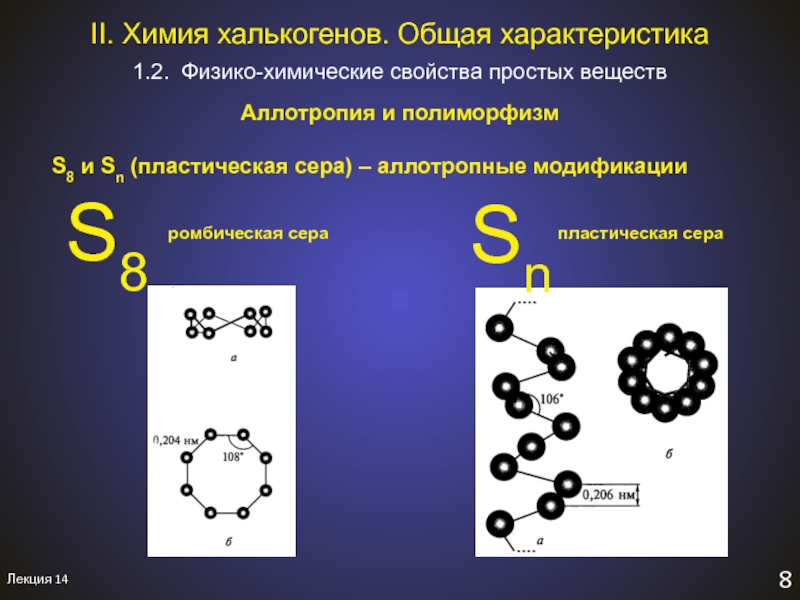
Слайд 8Лекция 14
7
Полиморфизм – явление существования одного соединения
в виде двух или
более веществ с разной кристаллической
структурой.
Полиморфные модификации - одно соединение, разные
вещества.
Обладают разными физико-химическими свойствами,
но близкими химическими свойствами.
1.2. Физико-химические свойства простых веществ
II. Химия халькогенов. Общая характеристика.
Aллотропия и полиморфизм
S8
S8
ромбическая сера
моноклинная сера
Слайд 9Лекция 14
8
1.2. Физико-химические свойства простых веществ
II. Химия халькогенов. Общая характеристика
Aллотропия
и полиморфизм
S8 и Sn (пластическая сера) – аллотропные модификации
S8
Sn
ромбическая сера
пластическая
сераСлайд 10Лекция 14
9
1.2. Физико-химические свойства простых веществ
II. Химия халькогенов. Общая характеристика
Электроотрицательность
– условная величина, характеризующая относительную способность атома
приобретать отрицательный заряд.
Потенциал
ионизации – потенциал, необходимый для удаления электрона (в основном состоянии)из атома на бесконечность.
Потенциал ионизации – количественная мера электроположительности атома (способности приобретать
положительный заряд).
Слайд 11Лекция 14
10
II. Химия халькогенов. Общая характеристика
1.3. Химические свойства, общие для
всех элементов групп
A). Окислительные свойства простых веществ
окисление металлов:
Б). Восстановительные свойства
простых веществ (S, Se, Te)(с воспламенением)
(с воспламенением)
Слайд 12Лекция 3
11
В). Кислотные свойства растворов халькогеноводородов (S, Se, Te)
H2Э +
H2O HЭ- + H3O+
II. Химия халькогенов. Общая характеристика
1.3. Химические
свойства, общие для всех элементов группГ). Кислотные свойства оксидов (S, Se, Te)
ЭO2 + 2NaOH = Na2ЭO3 + H2O
ЭO3 + 2NaOH = Na2ЭO4 + H2O
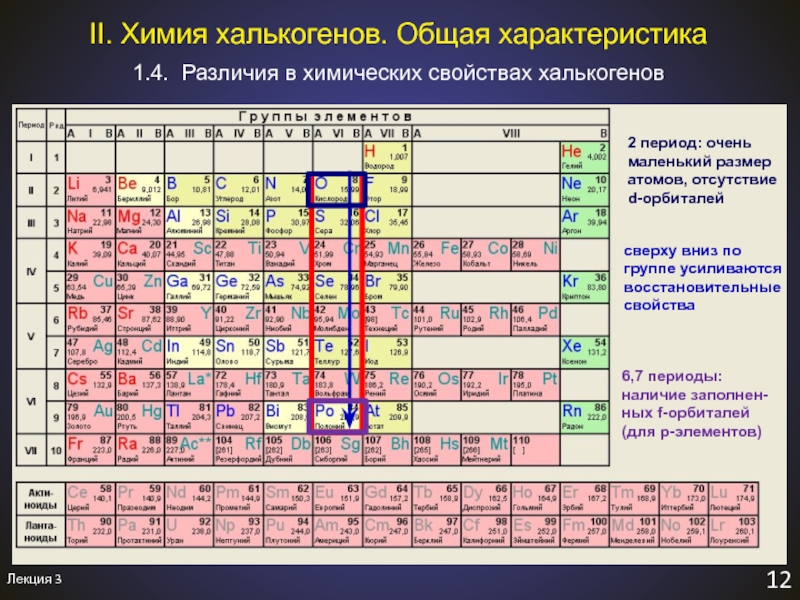
Слайд 132 период: очень маленький размер атомов, отсутствие
d-орбиталей
сверху вниз по
группе усиливаются восстановительные свойства
Лекция 3
12
1.4. Различия в химических свойствах халькогенов
II.
Химия халькогенов. Общая характеристика6,7 периоды: наличие заполнен-ных f-орбиталей (для p-элементов)
Слайд 14Лекция 3
13
1.4. Различия в химических свойствах халькогенов
II. Химия халькогенов. Общая
характеристика
A). Очень высокая окислительная способность кислорода
окисление металлов:
окисление неметаллов:
окисление органических веществ:
C2H5OH
+ 3O2 = 2CO2 + 3H2O(в чистом (особенно жидком) кислороде реакции часто идут со взрывом!)
Слайд 15Лекция 14
14
1.4. Различия в химических свойствах халькогенов
II. Химия халькогенов. Общая
характеристика
Б). Увеличение восстановительных свойств простых веществ
сверху
вниз по группеO2 + HNO3 ≠
6HNO3 + S = H2SO4 + 6NO2 + 2H2O
S (Se) + H2O ≠
Te + 2H2O = TeO2 + 2H2
Po + 2HCl = PoCl2 + H2↑
SO2 + SeO2 = SO3 + Se↓
t
100-160 oC
Слайд 16Лекция 14
15
1.5. Химические свойства простых веществ
II. Химия халькогенов. Общая характеристика
А).
С водой и кислотами - неокислителями не взаимодействуют
(кроме Te)
Б). Реагируют
c растворами щелочейS + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Na2S + (n-1)S = Na2Sn
Na2SO3 + S = Na2SO3S
сульфид
натрия
сульфит
натрия
полисульфид
натрия
тиосульфат
натрия
t
t
t
В). Окисляются кислородом воздуха при нагревании
Г). Реагируют с галогенами (кроме O2)
S + Cl2 = S2Cl2↑
S + 3F2 = SF6↑
t
Слайд 17Лекция 14
16
1.6. Нахождение в природе
II. Химия халькогенов. Общая характеристика
КИСЛОРОД: 47.2%
– самый распространённый на Земле элемент!
В атмосферном воздухе – 23.15%
(по массе) или 20.93% (по объёму).В воде – 85.82% (по массе). В минералах и горных породах – более 50% (по массе).
В живых организмах – около 65% (по массе).
Кислород – незаменимый элемент для живых организмов.
Слайд 18Лекция 14
17
1.6. Нахождение в природе
II. Химия халькогенов. Общая характеристика
СЕРА: 0.05%
Встречается
в самородном виде. В виде соединений – в морской воде
(сульфаты), во многих минералах (сульфиды, сульфаты). Также встречается в природных газах, нефтях, углях. В живых организмах (белки).Сера – незаменимый элемент для живых организмов.
САМОРОДНАЯ СЕРА
ПИРИТ (FeS2)
ГИПС (CaSO42H2O)
(«розы пустыни»)
Слайд 19Лекция 14
18
1.6. Нахождение в природе
II. Химия халькогенов. Общая характеристика
СЕЛЕН: 6.0·10-5
%, редкий элемент, в рассеянном виде.
Собственные минералы очень редки. Следы
селена присутствуют во многих сульфидных минералах. Важный микроэлемент для живых организмов.ТЕЛЛУР: 1·10-6 %, редкий элемент.
Основные минералы: самородный Te, теллуриды Au, Ag, Bi, теллуриты и теллураты железа, TeO2.
САМОРОДНЫЙ СЕЛЕН
САМОРОДНЫЙ ТЕЛЛУР
Слайд 21Лекция 14
20
O3: впервые получен Шёнбейном в 1840 г. öζω -
пахну
Современные методы получения:
В тлеющем электрическом разряде (в озонаторах)
O2 = 2O
O
+ O2 = O31.6. Получение
II. Химия халькогенов. Общая характеристика
Образуется при грозовых разрядах, в процессах с образованием
атомарного кислорода (разложение перекисей, окисление фосфора,
электролиз кислородсодержащих кислот и т.д.).
Озон – сильнейший яд!
ПДК = 10-5 % (~0.1 мл/м3)
Слайд 22Лекция 14
21
1.6. Получение
II. Химия халькогенов. Общая характеристика
S8 известна с древнейших
времён.
Современные методы получения:
Промышленные методы:
1. выплавка самородной серы;
2. из сероводорода промышленных, нефтяных и
природных газов:3. H2S + O2 = S↓ + H2O
4. 2H2S + SO2 = 3S↓ + 2H2O
Лабораторные методы:
1. 2H2S + SO2 = 3S↓ + 2H2O
2. Na2S + 2H2SO4(конц) = S↓ + Na2SO4 + SO2↑ + 2H2O
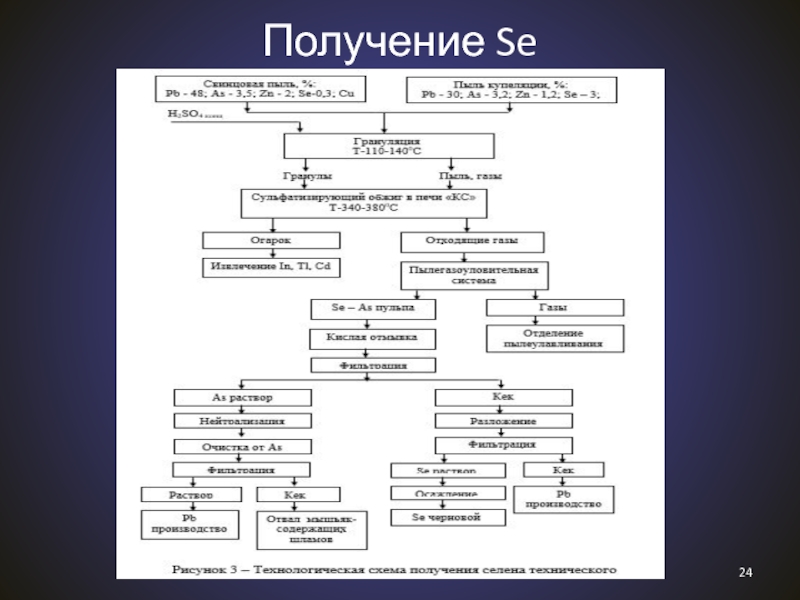
Слайд 23Лекция 14
22
1.6. Получение
II. Химия халькогенов. Общая характеристика
Se: открыт Йёнсом Якобом
Берцелиусом в 1817 г. в шламах сернокислотного производства.
Современные методы
получения:Промышленный метод – из медьэлектролитных шламов:
SeO2 + 2SO2 = Se↓ + 2SO3
Лабораторный метод:
2H2SeO3 + SO2 = Se↓ + 2H2SO4
Te: открыт в 1782 г. Ф. Мюллером в 1782 г., получен М. Клапротом в 1798 г.
Современные методы получения:
Промышленный метод – из медьэлектролитных шламов
и отходов свинцово-цинкового производства:
TeO2 + 2C = 2CO + Te
TeO2 + 2SO2 = 2SO3 + Te
Лабораторный метод:
2H2TeO3 + SO2 = Te↓ + 2H2SO4
t
Слайд 27Лекция 3
23
1.6. Получение
II. Химия халькогенов. Общая характеристика
Po: открыт Марией Склодовской-Кюри
и Пьером Кюри в 1898 г. в смоляной обманке.
Современные
методы получения:Из отходов переработки урановых руд
PoO2 = Po + O2
Облучение металлического висмута протонами
209Bi + p → 209Po + n
t
98 % мирового производства полония приходится на Россию.
Слайд 28Лекция 14
24
1.7. Применение
II. Химия галогенов. Общая характеристика
O: ● дыхание растений
и животных
● металлургия
● сварка и резка металлов
● окислители ракетных топлив
(жидкий О2, H2O2, O3)● очистка воды (озонирование)
● химическая промышленность
● транспорт (окисление топлива)
S: ● необходимый для жизнедеятельности элемент
● химическая промышленность (производство H2SO4)
● производство резины (вулканизация каучука)
● производство спичек и дымного пороха, пиротехники (S)
● получение фосфорных удобрений (H2SO4)
● производство моющих средств (H2SO4)
● производство полимеров и синтетических волокон (H2SO4)
● пищевая промышленность (производство сахара, растительных
масел и жиров)
● производство люминофоров и ФЭУ (сульфиды Zn, Cd)
Se: ● электроника (выпрямители, фотоэлементы, полупроводники)
● производство резины повышенной эластичности и износостойкости
Te: ● цветная металлургия (легирование свинца)
Слайд 29Лекция 14
25
II. Химия халькогенов. Водородные соединения
1.1. Халькогеноводороды.
A. Строение.
O-II
[He]2s22p6 донор
H+I 1s0 акцептор
Гибридизации нет!
угол
HOH равен 105оугол HЭH равен 90о
В образовании связи участвуют
только p-орбитали атома серы
Слайд 30Лекция 14
26
II. Химия халькогенов. Водородные соединения
Б. Физико-химические свойства.
Причина немонотонности-
водородные связи
между
молекулами H2O.
Дальнейший монотонный рост-
результат увеличения размера
молекул H2Э и, как следствие,
усиление межмолекулярного
взаимодействия.
Температура кипения
H2Э(ж) → H2Hal(г)
Чем сильнее взаимодействие
между молекулами жидкости,
тем выше температура кипения.
Tкип ,оС
H2O
H2S
H2Se
H2Te
Халькогеноводороды – бесцветные газы
с очень неприятным запахом.
Слайд 31H2S 1. Промышленный методы:
побочный продукт очистки нефти, природных и промышленных газов
2.
Лабораторные методы:
FeS2 + 2HCl = FeCl2 + S +
H2S↑Na2S + 2HCl = 2NaCl + H2S↑
CnH2n+2 + S = CnH2n + H2S↑
H2Se, H2 + Э = H2Э↑
H2Te Na2Э + 2H3O+ = Na+ + 2H2O + H2Э↑
Лекция 14
27
В. Получение.
II. Химия халькогенов. Водородные соединения
t
Слайд 32Лекция 14
28
В. Химические свойства.
I. Химия халькогенов. Водородные соединения
1) .Протолиз:
H2Э +
H2O HЭ- + H3O+
HЭ- + H2O Э2- +
H3O+Вода – универсальный растворитель.
Вода – амфолит:
H2O + H2O H3O+ + OH- автопротолиз воды
Kw = [H3O+][OH-] = 10-14 [H3O+] = [OH-] = 10-7
pH = -lg[H3O+] = -lg(10-7) = 7
H2S, H2Se, H2Te – слабые кислоты:
H2S
H2Se
H2Te
Kк1
Kк1
1.1∙10-7
1.2∙10-13
1.6∙10-4
1.0∙10-11
2.3∙10-3
6.8∙10-13
Слайд 33Лекция 14
29
В. Химические свойства (продолжение).
II. Химия халькогенов. Водородные соединения
2). Сильные
восстановительные свойства (кроме H2O):
H2S + O2 = SO2 + H2O
(горение)H2S + O2 = S + H2O (медленное окисление)
H2S(г) + 2HNO3(конц) = S↓ + 2NO2↑ + 2H2O
H2S(р-р) + I2 = S↓ + 2HI
2H2S + SO2 = 3S↓ + 2H2O
Восстановительные свойства
Халькогеноводороды – сильнейшие яды!
Слайд 34Лекция 14
30
II. Химия халькогенов. Сульфиды.
1.2. Сульфиды
А. Получение
Fe + S =
FeS прямой синтез из элементов
2Al + 3H2S = Al2S3
+ 3H2 взаимодействие H2S с металламиBaSO4 + 4C = BaS + 4CO восстановление сульфатов
NaOH + H2S = Na2S + H2O взаимодействие H2S cо щелочами
Hg(NO3)2 + H2S = HgS↓ + HNO3 обменное взаимодействие
MnCl2 + Na2S = MnS↓ + 2NaCl обменное взаимодействие
Б. Растворимость
Разделение катионов металлов (сульфидный метод)
t
1000 oC
1000 oC
Слайд 35Лекция 14
31
II. Химия халькогенов. Сульфиды.
1.2. Сульфиды
Задача 1.
Рассчитайте молярную концентрацию сероводорода
в насыщенном растворе
при 0 оС, если его растворимость составляет 467
мл / 100 г H2O.Задача 2.
Рассчитайте молярную концентрацию сероводорода в насыщенном растворе
при 20 оС, если его растворимость составляет 258 мл / 100 г H2O.
Задача 3.
Рассчитайте молярную концентрацию сульфид-ионов в насыщенном растворе
сероводорода при 20 оС и pH этого раствора.
Задача 4.
Рассчитайте молярную концентрацию сульфид-ионов в насыщенном растворе
сероводорода при 20 оС, если pH раствора равен 1.
Задача 5.
Определите, выпадет ли осадок сульфида марганца при насыщении раствора
MnSO4 сероводородом при 20 оС.
Слайд 36Лекция 14
32
II. Химия халькогенов. Сульфиды.
В. Гидролиз
Обратимый гидролиз:
Na2S = 2Na+ +
S2-
S2- + H2O HS- + OH- pH > 7
Необратимый гидролиз:
Al2S3
+ 6H2O = 2Al(OH)3↓ + 3H2S↑CrCl3 + Na2S + 6H2O = 2Cr(OH)3↓ + 3H2S↑ + NaCl
Такие сульфиды получить в водном растворе нельзя!
Синтез - из элементов: 2Al + 3S = Al2S3
Г. Восстановительные свойства
2KMnO4 + 4H2O + 3K2S = 2MnO2 + 3S↓ + 8KOH
CuS(т) + 8HNO3(конц) = CuSO4 + 8NO2↑ + 4H2O
t
t
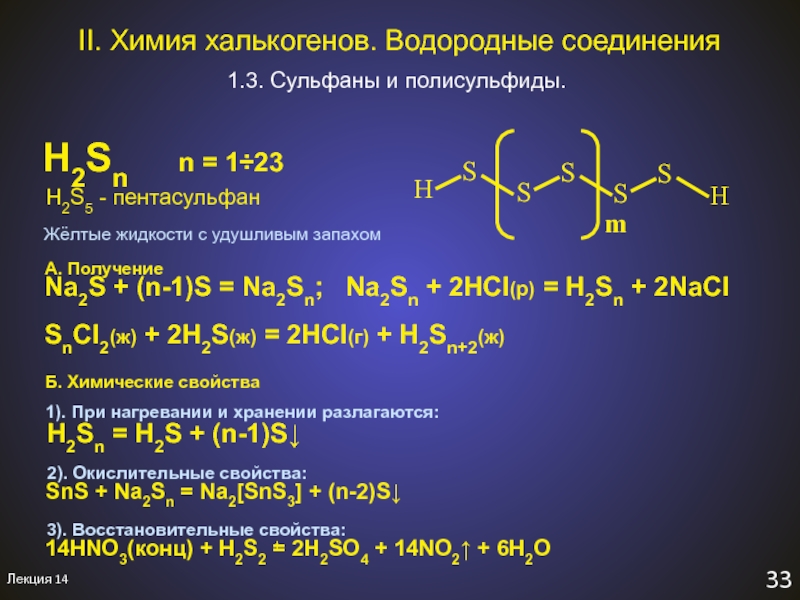
Слайд 37Лекция 14
33
II. Химия халькогенов. Водородные соединения
1.3. Сульфаны и полисульфиды.
H2Sn
n = 123
H2S5 -
пентасульфанA. Получение
Na2S + (n-1)S = Na2Sn; Na2Sn + 2HCl(р) = H2Sn + 2NaCl
SnCl2(ж) + 2H2S(ж) = 2HCl(г) + H2Sn+2(ж)
Б. Химические свойства
1). При нагревании и хранении разлагаются:
H2Sn = H2S + (n-1)S↓
2). Окислительные свойства:
SnS + Na2Sn = Na2[SnS3] + (n-2)S↓
Жёлтые жидкости с удушливым запахом
3). Восстановительные свойства:
14HNO3(конц) + H2S2 = 2H2SO4 + 14NO2↑ + 6H2O
t
Слайд 38Лекция 14
34
II. Химия халькогенов. Водородные соединения.
1.4. Пероксид водорода
A. Строение и
физико-химические свойства.
Бесцветная вязкая жидкость.
d = 1.44 г/см3; Тпл = -0.4
оС, Тк = 152 oC (с разложением)30%-ный водный раствор (пергидроль)
Слайд 39Лекция 14
35
II. Химия халькогенов. Пероксид водорода.
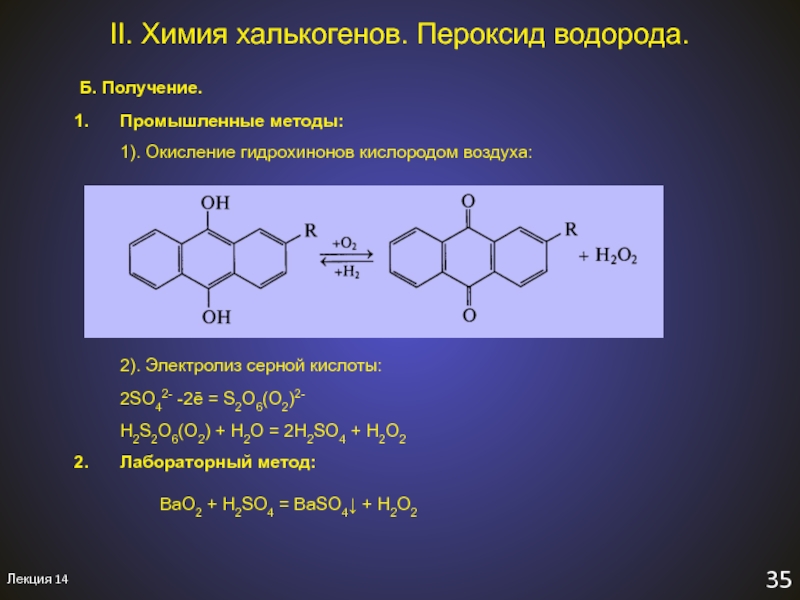
Б. Получение.
Промышленные методы:
1). Окисление гидрохинонов
кислородом воздуха:
2). Электролиз серной кислоты:
2SO42- -2ē
= S2O6(O2)2-H2S2O6(O2) + H2O = 2H2SO4 + H2O2
Лабораторный метод:
BaO2 + H2SO4 = BaSO4↓ + H2O2
Слайд 40Лекция 14
36
II. Химия халькогенов. Пероксид водорода.
В. Химические свойства.
2). Окислительные свойства:
3).
Восстановительные свойства:
3H2O2 + KI = KIO3 + 3H2O
2[Cr(OH)6]3- + 3H2O2
= 2CrO42- + 8H2O + 2OH-2KMnO4 + 6H3O+ + 5H2O2 = 5O2↑ + 2Mn2+ + 2K+ + 14H2O
PbO2(т) + H2O2 + 2H3O+ = Pb2+ + 4H2O + O2
PbO2(т) + H2O2 + OH- = [Pb(OH)3]- + O2
В кислой среде: H2O2 + 2H+ + 2ē = 2H2O φo = +1.76 В
В щелочной среде: H2O2 + 2ē = 2OH- φo = +0.94 В
В кислой среде: H2O2 + 2H+ - 2ē = O2 + 2H+ φo = +0.69 В
В щелочной среде: H2O2 + 2OH- - 2e = O2 + 2H2O φo = -0.13 В
1). Протолиз:
H2O2 + H2O = HO2- + H3O+ слабая кислота (Кк = 2.38∙10-12)
Слайд 41Лекция 15
37
II. Химия халькогенов. Кислородные соединения
Кислородные соединения
1.1. Оксиды ЭO2. Кислоты
H2ЭO3.
А. Строение и физико-химические свойства
S+IV [Ne]3s23p0 акцептор
O-II [He]2s22p6 донор
незавершённый треугольник
Слайд 43Лекция 2
38
В. Химические свойства
1). Взаимодействие с водой:
SO2 + H2O
SO2∙H2O
SO2 ∙H2O + H2O HSO3- + H3O+
SeO2 + H2O
= H2SeO3H2SeO3 + H2O HSeO3- + H3O+
По правилу Поллинга:
NO – NH = 3 – 2 = 1
cлабые кислоты
II. Химия халькогенов. Оксиды ЭO2
сернистая кислота
гидросульфит-ион
селенистая
кислота
2). Кислотные свойства:
SO2 + 2NaOH = Na2SO3 + H2O
SO2 + H2O + Na2SO3 = 2NaHSO3
сульфит натрия
гидросульфит натрия
TeO2 в воде практически нерастворим
TeO2 – амфотерен!
Слайд 44Лекция 3
39
Строение сульфит- и гидросульфит-ионов
II. Химия халькогенов. Оксиды ЭO2
S+IV [Ne]3s23p0
акцептор
O-II [He]2s22p6 донор
O-II
незавершённый тетраэдр
таутомерные формы
Слайд 45Лекция 3
40
В. Химические свойства (продолжение)
3). Восстановительные свойства:
II. Химия халькогенов. Оксиды
ЭO2
5SO2 + 2H2O + 2KMnO4 = 2H2SO4 + K2SO4 +
2MnSO4SO2 + SeO2 = SO3 + Se
4). Окислительные свойства:
SO2 + 2H2 = S + 2H2O
SO2 + H2S = S + H2O
В реакциях с сильными восстановителями
Аналогичные свойства проявляют сернистая кислота и её соли:
5Na2SO3 + 6H3O+ + 2KMnO4 = 5Na2SO4 + 2Mn2+ + 2K+ + 9H2O
2SO2∙H2O + Zn = ZnS2O4 + 2H2O
дитионит
цинка
Слайд 46Лекция 3
41
II. Химия халькогенов. Кислородные соединения
1.2. Оксиды ЭO3
S+VI [Ne]3s03p0 акцептор
O-II [He]2s22p6
донор
А. Строение и физико-химические свойства
O-II
правильный треугольник
Слайд 47Лекция 3
42
II. Химия халькогенов. Оксиды ЭO3
Б. Получение
1. В промышленности:
2SO2(г) +
O2(г) 2SO3(г) + Q (95.6 кДж/моль)
Катализаторы: Pt, V2O5 + K2O
2.
В лаборатории:Na2S2O7 = Na2SO4 + SO3↑
Fe2(SO4)3 = Fe2O3 + 3SO3↑
2H2SeO4 + P4O10 = 2SeO3 + 4HPO3
H6TeO6 = TeO3 + 3H2O
t
t
400-620 oC, кат.
t
Слайд 48Лекция 3
43
II. Химия халькогенов. Оксиды ЭO3
В. Химические свойства
2). Взаимодействие с
водой:
SO3 + H2O = H2SO4 + Q (90 кДж/моль)
(n-1)SO3 +
H2SO4 = H2SnO3n+1SeO3 + H2O = H2SeO4
TeO3 с водой практически не взаимодействует
серная кислота
селеновая кислота
олеум
1). Термическое разложение:
ЭO3 = ЭO2 + O2
t
Температура разложения, oC:
SO3 ~450
SeO3 ~240
TeO3 ~360
Слайд 49Лекция 3
44
II. Химия халькогенов. Оксиды ЭO3
В. Химические свойства (продолжение)
3). Кислотные
свойства:
SO3 + 2NaOH = Na2SO4 + H2O
TeO3 + 6NaOH =
Na6TeO6 + 3H2OFe2O3 + 3SO3 = Fe2(SO4)3
4). Окислительные свойства:
2SO3 + C = CO2 + SO2
2SO3 + 2HCl = SO2↑+ Cl2↑ + H2SO4
2SO3 + 8HI = H2S + 4I2 + 3H2O
SeO3 + 2HCl = H2SeO3 + Cl2
Смеси SeO3 с органическими веществами взрываются!
t
Сильные окислители
SO3 < SeO3 > TeO3
окислительная способность
0 oC
0 oC
Слайд 50Лекция 3
45
II. Химия халькогенов. Кислородные соединения
2. Кислоты H2ЭO4
А. Строение и
физико-химические свойства
S+VI [Ne]3s03p0 акцептор
O-II [He]2s22p6 донор
O-II
O-II
H2SO4 – бесцветная тяжёлая маслянистая
жидкость (Тк = 279.6 оС);H2SеO4 и H2TеO4 – бесцветные кристаллические вещества.
Слайд 51Лекция 3
46
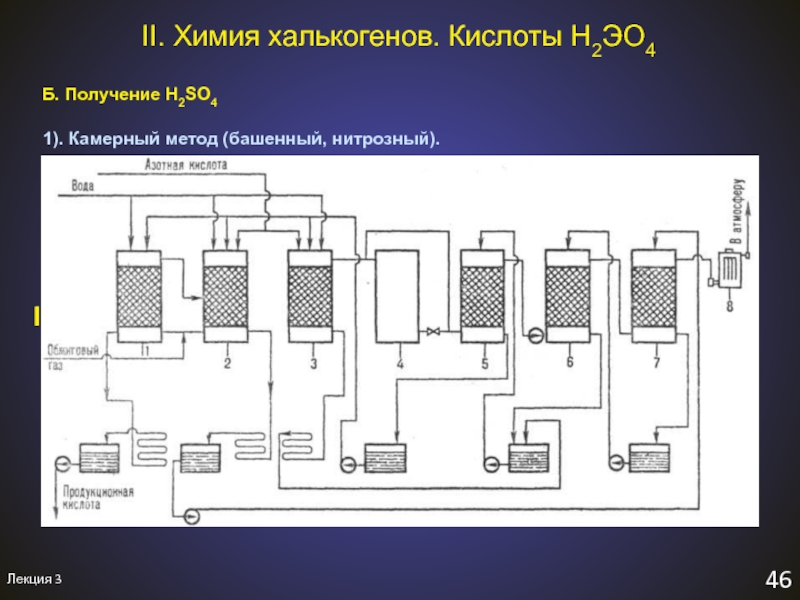
II. Химия халькогенов. Кислоты H2ЭO4
Б. Получение H2SO4
1). Камерный метод
(башенный, нитрозный).
I. 2FeS2 + 11O2 = Fe2O3 + 4SO2↑ обжиг пирита
или
S
+ O2 = SO2↑ сжигание серыSO2 + NO2 + H2O = H2SO4 + NO↑
SO2 + N2O3 + H2O = H2SO4 + 2NO↑
2NO + O2 = 2NO2
t
t
Слайд 52Лекция 3
47
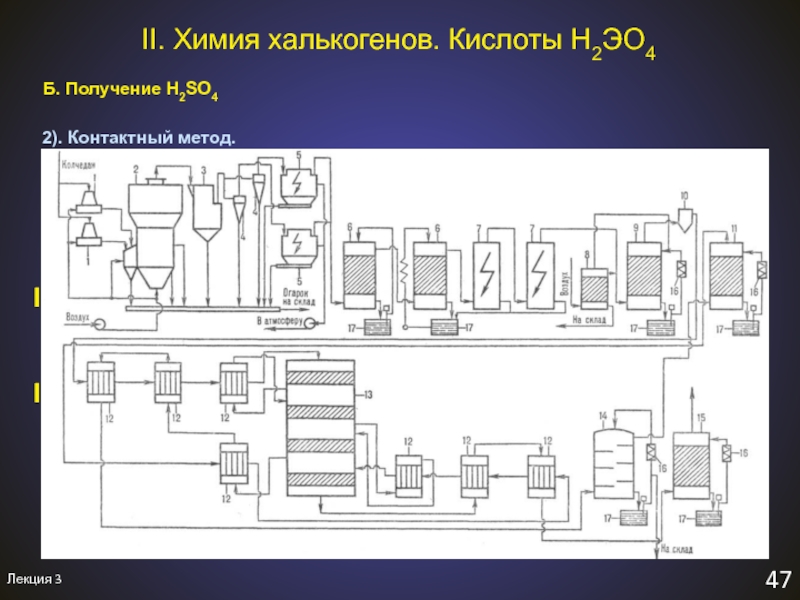
II. Химия халькогенов. Кислоты H2ЭO4
Б. Получение H2SO4
2). Контактный метод.
I. 2FeS2
+ 11O2 = Fe2O3 + 4SO2↑ обжиг пирита
или
S + O2
= SO2↑ сжигание серы2SO2 + O2 2SO3 окисление диоксида серы
300-400 оС, катализатор – V2O5 + K2O
SO3 + H2O = H2SO4 абсорбция триоксида серы
(n-1)SO3 + H2SO4 = H2SnO3n+1
олеум
Слайд 53Лекция 3
48
II. Химия халькогенов. Кислоты H2ЭO4
Б. Получение H2SO4
3). Купоросный метод
FeSO4∙7H2O
= FeSO4 + 7H2O↑
2FeSO4 = Fe2O3 + SO2↑ + SO3↑
SO3
+ H2O = H2SO4t
t
В. Получение H2SеO4 и H2TеO4
Se + 3Cl2 + 4H2O = H2SеO4 + 6HCl
H2SeO3 + H2O2 = H2SeO4 + H2O
Слайд 54Лекция 3
49
II. Химия халькогенов. Кислоты H2ЭO4
Г. Химические свойства
1). Протолиз:
H2ЭO4 +
2H2O = SO42- + 2H3O+
HЭO4- + H2O = ЭO42- +
H3O+сильные кислоты
2). Кислотные свойства:
H2SO4(р) + Zn = ZnSO4 + H2
H2SO4 + 2NaOH = Na2SO4 + 2H2O
3H2SO4 + Fe2O3 = Fe2(SO4) 3+ 3H2O
в разбавленном виде –
кислоты-неокислители.
Слайд 55Лекция 3
50
II. Химия халькогенов. Кислоты H2ЭO4
Г. Химические свойства
3). Окислительные свойства:
2H2SO4(конц)
+ Cu = CuSO4 + SO2↑ + 2H2O
5H2SO4(конц) + 4Zn
= 4ZnSO4 + H2S↑ + 4H2OВ концентрированном виде – сильные окислители!
Окислительная способность: H2SO4 < H2SeO4 > H2TeO4
t
6H2SеO4(конц) + 2Au = Au2(SeO4)3 + 3H2SeO3 + 3H2O
4). Водоотнимающие свойства H2SO4
H2SO4(конц) + nH2O = H2SO4∙nH2O + Q
H2SO4(конц) + C2H5OH = H2SO4∙H2O + C2H4↑
xH2SO4(конц) + Cn(H2O)m = nC + xH2SO4∙(H2O)m/x
обугливание органических соединений
(дегидратация)
Слайд 56Лекция 3
51
II. Химия халькогенов. Кислородные соединения
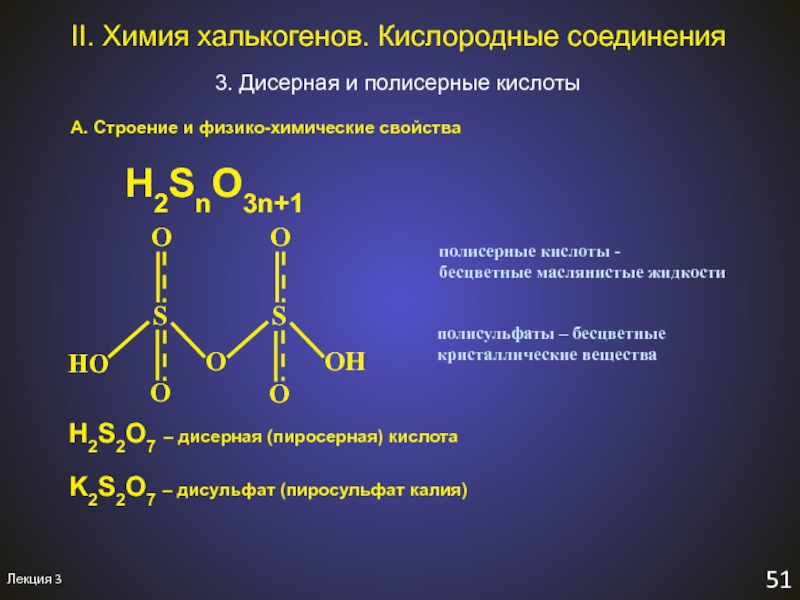
3. Дисерная и полисерные кислоты
А.
Строение и физико-химические свойства
H2SnO3n+1
полисерные кислоты -
бесцветные маслянистые жидкости
полисульфаты –
бесцветныекристаллические вещества
H2S2O7 – дисерная (пиросерная) кислота
K2S2O7 – дисульфат (пиросульфат калия)
Слайд 57Лекция 1
52
Б. Получение
II. Химия халькогенов. Кислородные соединения
Дисерная кислота и дисульфаты
H2SO4(конц)
+ SO3 = H2S2O7
2KHSO3 = K2S2O7 + H2O↑
В. Химические свойства
H2S2O7
+ H2O = 2H2SO4K2S2O7 + H2O = 2KHSO3
1). В водных растворах:
свойства в водных растворах
идентичны свойствам H2SO4 и KHSO3
2). В твёрдом виде:
Al2O3 + 3K2S2O7 = 3K2SO4 + Al2(SO4)3
Cr2O3 + 3K2S2O7 = 3K2SO4 + Cr2(SO4)3
перевод инертных оксидов
в растворимое состояние
t
t
t
Слайд 58Лекция 3
53
II. Химия халькогенов. Кислородные соединения
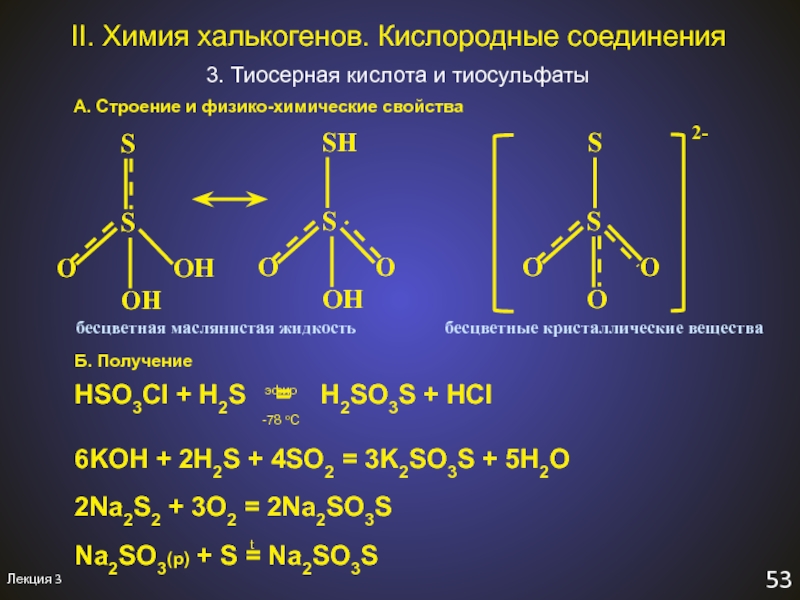
3. Тиосерная кислота и тиосульфаты
А.
Строение и физико-химические свойства
Б. Получение
HSO3Cl + H2S =
H2SO3S + HCl6KOH + 2H2S + 4SO2 = 3K2SO3S + 5H2O
2Na2S2 + 3O2 = 2Na2SO3S
Na2SO3(р) + S = Na2SO3S
эфир
-78 оС
t
бесцветная маслянистая жидкость
бесцветные кристаллические вещества
Слайд 59Лекция 3
54
II. Химия халькогенов. Тиосульфаты
В. Химические свойства
1). Термическое разложение
2). Раложение
в кислой среде
H2SO3S = SO2↑ + S↓ + H2O
SO3S2- +
2H3O+ = SO2↑ + S↓ + 3H2O3). Восстановительные свойства
SO3S2- + I2 = S4O62- + 2I-
SO3S2- + 4Cl2 + 5H2O = 2SO42- + 10H+ + 8Cl-
тетратионат-
ион
при действии слабых окислителей
при действии сильных окислителей
t
Слайд 60Лекция 3
54
II. Химия халькогенов. Тиосульфаты
В. Химические свойства
4). Комплексообразующие свойства
AgI (т)
+ 3SO3S2- = [Ag(SO3S)2]3- + I-
бис(тиосульфато)аргентат-ион
3).
Окислительные свойства3SO3S2- + 8Al + 14OH- + 9H2O = 6S2- + 8[Al(OH)4]-
при действии сильных восстановителей
Слайд 61Лекция 3
55
II. Химия халькогенов. Кислородные соединения
4. Политионовые кислоты и политионаты
А.
Строение и физико-химические свойства
политионовые кислоты -
желтовато-зелёные растворы
политионаты – бесцветные
кристаллические
веществаH2S2+xO6
Слайд 62Лекция 1
56
II. Химия халькогенов. Политионаты
Б. Получение
H2Sx + 2SO3 =
H2S2+xO6
эфир
-78 оС
MnO2 + 2SO2 = MnS2O6
SO3S2- + I2 =
S4O62- + 2I-2Na2SO3S + SCl2 = Na2S5O6 + 2NaCl
2Na2SO3S + H2O2 = Na2S3O6 + Na2SO4 + 3H2O
Слайд 63Лекция 2
57
II. Химия халькогенов. Политионаты
В. Химические свойства
Na2S2O6 = Na2SO4 +
SO2↑
1). Термическое разложение
Na2S2+xO6 = Na2SO4 + SO2 + xS↓
2). Восстановительные
свойстваS2O62- + 2H2O – 2ē = 2SO42- + 4H+
при действии сильных окислителей
S2O62- + 2ē = 2SO32-
3). Окислительные свойства
при действии сильных восстановителей
t
t
H2S2+xO6 = H2S2+x-yO6 + yS↓
t
H2S2+xO6 = H2SO4 + SO2 + xS↓
медленное разложение при хранении
Слайд 64Лекция 3
58
II. Химия халькогенов. Кислородные соединения.
5. Пероксокислоты
А. Строение и физико-химические
свойства
пероксомоносерная кислота
(кислота Каро)
пероксодисерная кислота
Бесцветные кристаллические вещества. H2SO5 в кристаллическом виде
взрывоопасна!H2SO5
H2S2O6(O2)
Слайд 65Лекция 3
59
II. Химия халькогенов. Пероксокислоты.
Б. Получение
катод: 2H3O+ + 2ē
= H2 + 2H2O
анод: 2SO42- - 2ē =
S2O82-электролиз серной кислоты или сульфатов
HSO3Cl + H2O2(безводн.) = H2SO5 + HCl
K2S2O8 + H2O + H2SO4(конц) = H2SO5 + 2KHSO4
Слайд 66Лекция 3
60
II. Химия халькогенов. Пероксокислоты.
В. Химические свойства
3). Взаимодействие с водой
H2S2O8
+ 2H2O = 2H2SO4 + H2O2
H2SO5 + H2O = H2SO4
+ H2O21). Термическое разложение
2). Протолиз
H2S2O8 + 2H2O = S2O82- + 2H3O+
H2SO5 + H2O = HSO5- + H3O+
t
t
на холоду
Слайд 67Лекция 3
61
II. Химия халькогенов. Пероксокислоты
В. Химические свойства (продолжение)
4). Окислительные свойства
5K2S2O8
+ 2MnSO4 + 8H2O = 2KMnO4 + 8H2SO4 + 4K2SO4
Ag+
S2O82-
+ 2ē = 2SO42- Eo = 2.01 В >> 1В очень сильный окислитель!Слайд 68Лекция 14
31
II. Химия халькогенов. Сульфиды.
1.2. Сульфиды
Задача 1.
Рассчитайте молярную концентрацию сероводорода
в насыщенном растворе
при 0 оС, если его растворимость составляет 467
мл / 100 г H2O.Задача 2.
Рассчитайте молярную концентрацию сероводорода в насыщенном растворе
при 20 оС, если его растворимость составляет 258 мл / 100 г H2O.
Задача 3.
Рассчитайте молярную концентрацию сульфид-ионов в насыщенном растворе
сероводорода при 20 оС и pH этого раствора.
Задача 4.
Рассчитайте молярную концентрацию сульфид-ионов в насыщенном растворе
сероводорода при 20 оС, если pH раствора равен 1.
Задача 5.
Определите, выпадет ли осадок сульфида марганца при насыщении раствора
MnSO4 сероводородом при 20 оС.























![Балтийский федеральный университет им. И. Канта
Институт живых систем
ХИМИЯ Лекция 1425II. Химия халькогенов. Водородные соединения1.1. Халькогеноводороды.A. Строение.O-II [He]2s22p6 донорH+I Лекция 1425II. Химия халькогенов. Водородные соединения1.1. Халькогеноводороды.A. Строение.O-II [He]2s22p6 донорH+I 1s0](/img/thumbs/770a6a39d664953ab689871e75bde982-800x.jpg)









![Балтийский федеральный университет им. И. Канта
Институт живых систем
ХИМИЯ Лекция 1537II. Химия халькогенов. Кислородные соединенияКислородные соединения1.1. Оксиды ЭO2. Кислоты H2ЭO3.А. Лекция 1537II. Химия халькогенов. Кислородные соединенияКислородные соединения1.1. Оксиды ЭO2. Кислоты H2ЭO3.А. Строение и физико-химические свойстваS+IV [Ne]3s23p0 акцепторO-II [He]2s22p6](/img/thumbs/c720010b8680d7fbc93909509b2e47de-800x.jpg)


![Балтийский федеральный университет им. И. Канта
Институт живых систем
ХИМИЯ Лекция 339Строение сульфит- и гидросульфит-ионовII. Химия халькогенов. Оксиды ЭO2S+IV [Ne]3s23p0 акцепторO-II [He]2s22p6 донорO-IIнезавершённый тетраэдртаутомерные формы Лекция 339Строение сульфит- и гидросульфит-ионовII. Химия халькогенов. Оксиды ЭO2S+IV [Ne]3s23p0 акцепторO-II [He]2s22p6 донорO-IIнезавершённый тетраэдртаутомерные формы](/img/thumbs/d0fd63cf30d84acadc6cc1b1c70b77fb-800x.jpg)

![Балтийский федеральный университет им. И. Канта
Институт живых систем
ХИМИЯ Лекция 341II. Химия халькогенов. Кислородные соединения1.2. Оксиды ЭO3S+VI [Ne]3s03p0 акцепторO-II [He]2s22p6 донорА. Строение и физико-химические свойстваO-IIправильный треугольник Лекция 341II. Химия халькогенов. Кислородные соединения1.2. Оксиды ЭO3S+VI [Ne]3s03p0 акцепторO-II [He]2s22p6 донорА. Строение и физико-химические свойстваO-IIправильный треугольник](/img/thumbs/6bcc125b204754025ca98491b8b91ab5-800x.jpg)



![Балтийский федеральный университет им. И. Канта
Институт живых систем
ХИМИЯ Лекция 345II. Химия халькогенов. Кислородные соединения2. Кислоты H2ЭO4А. Строение и физико-химические Лекция 345II. Химия халькогенов. Кислородные соединения2. Кислоты H2ЭO4А. Строение и физико-химические свойстваS+VI [Ne]3s03p0 акцепторO-II [He]2s22p6 донорO-IIO-IIH2SO4 –](/img/thumbs/e59b8f7caccb9dd2978265aa87554787-800x.jpg)





![Балтийский федеральный университет им. И. Канта
Институт живых систем
ХИМИЯ Лекция 354II. Химия халькогенов. ТиосульфатыВ. Химические свойства4). Комплексообразующие свойстваAgI (т) + Лекция 354II. Химия халькогенов. ТиосульфатыВ. Химические свойства4). Комплексообразующие свойстваAgI (т) + 3SO3S2- = [Ag(SO3S)2]3- + I-](/img/thumbs/6ef734067e1f73b8541dec00252506d9-800x.jpg)