Слайд 2С пищей в организм поступают разнообразные жирные кислоты, в том
числе и незаменимые. Значительная часть заменимых жирных кислот синтезируется в
печени, в меньшей степени - в жировой ткани.
Источником углерода для синтеза жирных кислот служит ацетил-КоА, образующийся при распаде глюкозы в абсорбтивном периоде.
!!! Таким образом, избыток углеводов, поступающих в организм, трансформируется в жирные кислоты, а затем в жиры.
Слайд 3Синтез жирных кислот происходит в абсорбтивный период.
Активный гликолиз и
последующее окислительное декарбоксилирование пирувата способствуют увеличению концентрации ацетил-КоА в матриксе
митохондрий.
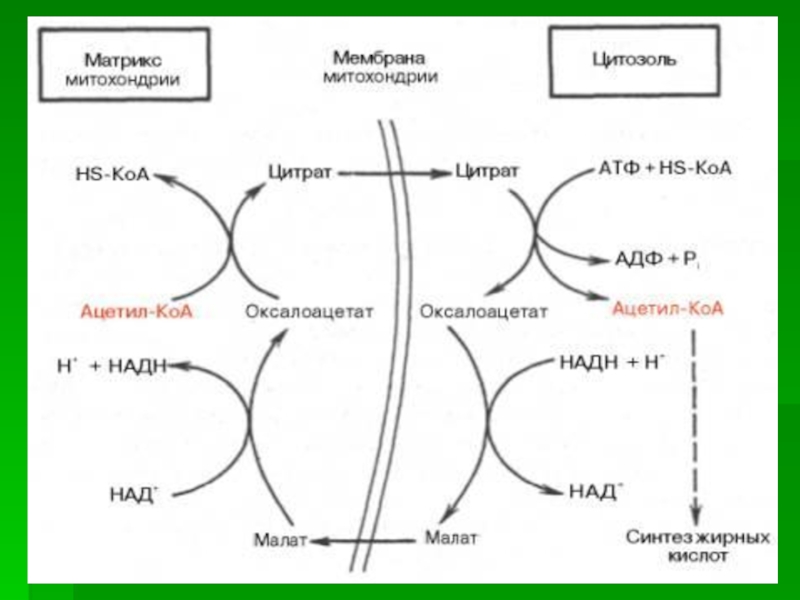
Слайд 4Синтез жирных кислот происходит в цитозоле клеток, поэтому ацетил-КоА должен
транспортироваться через внутреннюю мембрану митохондрий в цитозоль.
Однако внутренняя мембрана
митохондрий непроницаема для ацетил-КоА, поэтому в матриксе митохондрий ацетил-КоА превращается в цитрат при участии цитратсинтазы:
Ацетил-КоА + Оксалоацетат Цитрат + HS-КоА
Слайд 5Перенос цитрата в цитоплазму происходит только при увеличении количества цитрата
в митохондриях, когда изоцитратдегидрогеназа и α-кетоглутарат-дегидрогеназа ингибированы высокими концентрациями NADH
и АТФ.
В цитоплазме цитрат расщепляется под действием фермента цитратлиазы:
Цитрат + HSKoA + АТФ → Ацетил-КоА + АДФ + Pi + Оксалоацетат
Слайд 6Ацетил-КоА в цитоплазме служит исходным субстратом для синтеза жирных кислот,
а оксалоацетат
в цитозоле подвергается следующим превращениям.
Пируват
транспортируется обратно в матрикс митохондрий.
Восстановленный в результате действия малик-фермента NADPH используется как донор водорода для последующих реакций синтеза жирных кислот. Другой источник NADPH - окислительные стадии пентозофосфатного пути катаболизма глюкозы.
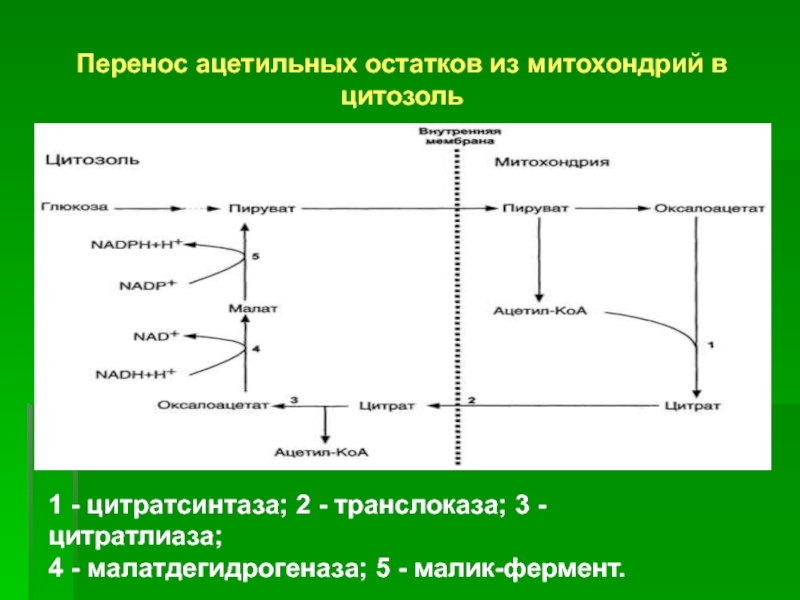
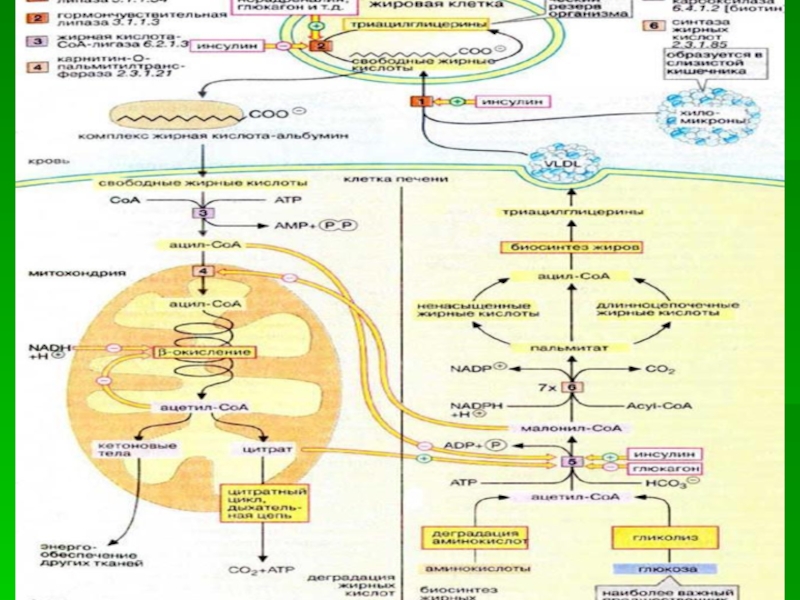
Слайд 7Перенос ацетильных остатков из митохондрий в цитозоль
1 - цитратсинтаза;
2 - транслоказа; 3 - цитратлиаза;
4 - малатдегидрогеназа; 5
- малик-фермент.
Слайд 8Образование малонил-КоА из ацетил-КоА – это первая и регуляторная реакция
в биосинтезе жирных кислот.
Фермент, катализирующий эту реакцию - ацетил-КоА-карбоксилаза.
Он
содержит ковалентно связанный биотин.
Слайд 9В первой стадии реакции СО2 ковалентно связывается с биотином за
счёт энергии АТФ,
во второй стадии СОО- переносится на ацетил-КоА
с образованием малонил-КоА.
Активность фермента ацетил-КоА-карбоксилазы определяет скорость всех последующих реакций синтеза жирных кислот.
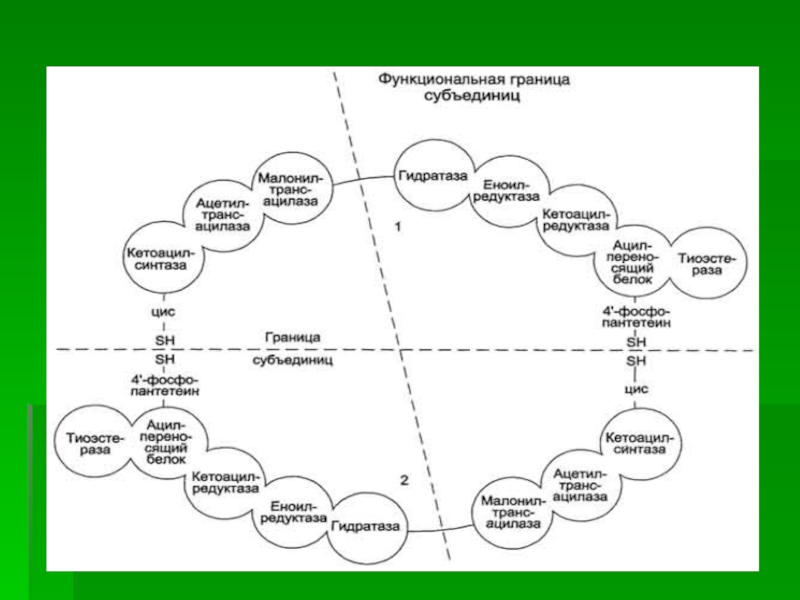
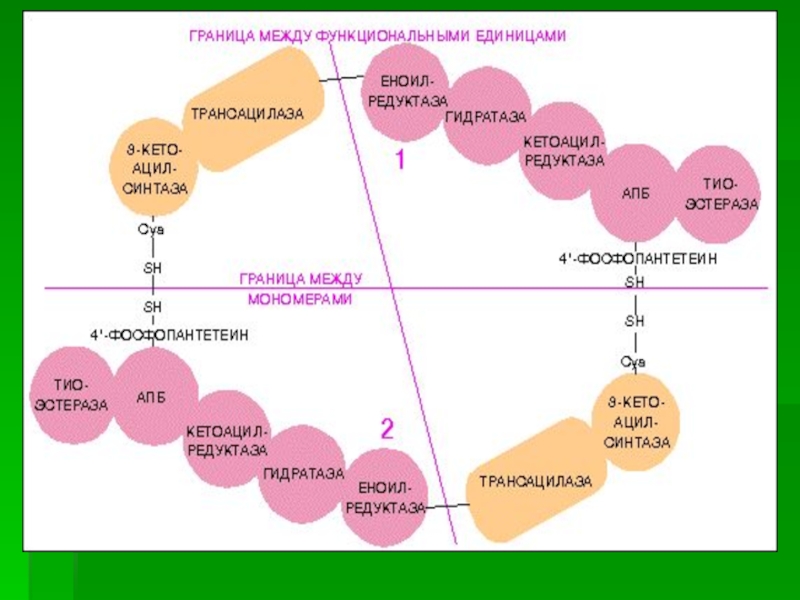
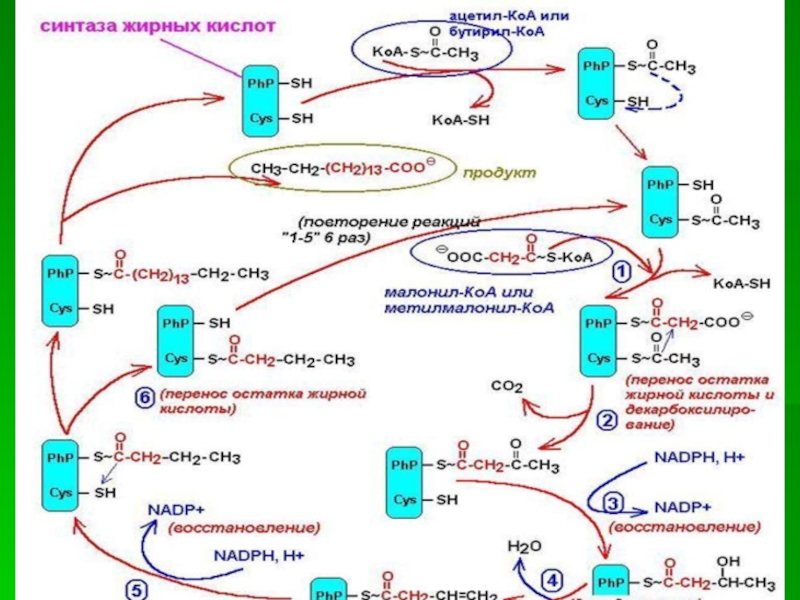
Слайд 10После образования малонил-КоА синтез жирных кислот продолжается на мультиферментном комплексе
- синтазе жирных кислот.
Этот фермент состоит из 2 идентичных
субъединиц, каждая из которых содержит 7 протомеров, обладающих разными каталитическими активностями:
1.Ацетилтрансацилаза
2.Маланилтрансацилаза
3.b-кетоацил-АПБ – синтетаза
4. b-кетоацил-АПБ – редуктаза
5. b-оксиацил-АПБ – дегидрогеназа
6.Еноил-АПБ-редуктаза
7.ацилпереносящий белок (АПБ).
Слайд 14Суммарная реакция :
Ацетил-КоА+7 Малонил-КоА +14 НАДФН2 = ПК+7СО2+7 Н2О +
8 HSKoA +14 НАДФ+
Слайд 18Каждый мономер содержит все каталитические центры, функционально активен комплекс из
2 протомеров.
Поэтому реально синтезируются одновременно 2 жирных кислоты.
Для
упрощения в схемах обычно изображают последовательность реакций при синтезе одной молекулы кислоты.
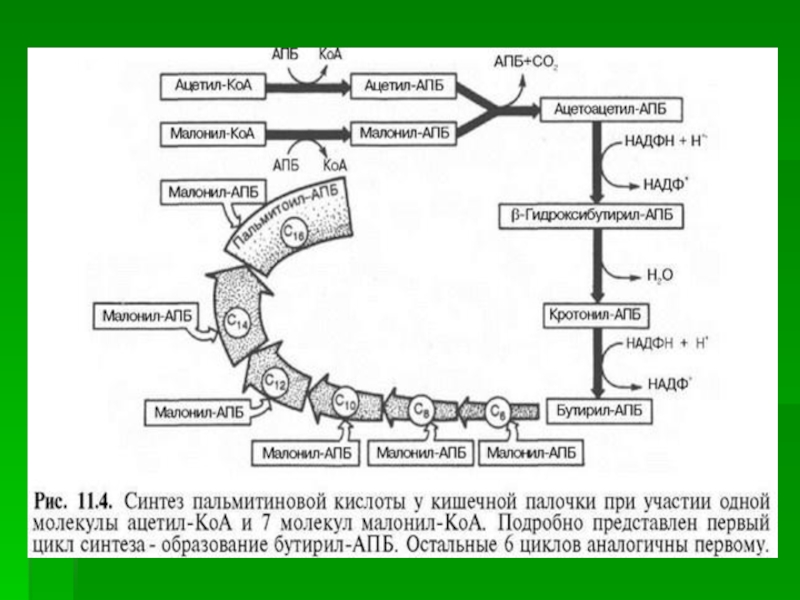
Слайд 19Этот комплекс последовательно удлиняет радикал жирной кислоты на 2 углеродных
атома, донором которых служит малонил-КоА.
Конечный продукт работы этого комплекса
- пальмитиновая кислота.
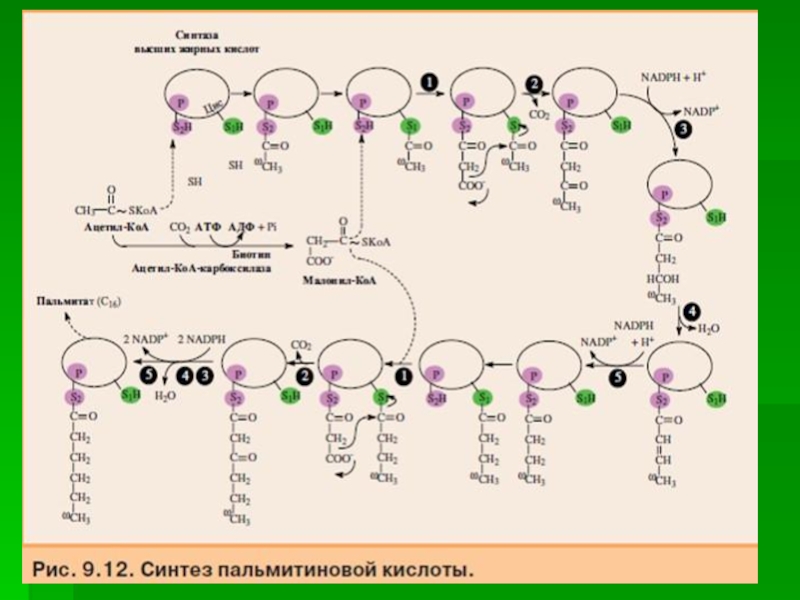
Слайд 20Первая реакция - перенос ацетильной группы ацетил-КоА на тиоловую группу
цистеина ацетилтрансацилазным центром.
Затем от малонил-КоА остаток малонила переносится на
сульфгидрильную группу ацилпереносящего белка малонилтрансацилаз-ным центром.
После этого комплекс готов к первому циклу синтеза.
Слайд 21Ацетильная группа конденсируется с остатком малонила по месту отделившегося СО2.
Реакция катализируется кетоацилсинтазным центром.
Слайд 22Образовавшийся радикал ацетоацетила последовательно восстанавливается кетоацилредуктазой, затем дегидратируется и опять
восстанавливается еноилредуктазой - активными центрами комплекса.
В результате первого цикла
реакций образуется радикал бутирила, связанный с субъединицей синтазы жирных кислот.
Слайд 23Перед вторым циклом радикал бутирила переносится туда, где находился ацетил
в начале первого цикла реакций.
Затем остаток бутирила подвергается тем
же превращениям и удлиняется на 2 углеродных атома, происходящих из малонил-КоА.
Слайд 24Аналогичные циклы реакций повторяются до тех пор, пока не образуется
радикал пальмитиновой кислоты.
Под действием тиоэстеразного центра радикал пальмитиновой кислоты
гидролитически отделяется от ферментного комплекса, превращаясь в свободную пальмитиновую кислоту.
Слайд 25Суммарное уравнение синтеза пальмитиновой кислоты из ацетил-КоА и малонил-КоА:
CH3-CO-SKoA
+ 7 HOOC-CH2-CO-SKoA + 14 (NADPH + H+)
C15H31COOH + 7 СО2 + 6 Н2О +
8 HSKoA + 14 NADP+
Слайд 27Основные источники водорода для синтеза жирных кислот
В каждом цикле
биосинтеза пальмитиновой кислоты проходят 2 реакции восстановления,
донором водорода в
которых служит кофермент NADPH.
Восстановление NADP+ происходит в реакциях:
дегидрирования в окислительных стадиях пентозофосфатного пути катаболизма глюкозы;
дегидрирования малата малик-ферментом;
дегидрирования изоцитрата цитозольной NADP-зависимой дегидрогеназой.
Слайд 28Общая схема реакций синтеза
пальмитиновой кислоты
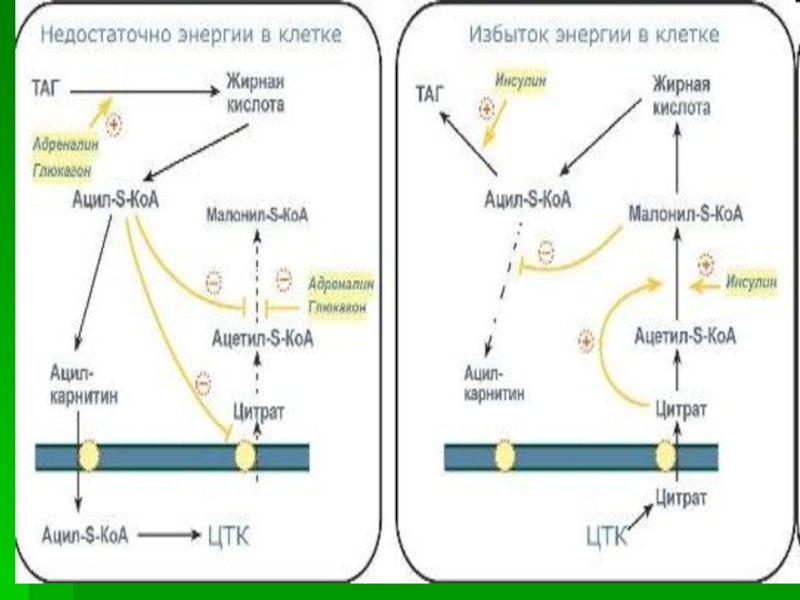
Слайд 29Регуляция синтеза жирных кислот
Регуляторный фермент - ацетил-КоА-карбоксилаза.
Ассоциация/диссоциация комплексов
субъединиц фермента. В неактивной форме ацетил-КоА-карбоксилаза представляет собой отдельные комплексы,
каждый из которых состоит из 4 субъединиц. Активатор фермента - цитрат стимулирует объединение комплексов, в результате чего активность фермента увеличивается. Ингибитор - пальмитоил-КоА вызывает диссоциацию комплекса и снижение активности фермента.
Слайд 30Фосфорилирование/дефосфорилирование ацетил-КоА-карбоксилазы.
В постабсорбтивном состоянии или при физической работе глюкагон/адреналин
через аденилат-циклазную систему активируют протеинкиназу А и стимулируют фосфорилирование субъединиц
ацетил-КоА карбоксилазы. Фосфорилированный фермент неактивен, и синтез жирных кислот останавливается.
В абсорбтивный период инсулин активирует фосфатазу, и ацетил-КоА карбоксилаза переходит в дефосфорилированное состояние.
Слайд 31Длительное потребление богатой углеводами и бедной жирами пищи приводит к
увеличению секреции инсулина, который стимулирует индукцию синтеза ферментов: ацетил-КоА-карбоксилазы, синтазы
жирных кислот, цитратлиазы, изоцитратдегидро-геназы.
!!! Следовательно, избыточное потребление углеводов приводит к ускорению превращения продуктов катаболизма глюкозы в жиры. Голодание или богатая жирами пища приводит к снижению синтеза ферментов и, соответственно, жиров.
Слайд 35Синтез жирных кислот из пальмитиновой кислоты
В ЭР происходит удлинение
пальмитиновой кислоты с участием малонил-КоА.
Последовательность реакций сходна с той,
что происходит при синтезе пальмитиновой кислоты, однако в данном случае жирные кислоты связаны не с синтазой жирных кислот, а с КоА.
Слайд 36Ферменты могут использовать в качестве субстратов не только пальмитиновую, но
и другие жирные кислоты.
Поэтому в организме могут синтезироваться не
только стеариновая кислота, но и жирные кислоты с большим числом атомов углерода.
Слайд 37 Основной продукт элонгации в печени - стеариновая кислота (С18:0),
однако в ткани мозга образуется большое количество жирных кислот с
более длинной цепью - от С20 до С24, которые необходимы для
образования сфинголипидов и гликолипидов.
В нервной ткани происходит синтез и других жирных кислот - α-гидроксикислот.
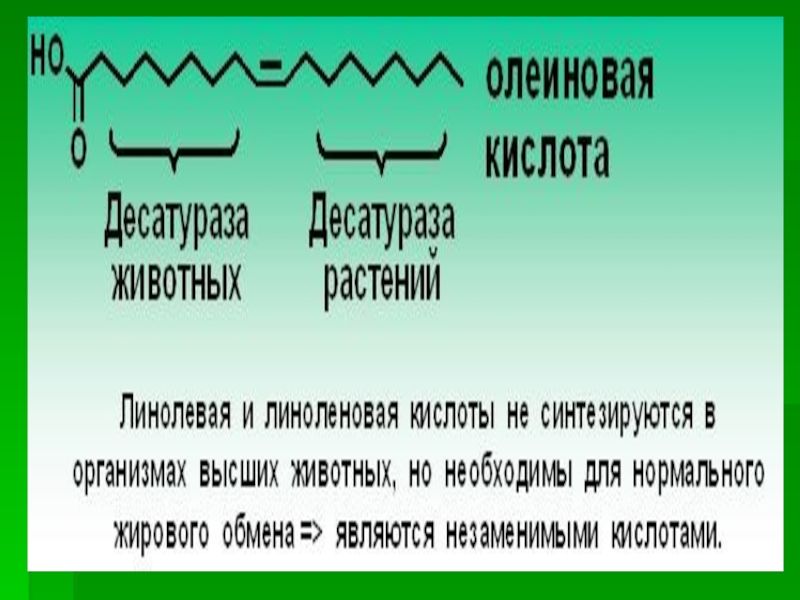
Слайд 38Включение двойных связей в радикалы жирных кислот называется десатурацией.
Основные
жирные кислоты, образующиеся в организме человека в результате десатурации, -
пальмитоолеиновая (С16:1Δ9) и олеиновая (С18:1Δ9).
Слайд 39Для образования двойной связи в радикале жирной кислоты требуется молекулярный
кислород, NADH, цитохром b5 и FAD-зависимая редуктаза цитохрома b5.
Атомы
водорода, отщепляемые от насыщенной кислоты, выделяются в виде воды.
Один атом молекулярного кислорода включается в молекулу воды, а другой также восстанавливается до воды с участием электронов NADH, которые передаются через FADH2 и цитохром b5.
Слайд 41Эйкозаноиды, включающие в себя простагландины - высокоактивные регуляторы клеточных функций.
Эйкозаноиды - биологически активные вещества, синтезируемые большинством клеток из полиеновых
жирных кислот, содержащих 20 углеродных атомов (слово "эйкоза" по - гречески означает 20).
Слайд 42
Эйкозаноиды участвуют во многих процессах: регулируют тонус ГМК и вследствие
этого влияют на АД, состояние бронхов, кишечника, матки.
Эйкозаноиды регулируют
секрецию воды и натрия почками, влияют на образование тромбов. Участвуют в развитии воспалительного процесса, происходящего после повреждения тканей или инфекции.
Слайд 43
Такие признаки воспаления, как боль, отёк, лихорадка, в значительной мере
обусловлены действием эйкозаноидов. Избыточная секреция эйкозаноидов приводит к ряду заболеваний,
например бронхиальной астме и аллергическим реакциям.
Главный субстрат для синтеза эйкозаноидов у человека - арахидоновая кислота.
Слайд 44 Реакции перекисного
окисления
липидов
Слайд 45Перекисное окисление липидов – свободнорадикальное окисление липидов, вызванное пероксидным ионом.
При изучении процессов биологического окисления рассматривается вариант короткой цепи окисления
– перекисное окисление. Кроме полезного действия (например разрушение мембран фагоцитированных микробов в лейкоцитах) при спонтанном образовании перекиси, образовавшийся пероксидный ион способен вступать в реакцию со многими молекулами. В белках окисляются некоторые аминокислоты, активные формы кислорода легко нарушают и структуру ДНК.
Слайд 46Перекисное окисление липидов
– это цепные реакции, обеспечивающие расширенное воспроизводство свободных
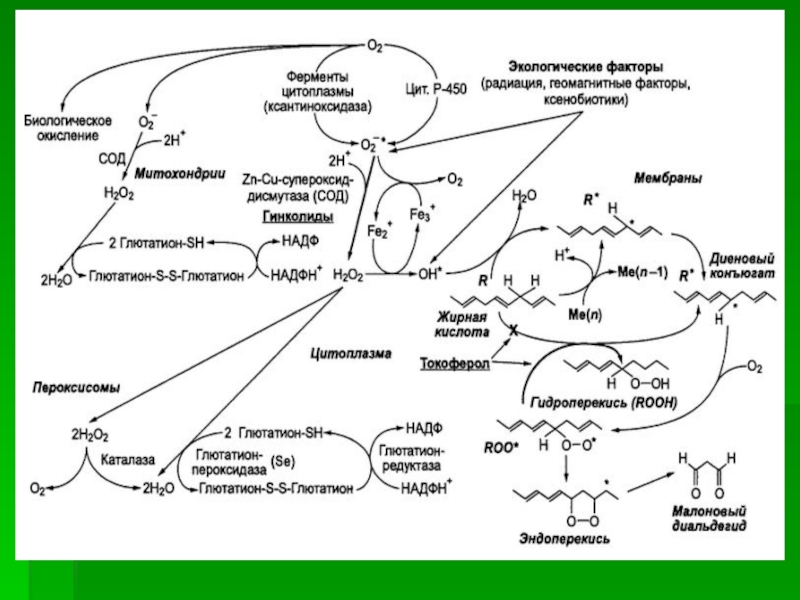
радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного
окисления. В клетке присутствует довольно развитая система защиты от перекисного окисления (антиоксидантная система), включающая ферменты, нейтрализующие перекиси и свободные радикалы (каталаза, глютатионредуктаза) и молекулы «ловушки» свободных радикалов и активных ионов (мембранная система витамина Е и селена, глютатион, аскорбиновая кислота).
Слайд 47Наиболее развита антиоксидантная система в клетках, больше подверженных окислению, где
выше парциальное давление кислорода, например, эритроциты, лейкоциты, эпителиальные клетки дыхательных
путей. При несостоятельности антиоксидантной системы перекисное повреждение липидов приводит к повреждению мембранных структур клетки, что нарушает функционирование клетки и является основным механизмом гибели клетки.
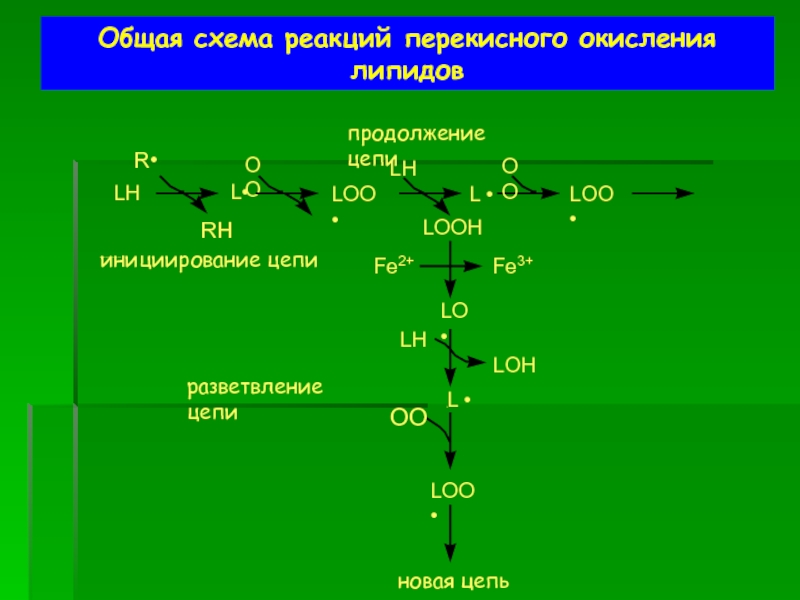
Слайд 48Общая схема реакций перекисного окисления липидов
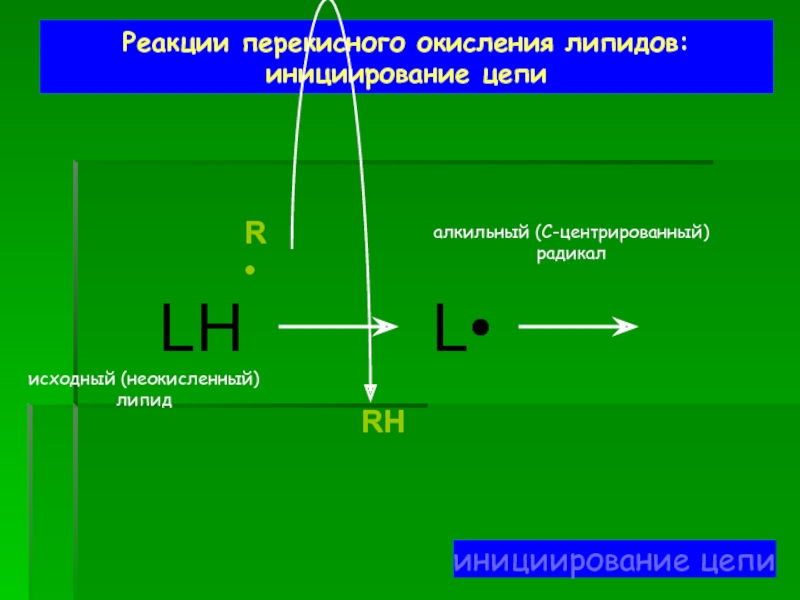
Слайд 49Реакции перекисного окисления липидов:
инициирование цепи
Слайд 50Реакции перекисного окисления липидов:
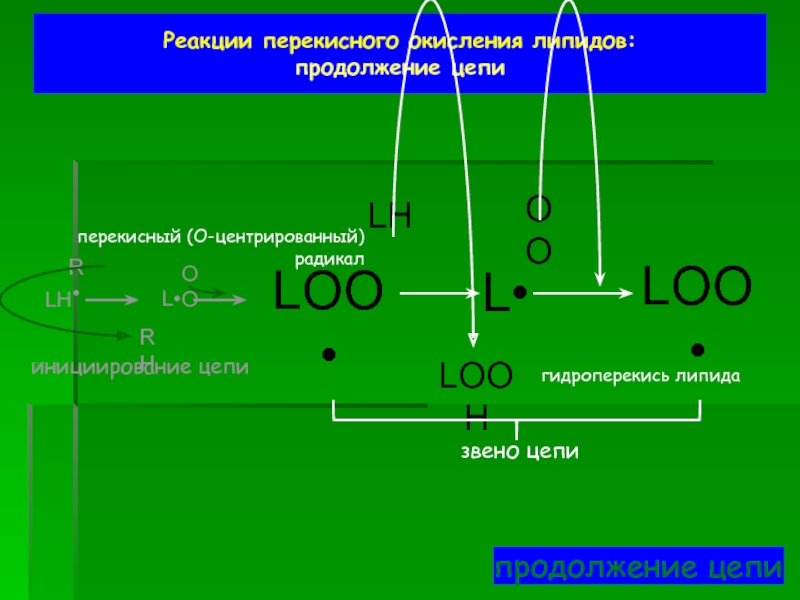
продолжение цепи
Слайд 51Реакции перекисного окисления липидов:
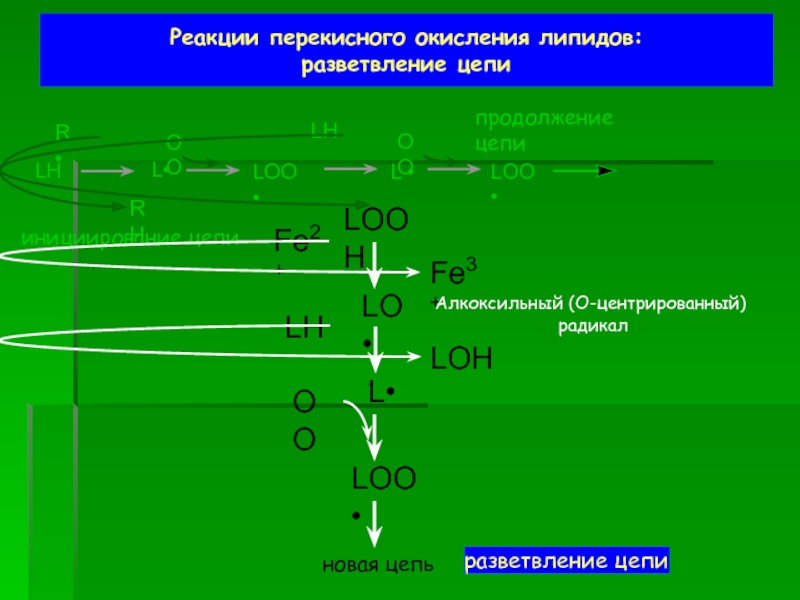
разветвление цепи
Слайд 52Реакции перекисного окисления липидов:
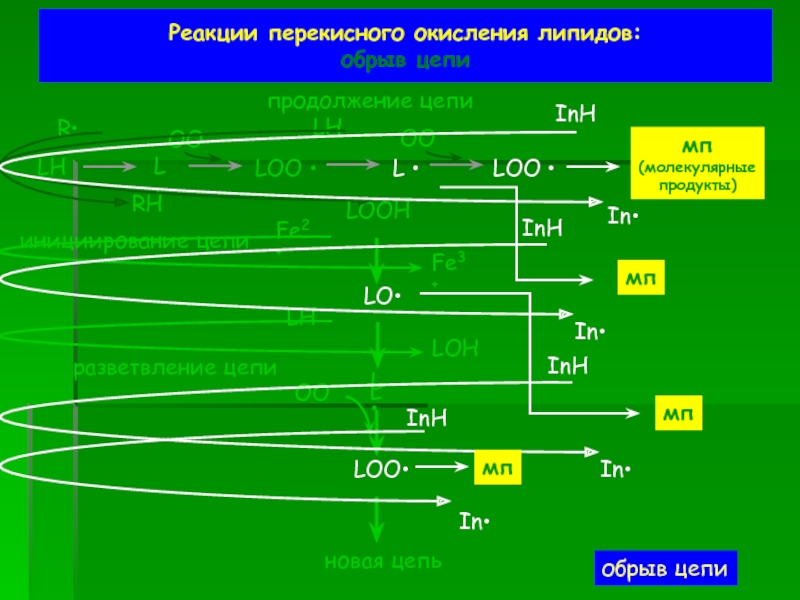
обрыв цепи
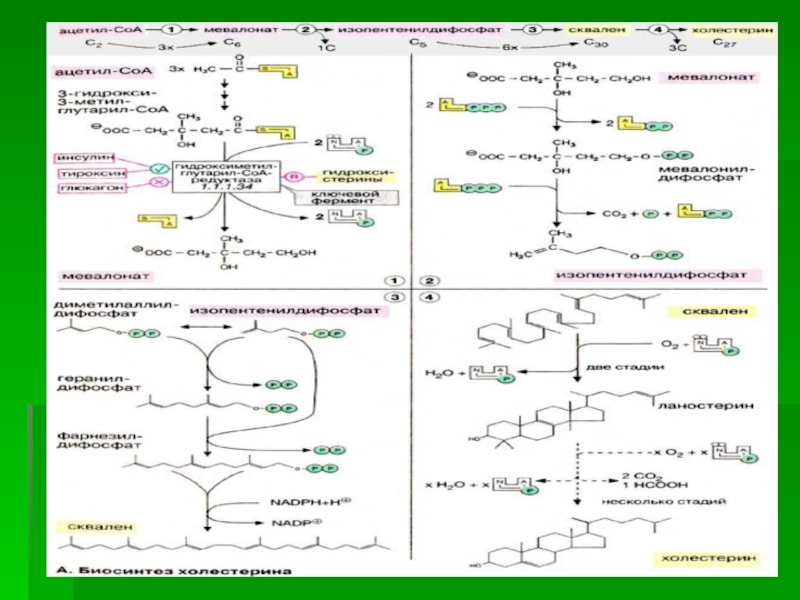
БИОСИНТЕЗ ХОЛЕСТЕРИНА
В синтезе холестерина можно выделить три основные стадии:
I – превращение активного ацетата в мевалоновую кислоту,
II – образование сквалена из мевалоновой кислоты,
III – циклизация сквалена в холестерин
стадия
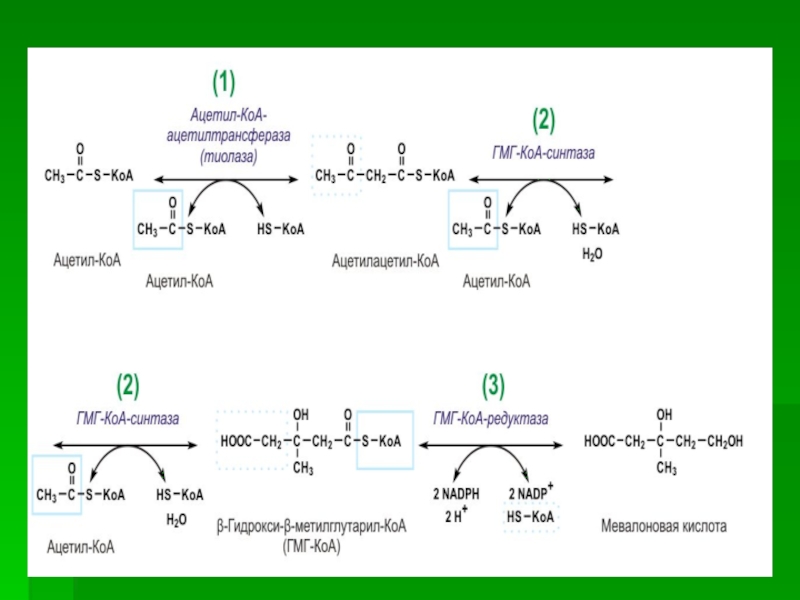
Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА является образование ацетоацетил-КоА
посредством обратимой тиолазной реакции:
Слайд 56В результате конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии
гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
Слайд 57β-Гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА- редуктаза) в
результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается
в мевалоновую кислоту:
ГМГ-КоА-редуктазная реакция – первая практически необратимая реакция в цепи биосинтеза холестерина.
Активность ГМГ-редуктазы возрастает при введении инсулина и тиреоидных гормонов. Это приводит к усилению синтеза холестерина и повышению его уровня в крови. При голодании, тиреоидэктомии, введение глюкагона и глюкокортикоидов, напротив, отмечается угнетение синтеза холестерина, что прежде всего связано со снижением активности ГМГ-КоА-редуктазы.
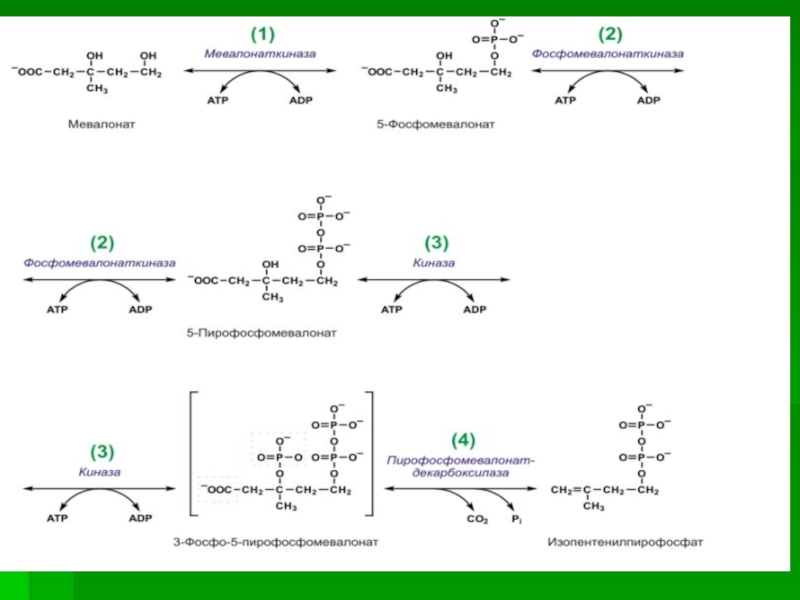
Слайд 59 II стадия
Мевалоновая
кислота превращается в сквален.
Реакции II стадии начинаются с фосфорилирования
мевалоновой кислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, затем 5-пирофосфорный эфир мевалоновой кислоты.
Мевалонат за счет декарбоксилирования с потреблением АТФ превращается в изопентенилдифосфат, который и является тем структурным элементом, из которого строятся все изопреноиды
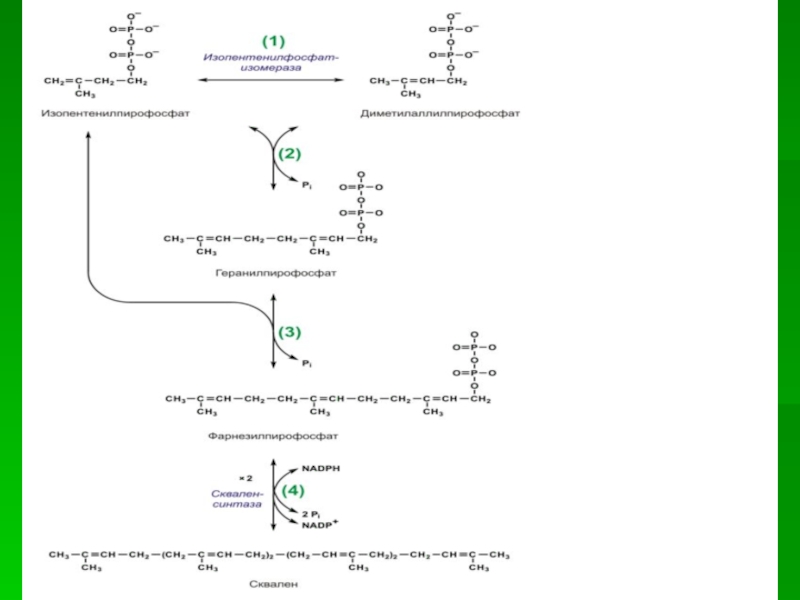
Слайд 60Оба изомерных изопентенилпирофосфата (диметилаллилпирофосфат и изопентенилпирофосфат) конденсируются с высвобождением пирофосфата
и образованием геранилпирофосфата:
Слайд 61К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется
фарнезилпирофосфат
Фарнезилдифосфат является также исходным соединением для синтеза других полиизопреноидов,
например, убихинонаубихинон
Слайд 63В заключительной реакции данной стадии в результате НАДФН-зависимой восстановительной конденсации
2 молекул фарнезилпирофосфата образуется сквален:
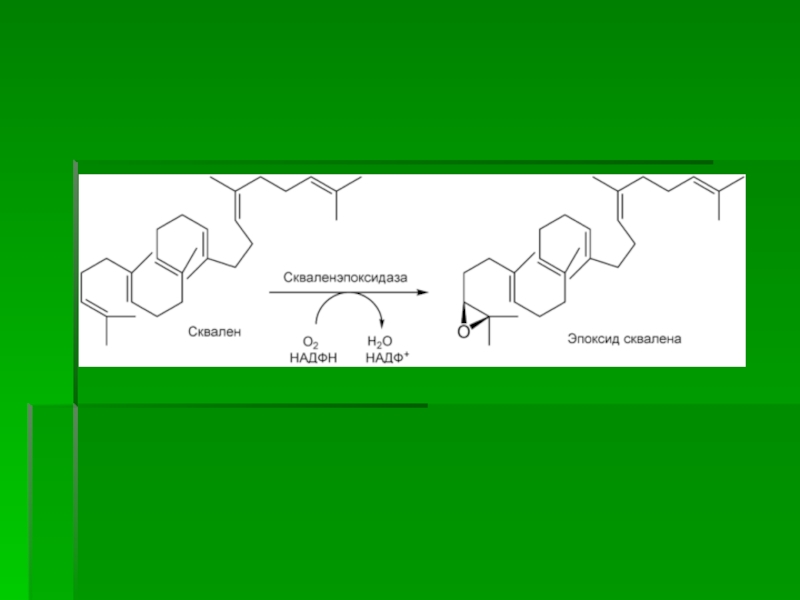
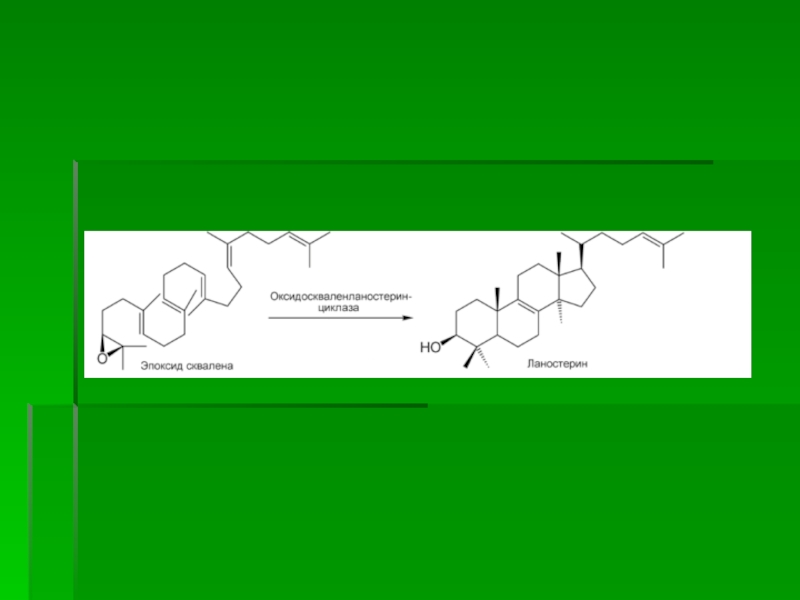
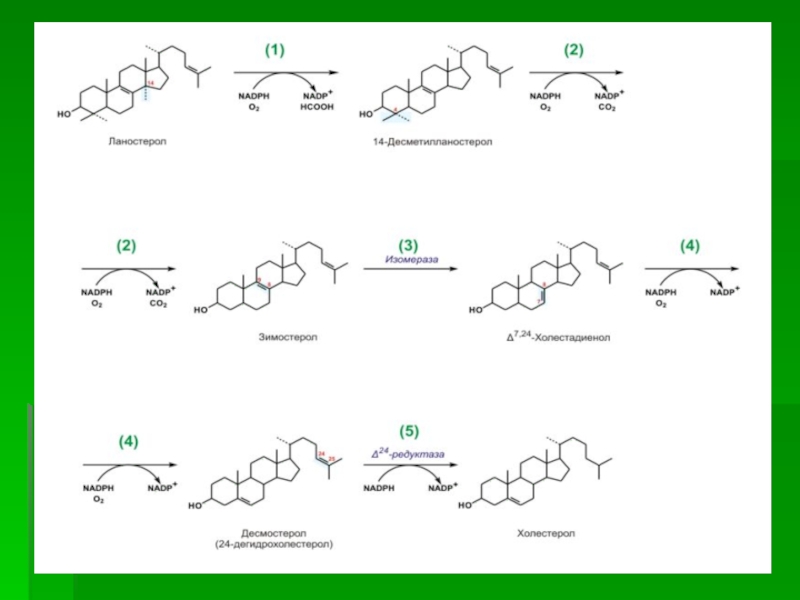
Слайд 65III стадия
Сквален, линейный изопреноид, под влиянием сквален-оксидоциклазы циклизируется с потреблением
кислорода в ланостерин, С 30 -стерин, от которого на последующих
стадиях, катализируемых цитохромом Р450, отщепляются три метильные группы, далее насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6 вследствие чего образуется конечный продукт холестерин
Слайд 69 ОБЩАЯ СХЕМА СИНТЕЗА ХОЛЕСТЕРИНА
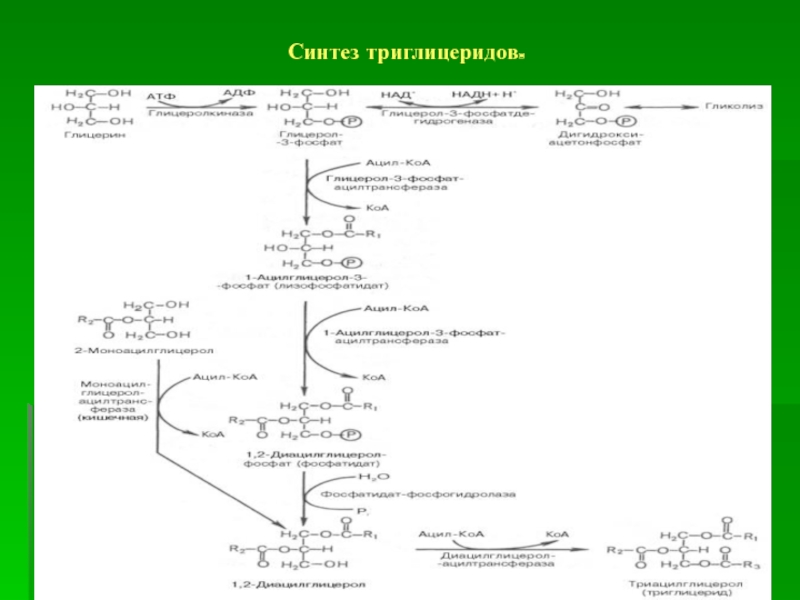
липидов в тканях осуществляют гидролитические ферменты– липазы. Три-, ди- и
моноглицеридлипазы действуют на нейтральные жиры. Фосфолипазы А1, А2, С и Д (лизосомные) расщепляют кислые фосфолипиды. В результате липолиза образуются энергетические субстраты: жирные кислоты и глицерин.
Глицерин в реакциях окисления (дегидрирования) и фосфорилирования (фосфокиназные) превращается в глицероальдегидфосфат. Далее путем глюнеогенеза из него синтезируются запасные энергетические субстраты (глюкоза, гликоген) или при гликолитическом окислении образуется энергия в виде молекул АТФ. Глицерол-3-фосфат может использоваться для синтеза собственных липидов.