Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биохимия мышечной ткани
Содержание
- 1. Биохимия мышечной ткани
- 2. СодержаниеОсновные функции мышечной системыОбщая характеристика мышечной тканиГипокинезия.
- 3. Основные функции мышечной системыдвижение, стимуляция метаболизма,генератор проприцептивной
- 4. Общая характеристика мышечной ткани35-50 % от
- 5. Относительная автономия мышечной ткани Определяется наличием:Депо субстратов (гликоген
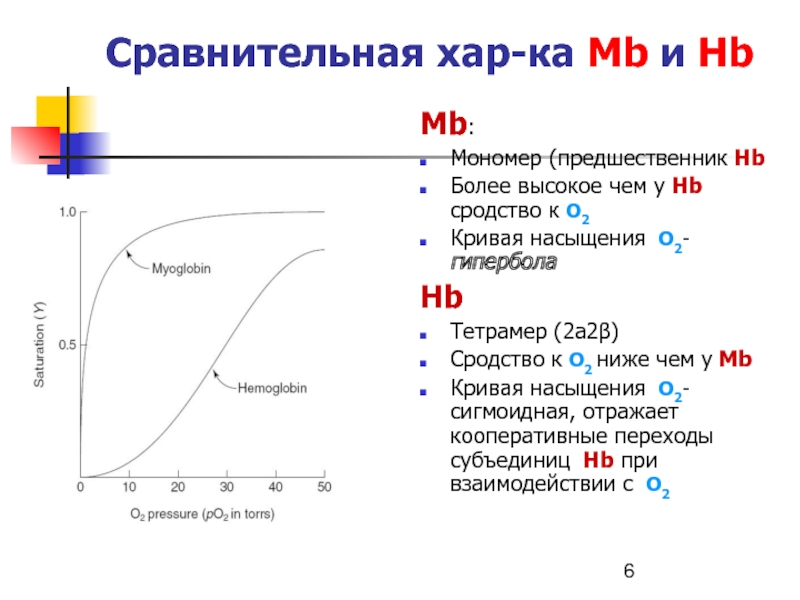
- 6. Сравнительная хар-ка Мb и НbМb:Мономер (предшественник НbБолее
- 7. Субстраты метаболизма: Гликоген мышечной тканиВ скелетных мышцах
- 8. Депо макроэргов: Креатин~фосфатВ мышцах, наряду с АТФ, имеется дополнительный энергетический резерв – креатинфосфат (КФ).
- 9. Креатин-фосфат переносчик ~
- 10. Механизмы стабилизации [АТФ]В процессе мышечного сокращения АТФ4–
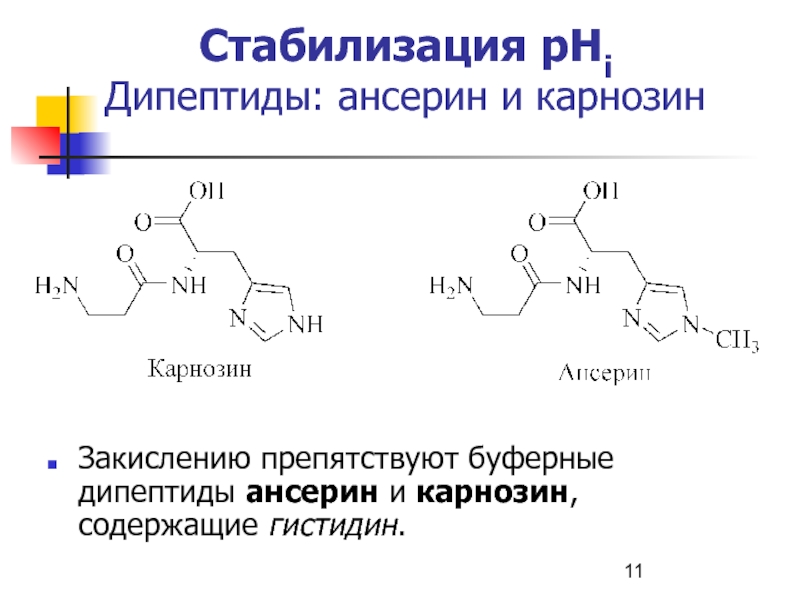
- 11. Стабилизация рНi Дипептиды: ансерин и карнозинЗакислению препятствуют буферные дипептиды ансерин и карнозин, содержащие гистидин.
- 12. ГипокинезияГипокинезия – существенное ограничение двигательной активности.Объем двигательной
- 13. Патогенез ГКС (1-й этап)Дефицит проприоцептивной информацииСтресс (как
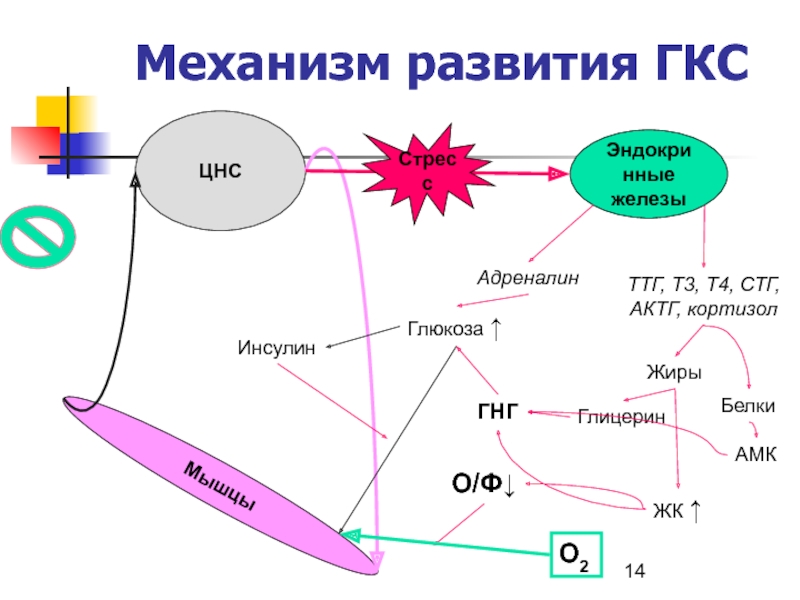
- 14. Механизм развития ГКСЦНСМышцыЭндокринныежелезыТТГ, T3, T4, СТГ, АКТГ, кортизолАдреналинСтрессГлюкоза ↑ЖирыГлицеринЖК ↑O/Ф↓O2ИнсулинГНГБелкиАМК
- 15. Патогенез ГКС (2-й этап)Увеличение потребления кислорода (гипокинетический
- 16. Патогенез ГКС (вывод)Гипокинетический синдром – диссипативный процесс,
- 17. Поперечно-полосатые мышцыСкелетные мышцыБелые мышцы (быстрые)Красные мышцы (медленные)Сердечная мышца
- 18. Скелетные мышцы (2 типа)Красные мышцы, способные к
- 19. Скелетные мышцы: белые, быстрыебольшой ∅, запас эндогенный
- 20. Скелетные мышцы: красные, медленныеМалый ∅, хорошо кровоснабжаются,
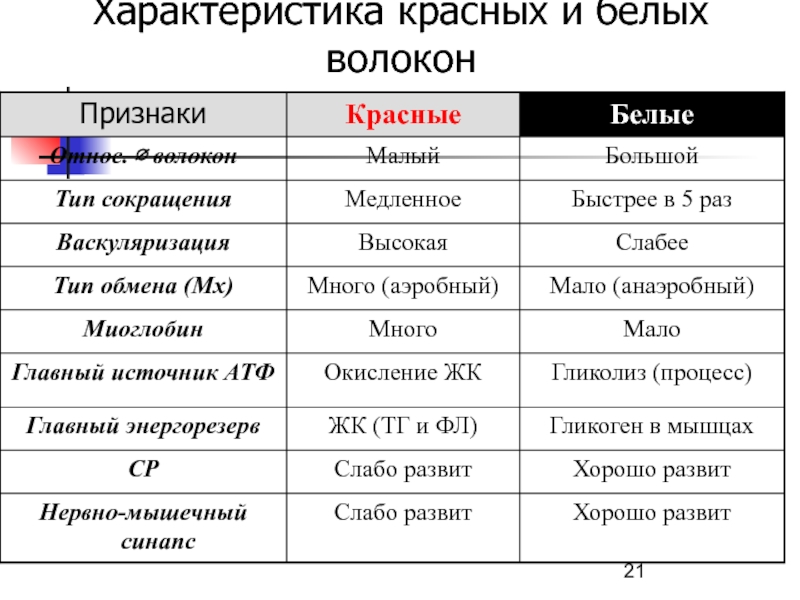
- 21. Характеристика красных и белых волокон
- 22. Сердечная мышцаСочетают свойства обоих волоконЗначительное количество Мх
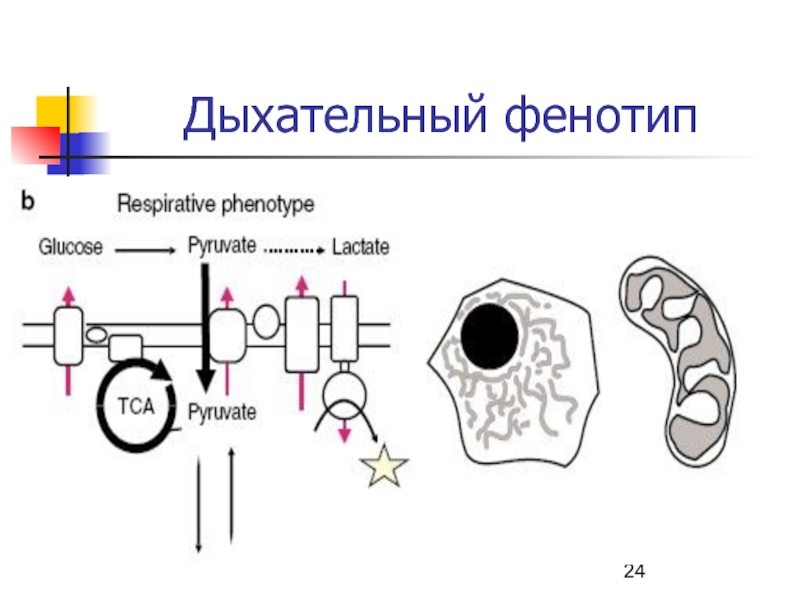
- 23. Особенности биохимии миокардаАэробный фенотип метаболизма - Аэробная
- 24. Дыхательный фенотип
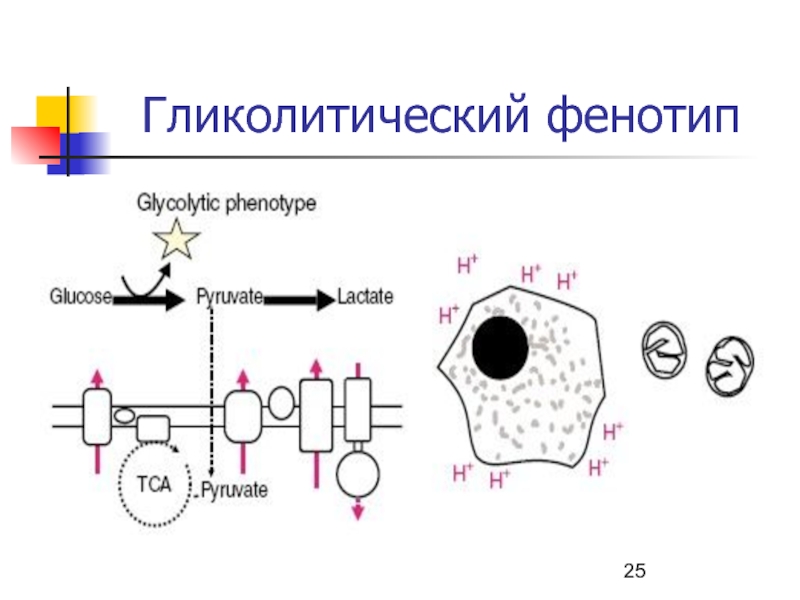
- 25. Гликолитический фенотип
- 26. Субстраты метаболизмаМышечная ткань использует разные субстраты метаболизма:
- 27. Субстраты метаболизма: лактат, аланин, циклы Кори и
- 28. Субстраты метаболизма: БелкиМышечные белки также могут использоваться
- 29. Энергетический метаболизм мышцПри интенсивной мышечной работе:АТФ4- → АДФ3- + Фн2- + H+актомиозин проявляет свойства АТФ-азы;
- 30. Энергетический метаболизм мышц (прод.)Скорость гидролиза АТФ превышает
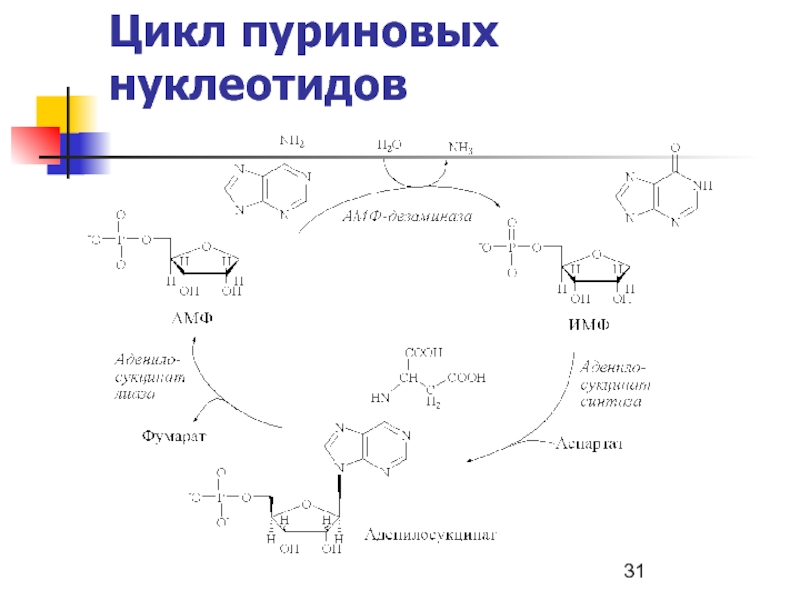
- 31. Цикл пуриновых нуклеотидов
- 32. Энергетический метаболизм мышц (прод.)Выделяющийся аммиак должен элиминировать
- 33. Метаболизм АКРУЦ в мышцахМышцы – наиболее важный
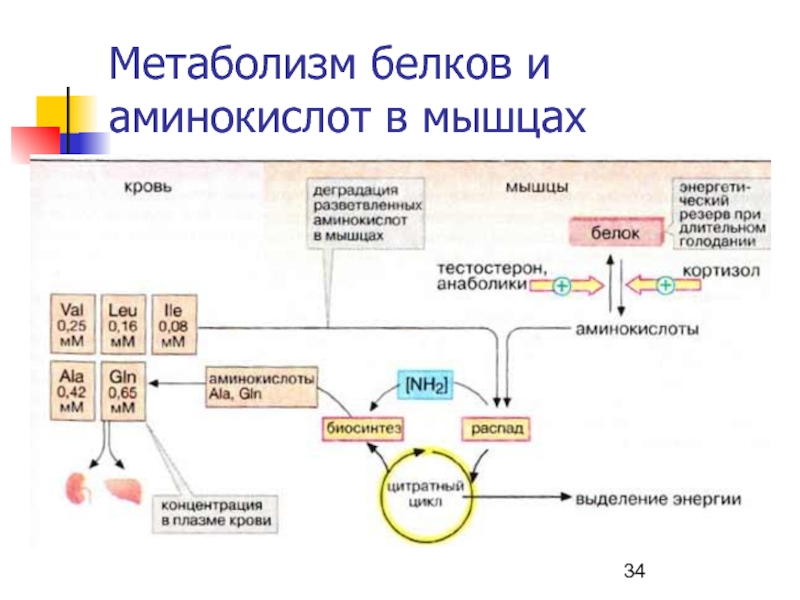
- 34. Метаболизм белков и аминокислот в мышцах
- 35. Пути утилизации АТФ в мышцеЭлектрическая работа составляющая
- 36. Электромеханическое сопряжение (ЭМС)ЭМС - преобразование нервного импульса
- 37. Ca2+ - фактор ЭМСКальмодулин (КМ) консервативный белок
- 38. Механизм ЭМСβαNa+Na+Ca2+(out)Ca2+(in)ЦТКАТФАДФ + ФнCa2+/КМTnCTnITnTTMАктинМиозинАктомиозинцАМФIP3ТГЖКГликогенГлАц-КоАПВКСРCa2+K+K+Δψ↓адреналинМхO2ОАДЦH2OCO2АТФАДФ + ФнNa+-K+- АТФазаPKCPKA
- 39. Ригорный комплекс (трупное окоченение)Ригорный комплекс образуется в
- 40. Мышечные белкиМышцы содержат уникальный набор белков, которые
- 41. Другая классификация мышечных белков Белки саркомеров: белки
- 42. АктинДлинный, закрученный белок (фибриллярный актин, F-актин) составленный
- 43. Актин (продолжение)Связывание АТФ мономером G-актина вызывает полимеризацию
- 44. Строение тонкого филаментаТонкие филаменты состоят из:Спирали F-актинаТропомиозина
- 45. МиозинМолекула миозина состоит из 6 полипептидных цепей:двух
- 46. Myosin (cont’d)The heavy chains have long α-helical
- 47. Light and Heavy MeromyosinesThe myosin molecule can
- 48. Domains of the MyosinMyosin exhibits aspects of
- 49. Общее строение скелетных мышцСкелетные поперечнополосатые мышцы состоят
- 50. Muscle Fiber StructureMyofibrils have thin filaments composed
- 51. Строение мышечной клеткиПоперечные трубочки (Т-трубочки) – впячивания
- 52. Транспорт Ca2+ в СР
- 53. Release and recovery of Ca2+ ions by
- 54. Потенциал-зависимые Ca2+ каналы (дигидропиридиновые рецепторы, DHPR)Олигомеры –
- 55. Нифедипин Нифедипин с высоким сродством связывается с DHPR T-трубочек.
- 56. Патологии DHPRГипокалиемический периодический паралич;Предрасположенность к тиротоксическому периодическому параличу;Предрасположенность к злокачественной гипертермии.
- 57. Ca2+ каналы – рианодиновые рецепторыCa2+-каналы саркоплазматического ретикулума
- 58. РианодинРианодин – растительный алкалоид, связывается с RYR и модулирует его действие.
- 59. Строение RYR
- 60. Патологии RYRRYR1:Предрасположенность к злокачественной гипертермии; Миопатии с
- 61. Ryanodine Receptor 1 (RYR1)5,032-amino acid protein; molecular
- 62. Central Core DiseaseCentral core disease is characterized
- 63. Ryanodine Receptor 2 (RYR2)The channel is a
- 64. Ryanodine Receptor 3 (RYR3)Last time it was
- 65. КальсеквестринКальсеквестрин (CASQ) – кислый гликопротеин, находящийся в
- 66. Патологии кальсеквестринаМиссенс-мутация в гене CASQ2 – причина
- 67. КальмитинКальмитин – митохондриальный кальций-связывающий белок, специфичный для
- 68. Остальные белки мышцОсновные белки мышц:Миозин и актин
- 69. Белки, связанные с миозином3 основных белка, находящихся
- 70. Остальные белки, связанные с миозиномБелок C (135
- 71. Белки, связанные с актиномКроме тропомиозина и тропонинов
- 72. Строение актининовα-Актинин – гомодимер из антипараллельных субъединиц.
- 73. Роль актининов и паратропомиозинаПовторы в α–актинине гомологичны
- 74. Регуляция мышечного сокращения кальцием
- 75. Динамика тайтинаБольшие филаменты тайтина и небулина остаются связанными с толстыми и тонкими филаментами при мышечном сокращении.
- 76. Система филаментов тайтин-небулинНити тайтина прикреплены к Z-диску
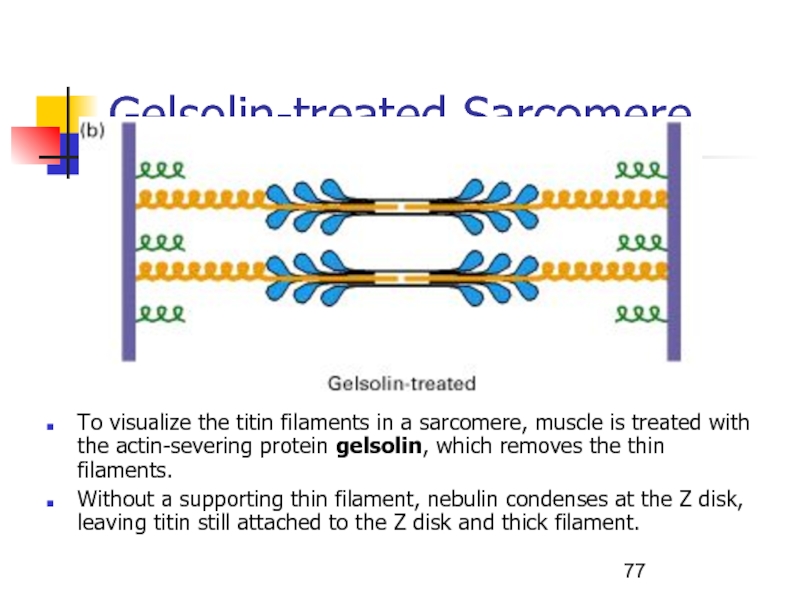
- 77. Gelsolin-treated SarcomereTo visualize the titin filaments in
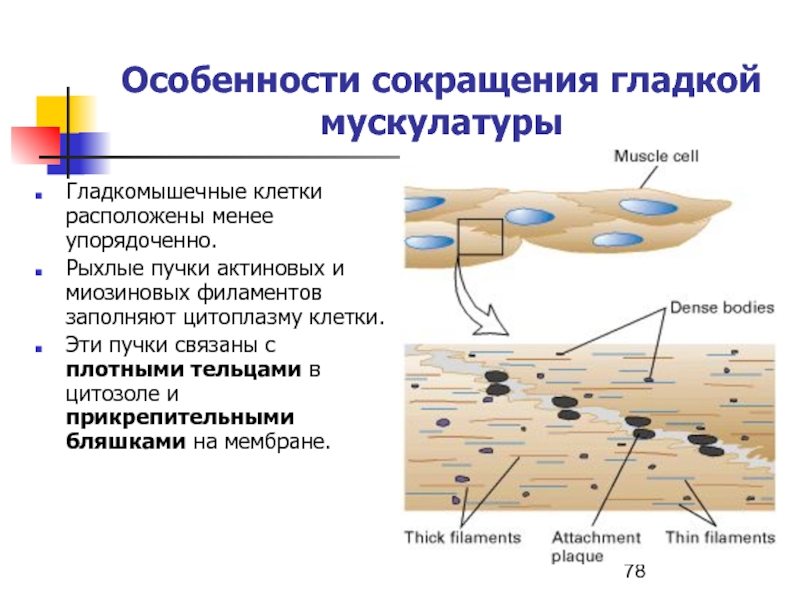
- 78. Особенности сокращения гладкой мускулатурыГладкомышечные клетки расположены менее
- 79. Сокращение гладких мышцПусковой механизм в сокращении гладких
- 80. Биохимические основы развития сердечной недостаточности (СН)Нарушение энергетического
- 81. Разобщение дыхания и фосфорилированияПоступление Ca2+ в МХ
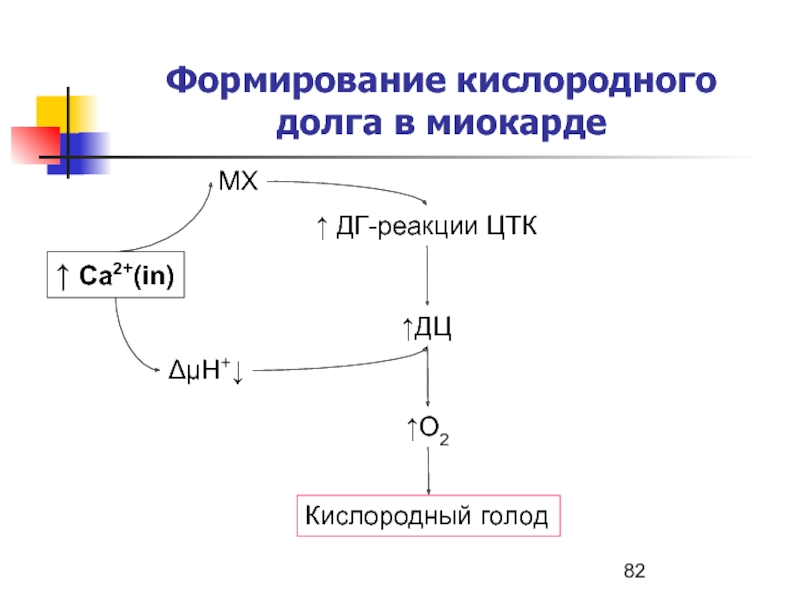
- 82. Формирование кислородного долга в миокарде↑ Ca2+(in)МХ↑ ДГ-реакции ЦТКΔμH+↓↑ДЦ↑О2Кислородный голод
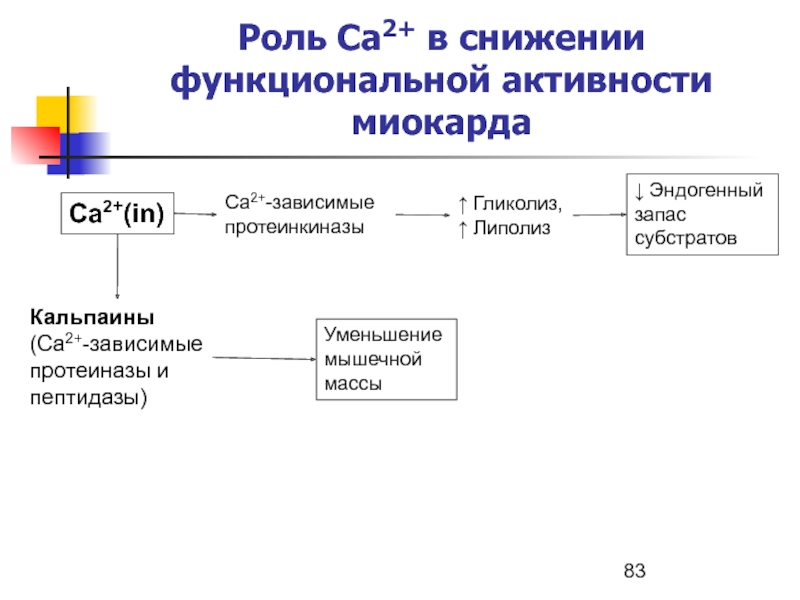
- 83. Роль Ca2+ в снижении функциональной активности миокардаCa2+(in)Кальпаины(Ca2+-зависимые
- 84. Последовательность развития СНПри сердечной недостаточности (СН):Слабая мышечная
- 85. Биохимические основы коррекции СН (1)Аэрация миокардаНормализация кровообращенияНормализация
- 86. Биохимические основы коррекции СН (2)Препараты, увеличивающие уровень
- 87. Воздействие 137Cs на энергетический метаболизм мышечной ткани
- 88. Воздействие 137Cs на
- 89. ↑ Образование АФКАктивация ПОЛОбразование лизоформ СЖК и
- 90. Слайд 90
- 91. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Биохимия мышечной ткани и миокарда
Кафедра биохимии
Лектор профессор Грицук А.И.
для студентов
2-го курса
Слайд 2Содержание
Основные функции мышечной системы
Общая характеристика мышечной ткани
Гипокинезия. Механизм развития ГКС
Поперечно-полосатые
мышцы
Скелетные мышцы (2 типа)
Сердечная мышца
Особенности биохимии миокарда
Двигательная функция
Субстраты метаболизма
Энергетический резерв:
КреатинфосфатЭнергетический метаболизм мышц
Дипептиды: ансерин и карнозин
Цикл пуриновых нуклеотидов
Пути утилизации АТФ в мышце
Электромеханическое сопряжение
Механизм электромеханического сопряжения
Ca2+ - ключевой элемент электромеханического сопряжения
Ригорный комплекс (трупное окоченение)
Мышечные белки
Актин
Строение тонкого филамента
Миозин
Общее строение скелетных мышц. Строение мышечной клетки
Транспорт Ca2+ в СР
Потенциал-зависимые Ca2+ каналы (дигидропиридиновые рецепторы, DHPR)
Нифедипин
Патологии DHPR
Ca2+ каналы – рианодиновые рецепторы
Рианодин
Строение RYR
Патологии RYR
Кальсеквестрин
Кальмитин
Патологии кальсеквестрина
Остальные белки мышц
Белки, связанные с миозином
Белки, связанные с актином
Строение актининов
Роль актининов и паратропомиозина
Динамика тайтина
Система филаментов тайтин-небулин
Особенности сокращения гладкой мускулатуры
Сокращение гладких мышц
Биохимические основы развития сердечной недостаточности (СН)
Разобщение дыхания и фосфорилирования
Формирование кислородного голода в миокарде
Роль Ca2+ в снижении функциональности миокарда
Последовательность событий в формировании СН
Биохимическое обоснование коррекции СН
Воздействие радионуклидов на энергетический метаболизм мышечной ткани (1)
Заключение
Слайд 3Основные функции мышечной системы
движение,
стимуляция метаболизма,
генератор проприцептивной импульсации в ретикулярную
формацию
стимуляция вегетативных функций
депо белка, электролитов и др.
Слайд 4Общая характеристика
мышечной ткани
35-50 % от массы тела
У детей –
25 %, у пожилых – 35 %
Высокий КПД: 40-50%
Относительная автономия.
Слайд 5Относительная автономия мышечной ткани
Определяется наличием:
Депо субстратов (гликоген и ЖК)
Депо О2
(окси Мb)
Депо ~ (креатин~фосфат)
Депо Са2+ (СР)
Система стабилизации [АТФ]
Система стабилизации рН
(ансерин, карнозин)Мощная АОЗ
Много БТШ
Слайд 6Сравнительная хар-ка Мb и Нb
Мb:
Мономер (предшественник Нb
Более высокое чем у
Нb сродство к О2
Кривая насыщения О2-гипербола
Нb
Тетрамер (2а2β)
Сродство к О2 ниже
чем у МbКривая насыщения О2- сигмоидная, отражает кооперативные переходы субъединиц Нb при взаимодействии с О2
Слайд 7Субстраты метаболизма: Гликоген мышечной ткани
В скелетных мышцах хранится около ¾
всего гликогена организма.
В печени – большая часть из оставшейся ¼.
Глюкоза не может выйти из мышц, так как в мышцах отсутствует фермент Г6Ф-аза.
Слайд 8Депо макроэргов: Креатин~фосфат
В мышцах, наряду с АТФ, имеется дополнительный энергетический
резерв – креатинфосфат (КФ).
Слайд 10Механизмы стабилизации [АТФ]
В процессе мышечного сокращения
АТФ4– → АДФ3– +
Фн2- + Н+
АДФ3– имеет ~ которую можно использовать в аденилаткиназной
реакции 2 АДФ3– ↔ АТФ4– + АМФ2-,
Для смещения реакции вправо АМФ2- гидролизуется АМФ-дезаминазой
АМФ2- → ИМФ + NH3
Слайд 11Стабилизация рНi
Дипептиды: ансерин и карнозин
Закислению препятствуют буферные дипептиды ансерин
и карнозин, содержащие гистидин.
Слайд 12Гипокинезия
Гипокинезия – существенное ограничение двигательной активности.
Объем двигательной активности за последние
100 лет уменьшился в 20 раз.
Последствия гипокинезии сказываются практически на
всех органах – гипокинетический синдром (ГКС).Слайд 13Патогенез ГКС (1-й этап)
Дефицит проприоцептивной информации
Стресс (как реакция организма на
недостаток проприоцептивной информации)
Эффекты континсулярных гормонов: катехоламинов, T3, T4, глюкокортикоидов и
др.Активация протеолиза, липолиза, ГНГ
Увеличение концентрации ЖК в крови
Разобщение окисления и фосфорилирования
Усиление катаболических процессов в организме
Увеличение теплопродукции
Слайд 14Механизм развития ГКС
ЦНС
Мышцы
Эндокринные
железы
ТТГ, T3, T4, СТГ,
АКТГ, кортизол
Адреналин
Стресс
Глюкоза ↑
Жиры
Глицерин
ЖК ↑
O/Ф↓
O2
Инсулин
ГНГ
Белки
АМК
Слайд 15Патогенез ГКС (2-й этап)
Увеличение потребления кислорода (гипокинетический парадокс)
Снижение массы мышечной
ткани
протеолиз
Резорбция костной ткани, остеопороз, ухудшение минерального обмена.
снижение физ.
нагрузки, пьезоэлектроэффект.Потеря с мочой электролитов Na+, K+, Ca2+
Как следствие уменьшения количества клеток
Увеличение частоты спонтанных мутаций
Следствие высокой концентрации NADH ⇒ генерация АФК.
Слайд 16Патогенез ГКС (вывод)
Гипокинетический синдром – диссипативный процесс, вызывающий распад структуры
и превращающий ее в тепло, рассеивающееся в окружающей среде.
Слайд 17Поперечно-полосатые мышцы
Скелетные мышцы
Белые мышцы (быстрые)
Красные мышцы (медленные)
Сердечная мышца
Слайд 18Скелетные мышцы (2 типа)
Красные мышцы, способные к продолжительной деятельности.
Богаты гемопротеидами:
Хорошее кровоснабжение – гемоглобин.
Запас кислорода – миоглобин.
Большое количество
митохондрий – цитохромы. Преобладает аэробный метаболизм, главный энергоресурс – окисление ЖК.
Белые мышцы, функционирующие в импульсном режиме (недолго и быстро).
Главный энергоресурс – запасы гликогена, анаэробный гликолиз.
Слайд 19 Скелетные мышцы: белые, быстрые
большой ∅, запас эндогенный субстратов (гликоген, креатинфосфат),
хорошо развит саркоплазматический ретикулум (СР),
основной энергетический процесс – анаэробный
гликолизСлайд 20Скелетные мышцы: красные, медленные
Малый ∅, хорошо кровоснабжаются, много митохондрий, СР
менее развит, активна Ca2+-АТФаза, запасы эндогенного субстрата – жир (ТГ),
Энергообеспечение – аэробные процессы
Слайд 22Сердечная мышца
Сочетают свойства обоих волокон
Значительное количество Мх до 25-30% объема
клетки.
Кардиомиоциты рано перестают делиться.
Очень быстрая замена белков, особенно сократительных
Полная замена
за один месяц.Слайд 23Особенности биохимии миокарда
Аэробный фенотип метаболизма - Аэробная ткань (7-20% всего
кислорода) ⇒ аэробные изоферменты.
ЛДГ1 и ЛДГ2
КФК2 (MB-изоформа).
Высокая скорость ЦТК, β-окисления
ЖК, очень низкая – анаэробного гликолиза (субсарколеммальная локализация).На сарколемме высокая активность АТФ-аз.
Энергосубстраты – ЖК, кетоновые тела глюкоза, лактат..
Особенно активно из крови миокард извлекает ненасыщенные ЖК – олеиновую кислоту.
Интенсивный метаболизм АМК ⇒ АлАТ, АсАТ.
СР развит хорошо, однако Ca2+ поступает из внеклеточной среды.
Слайд 26Субстраты метаболизма
Мышечная ткань использует разные субстраты метаболизма: глюкозу, жирные кислоты,
кетоновые тела.
Скелетные мышцы различаются по энергозатратам в зависимости от
их активности.В покоящейся мышце главным энергетическим субстратом являются жирные кислоты:
При физической нагрузке главным субстратом становится глюкоза.
Поэтому в мышцах имеется значительный запас гликогена.
Слайд 27Субстраты метаболизма: лактат, аланин, циклы Кори и Фелига
При физической нагрузке
скорость анаэробного гликолиза в мышце выше, чем ЦТК ⇒ лактат
накапливается и выходит из клеток.Другой продукт метаболизма –Ала образуется при переаминировании ПВК.
Лактат и Ала транспортируются с кровотоком в печень, где снова превращаются в глюкозу (ГНГ).
Глюкозо-лактатный цикл (Кори).
Глюкозо-аланиновый цикл (Фелига).
Слайд 28Субстраты метаболизма: Белки
Мышечные белки также могут использоваться для энергообеспечения.
Однако этот
процесс энергетически невыгоден и вреден – снижает шансы на выживаемость
организма.Поэтому катаболизм мышечных белков в нормальном состоянии минимален, увеличивается лишь в крайнем случае (напр. при голодании).
Слайд 29Энергетический метаболизм мышц
При интенсивной мышечной работе:
АТФ4- → АДФ3- + Фн2-
+ H+
актомиозин проявляет свойства АТФ-азы;
Слайд 30Энергетический метаболизм мышц (прод.)
Скорость гидролиза АТФ превышает скорость его синтеза.
АДФ накапливается, но не используется ни в каких реакциях, кроме
аденилаткиназной:2 АДФ ↔ АТФ + АМФ (миоаденилаткиназа)
В ходе аденилаткиназной реакции накапливается АМФ. Снижает его концентрацию фермент АМФ-дезаминаза:
АМФ → ИМФ + NH3
Слайд 32Энергетический метаболизм мышц (прод.)
Выделяющийся аммиак должен элиминировать в виде глн,
асн или ала.
Глу + NH3 + АТФ → Глн +
АДФ + Фн (глутамин-синтетаза)Асп + Глн → Асн + Глу (аспарагин-синтетаза)
ПВК + Глу ↔ Ала + α-кетоглутарат (аланин-аминотрансфераза)
Эти АК с кровотоком достигают печени, где используются как субстраты ГНГ. Т. обр., мышцы играют важную роль в межорганном обмене субстратами (циклы Кори и Фелига).
Слайд 33Метаболизм АКРУЦ в мышцах
Мышцы – наиболее важный участок деградации АК
с разветвленной углеводородной цепью (АКРУЦ): вал, иле, лей.
Эти соединения
катаболизируют до сукцинил-КоА (иле, вал) и ацетил-КоА (лей).Слайд 35Пути утилизации АТФ в мышце
Электрическая работа составляющая АТФ-азную активность ,
:
Na+/K+-АТФ-аза – способствует поддержанию потенциала покоя; транспорт субстратов.
Ca2+-АТФ-аза –
мышечное расслабление, Mg2+-АТФ-аза – стабилизация АТФ, и т.д.
Механическая работа – АТФ-зависимый процесс (сокращение и расслабление мышц) – (распад актомиозинового комплекса и откачивание Ca2+ из саркоплазмы)
Слайд 36Электромеханическое сопряжение (ЭМС)
ЭМС - преобразование нервного импульса (электро) в мышечное
(механическое)
сокращение
сопряжение электрики и механики
Сопрягающий
фактор ЭМС - Ca2+
Слайд 37Ca2+ - фактор ЭМС
Кальмодулин (КМ) консервативный белок связывает 4 иона
Ca2+
Ca2+in – 10-7 - 10-8 М.
Ca2+out – 10-3 М
Ca2+активирует ферменты:
ДГ
ЦТК : ПВК-ДГ, ИЦ-ДГ и α-КГДГ, МДГТриглицеридлипазу
Ca2+- КМ зависимых киназы (гладкой мускулатуры)
Слайд 38Механизм ЭМС
β
α
Na+
Na+
Ca2+(out)
Ca2+(in)
ЦТК
АТФ
АДФ
+ Фн
Ca2+/КМ
TnC
TnI
TnT
TM
Актин
Миозин
Актомиозин
цАМФ
IP3
ТГ
ЖК
Гликоген
Гл
Ац-КоА
ПВК
СР
Ca2+
K+
K+
Δψ↓
адреналин
Мх
O2
ОА
ДЦ
H2O
CO2
АТФ
АДФ + Фн
Na+-K+-
АТФаза
PKC
PKA
Слайд 39Ригорный комплекс (трупное окоченение)
Ригорный комплекс образуется в результате нарастающего дефицита
кислорода ⇒ АТФ↓ ⇒ Ca2+↑ ⇒ актомиозиновый комплекс не диссоциирует.
Через
≈2-3 часа ригорный комплекс разрушается (действие лизосомальных протеаз) ⇒ ткани мышц снова становятся мягкими.Слайд 40Мышечные белки
Мышцы содержат уникальный набор белков, которые можно разделить на
следующие группы:
Сократительные: актин и миозин.
Регуляторные:
Основные: Тропомиозин, тропонины (I, C, T)
Минорные:
Миомезин; креатинкиназа; M-, C-, F-, H-, I-белки; α-, β-, γ-актинины, филамин, паратропомиозин.Белки цитоскелета:
Тайтин-1, тайтин-2, небулин, винкулин, десмин (скелетин), виментин, синемин, Z-протеин, Z-nin, дистрофин.
Слайд 41Другая классификация мышечных белков
Белки саркомеров:
белки толстых филаментов: миозин,
связанные с миозином белки (C, F, H, I);
белки тонких
филаментов: актин (G, F), α-тропомиозин, тропонин (I, T, C), актинины (α-, β-, γ-), ABP (филамин), паратропомиозин. белки саркомерного цитоскелета: тайтин (коннектин); миомезины – белки, ассоциированные с тайтином. Белки диска Z: α-актинин, филамин, небулетте, телетонин и миотилин.
Несаркомерные белки.
Белки филаментов – десмин.
Белки микрофиламентов: γ-актин.
Белки микротрубочек – тубулин.
Белки, обеспечивающие интеграцию компонентов:
Дистрофин,
α- и β-интегрины,
винкулин, талин, тенсин, пахиллин, зиксин.
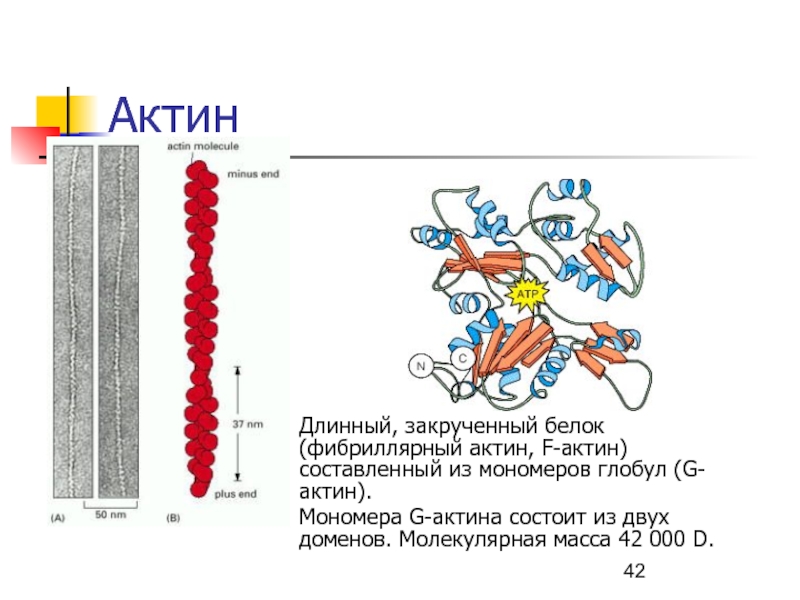
Слайд 42Актин
Длинный, закрученный белок (фибриллярный актин, F-актин) составленный из мономеров глобул
(G-актин).
Мономера G-актина состоит из двух доменов. Молекулярная масса 42
000 D. Слайд 43Актин (продолжение)
Связывание АТФ мономером G-актина вызывает полимеризацию (т.е., формирование F-актина).
АДФ, образующийся после гидролиза АТФ, остается связанным с актином.
F-актин образует
двойную спираль.Каждая субъединица актина в тонком филаменте содержит участок, способный связываться с миозином.
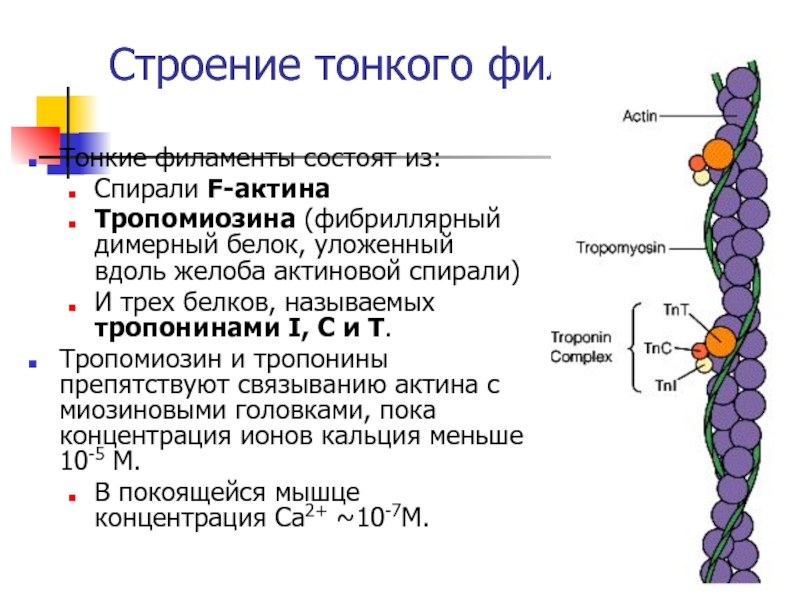
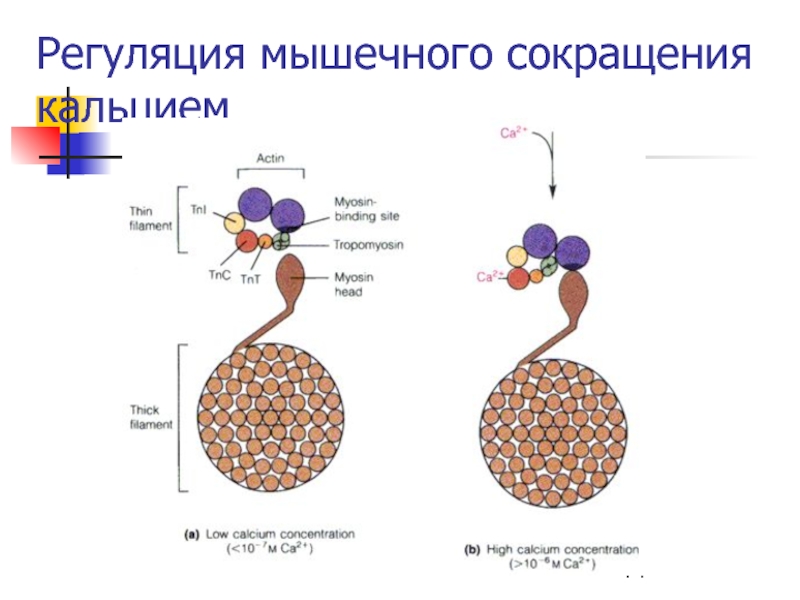
Слайд 44Строение тонкого филамента
Тонкие филаменты состоят из:
Спирали F-актина
Тропомиозина (фибриллярный димерный белок,
уложенный вдоль желоба актиновой спирали)
И трех белков, называемых тропонинами I,
C и T.Тропомиозин и тропонины препятствуют связыванию актина с миозиновыми головками, пока концентрация ионов кальция меньше 10-5 М.
В покоящейся мышце концентрация Ca2+ ~10-7M.
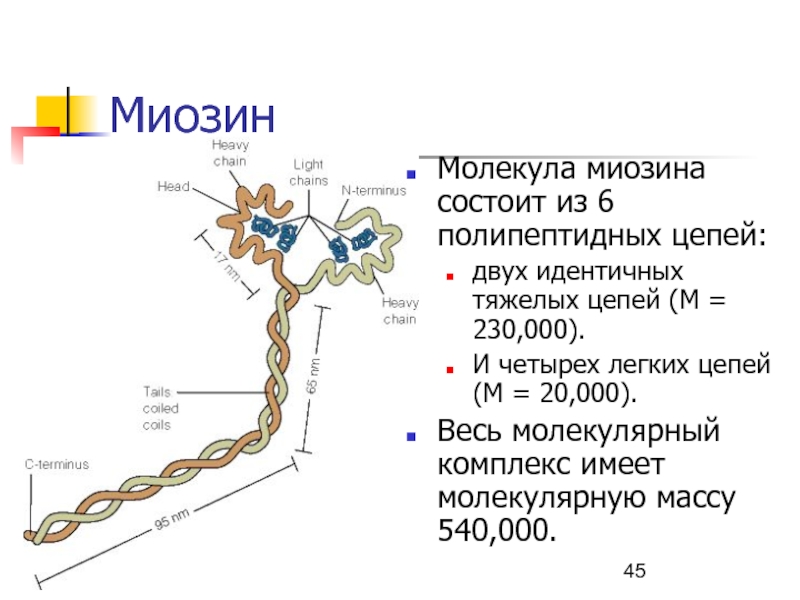
Слайд 45Миозин
Молекула миозина состоит из 6 полипептидных цепей:
двух идентичных тяжелых цепей
(M = 230,000).
И четырех легких цепей (M = 20,000).
Весь
молекулярный комплекс имеет молекулярную массу 540,000. Слайд 46Myosin (cont’d)
The heavy chains have long α-helical tails and globular
head domains.
The α-helical tails are interwound into a two-strand
coiled coil and the light chains are bound to the globular head domains. Between each head domain and tail domain is a flexible
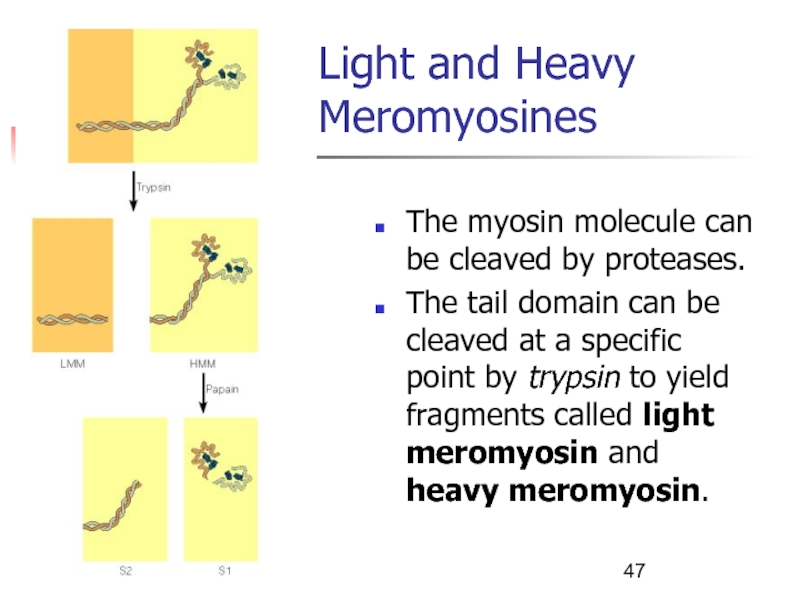
Слайд 47Light and Heavy Meromyosines
The myosin molecule can be cleaved by
proteases.
The tail domain can be cleaved at a specific
point by trypsin to yield fragments called light meromyosin and heavy meromyosin.Слайд 48Domains of the Myosin
Myosin exhibits aspects of both fibrous and
globular proteins, and its functional domains play quite different roles.
The tail domains have a pronounced tendency to aggregate, causing myosin molecules to form thick bipolar filaments.
The head domains, with their attached light chains, are often called headpieces; they have a strong tendency to bind to actin.
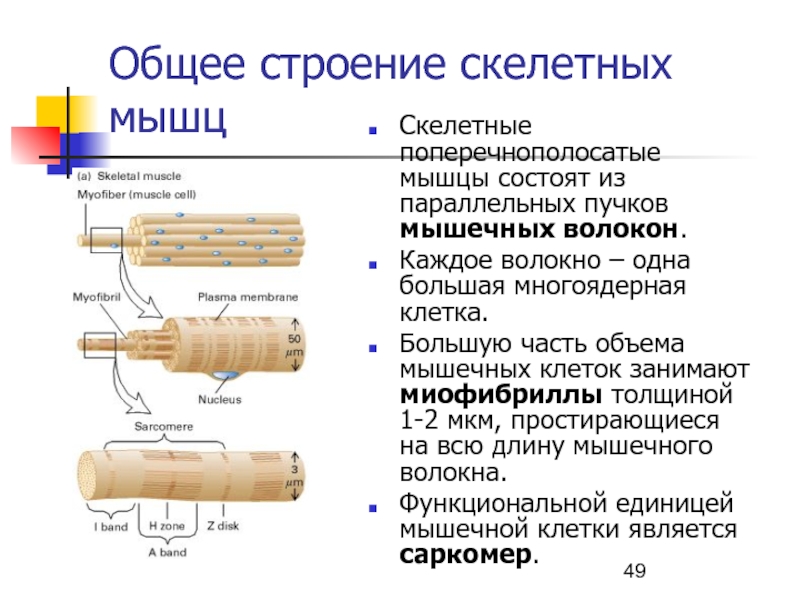
Слайд 49Общее строение скелетных мышц
Скелетные поперечнополосатые мышцы состоят из параллельных пучков
мышечных волокон.
Каждое волокно – одна большая многоядерная клетка.
Большую часть
объема мышечных клеток занимают миофибриллы толщиной 1-2 мкм, простирающиеся на всю длину мышечного волокна.Функциональной единицей мышечной клетки является саркомер.
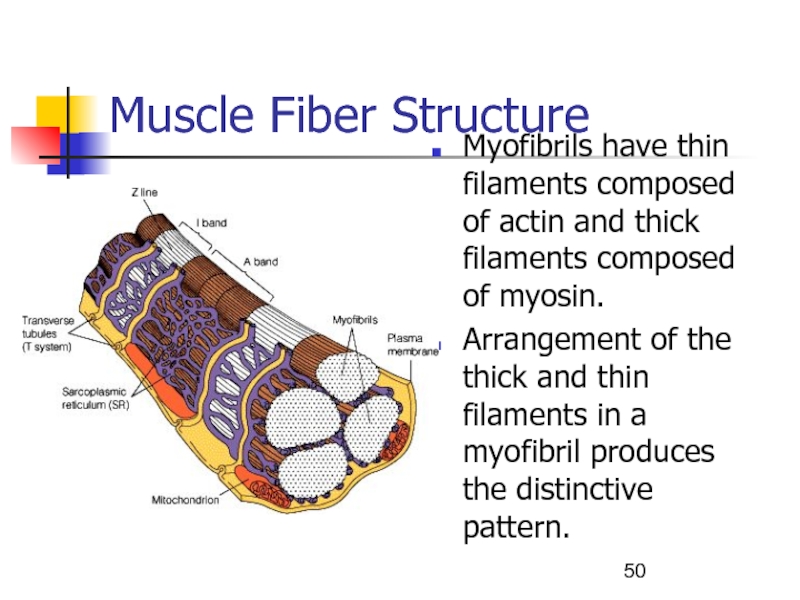
Слайд 50Muscle Fiber Structure
Myofibrils have thin filaments composed of actin and
thick filaments composed of myosin.
Arrangement of the thick and
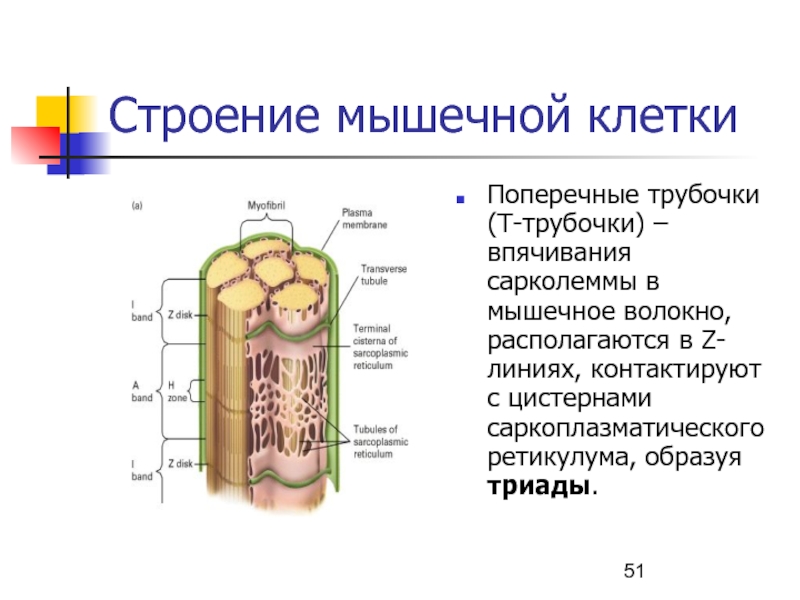
thin filaments in a myofibril produces the distinctive pattern.Слайд 51Строение мышечной клетки
Поперечные трубочки (Т-трубочки) – впячивания сарколеммы в мышечное
волокно, располагаются в Z-линиях, контактируют с цистернами саркоплазматического ретикулума, образуя
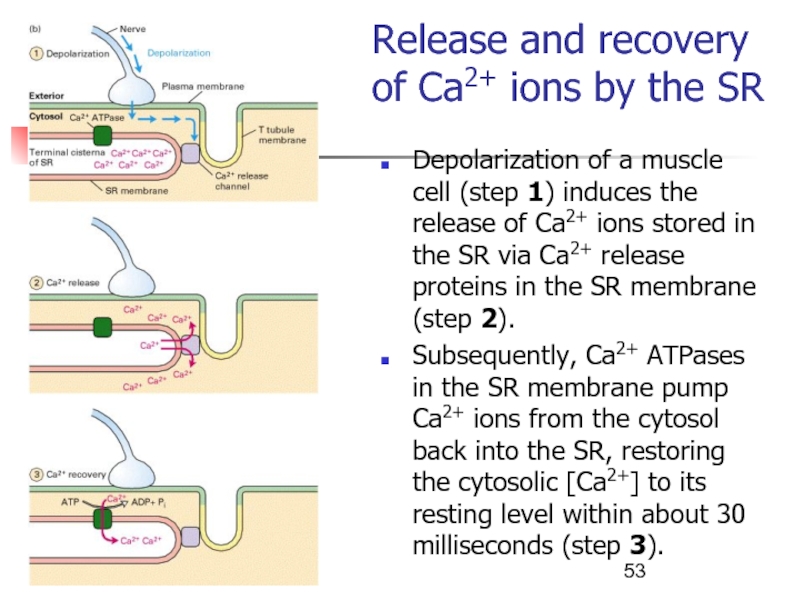
триады.Слайд 53Release and recovery of Ca2+ ions by the SR
Depolarization of
a muscle cell (step 1) induces the release of Ca2+
ions stored in the SR via Ca2+ release proteins in the SR membrane (step 2).Subsequently, Ca2+ ATPases in the SR membrane pump Ca2+ ions from the cytosol back into the SR, restoring the cytosolic [Ca2+] to its resting level within about 30 milliseconds (step 3).
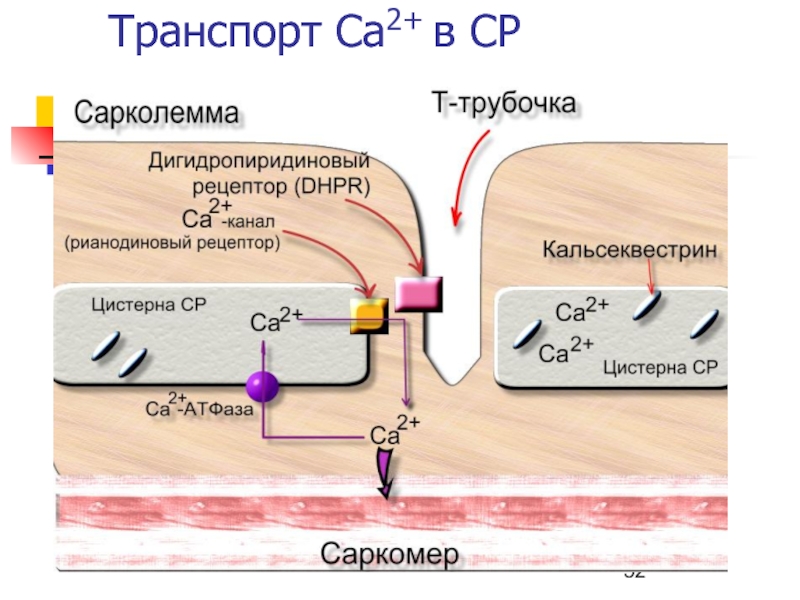
Слайд 54Потенциал-зависимые Ca2+ каналы (дигидропиридиновые рецепторы, DHPR)
Олигомеры – 2 большие субъединицы
(α-1 и α-2) и 3 малые (β, γ, и δ)
Выполняют
ключевую роль в электромеханическом сопряжении.Чувствительны к блокаторам кальциевых каналов (1,4-дигидропиридины - нифедипин).
Слайд 56Патологии DHPR
Гипокалиемический периодический паралич;
Предрасположенность к тиротоксическому периодическому параличу;
Предрасположенность к злокачественной
гипертермии.
Слайд 57Ca2+ каналы – рианодиновые рецепторы
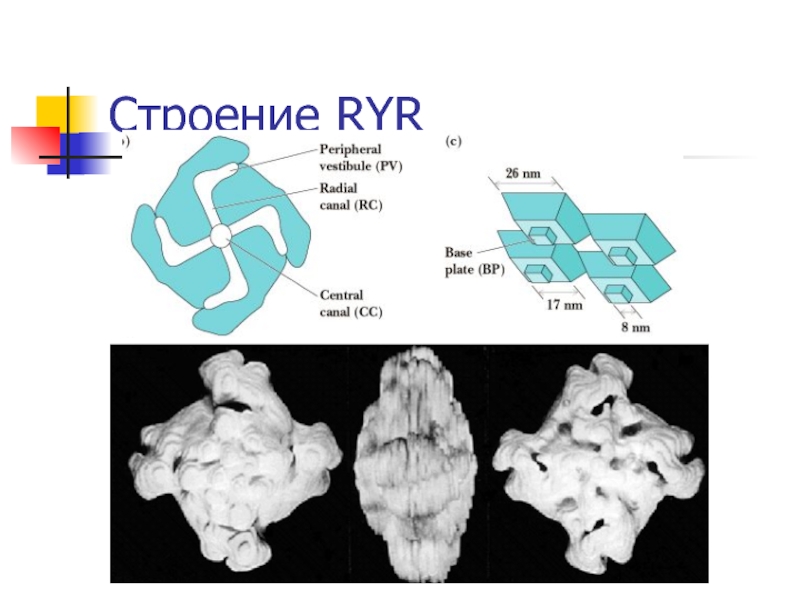
Ca2+-каналы саркоплазматического ретикулума – рианодиновые рецепторы
(RYR) – главный источник кальция для мышечного сокращения.
Известны 3
изоформы этих рецепторов: RYR1, RYR2 and RYR3.RYR1 – в скелетной мускулатуре,
RYR2 – в миокарде,
RYR3 – в головном мозгу.
Слайд 60Патологии RYR
RYR1:
Предрасположенность к злокачественной гипертермии;
Миопатии с внешней офтальмоплегией.
RYR2:
Желудочковая тахикардия,
полиморфная стресс-индуцированная тахикардия;
Семейная аритмогенная правожелудочковая дисплазия.
При сердечной недостаточности RYR2 гиперфосфорилирован
под действием протеинкиназы А, что приводит к нарушению функции канала и повышенной чувствительности к активации кальцием. Слайд 61Ryanodine Receptor 1 (RYR1)
5,032-amino acid protein; molecular mass of 563.5
kD, which is made without an N-terminal sequence.
10 +
2 potential transmembrane sequences.Hydrophilic part of the protein constitutes the cytoplasmic domain.
Potential calmodulin-binding sites.
Abnormalities:
Central core disease;
Susceptibility to malignant hyperthermia;
Minicore myopathy with external ophthalmoplegia.
Слайд 62Central Core Disease
Central core disease is characterized pathologically by the
presence of central core lesions extending the length of type
I muscle fibers.The cores are regions of sarcomeric disorganization, absent mitochondria, and lack of oxidative activity.
Ultrastructural studies show changes in the sarcoplasmic reticulum and t-tubules.
Central core disease is one of the conditions that produces the “floppy infant”.
Central core disease was the first described (Shy and Magee, 1956) example of a stationary muscle disorder.
Central core disease can be caused by mutation in the ryanodine receptor-1 gene (RYR1).
Слайд 63Ryanodine Receptor 2 (RYR2)
The channel is a tetramer comprised of
4 RYR2 polypeptides and 4 FK506-binding proteins.
Protein kinase A
phosphorylation of RYR2 dissociates FKBP12.6 and regulates the channel open probability (Marx et al., 2000). Abnormalities:
Ventricular tachycardia, stress-induced polymorphic (autosomal dominant);
Familial arrhythmogenic right ventricular dysplasia;
In failing human hearts RYR2 is PKA hyperphosphorylated, resulting in defective channel function due to increased sensitivity to calcium-induced activation.
Слайд 64Ryanodine Receptor 3 (RYR3)
Last time it was found new ryanodine
receptor 3.
The novel ryanodine receptor is expressed mainly in brain.
4,872
amino acids; shared characteristic structural features with the skeletal muscle (RYR1) and cardiac (RYR2) ryanodine receptors.
The brain ryanodine receptor gene is transcribed in smooth muscle, also in skeletal muscle during the postnatal phase of muscle development.
At the moment being RYR3 is studied actively.
Слайд 65Кальсеквестрин
Кальсеквестрин (CASQ) – кислый гликопротеин, находящийся в просвете терминальных цистерн
СР
связывает ионы Са2+ и выполняет запасающую функцию.
2 изоформы:
CASQ1 - в
скелетных мышцах,CASQ2 - в сердечной мышце.
Слайд 66Патологии кальсеквестрина
Миссенс-мутация в гене CASQ2 – причина аутосомального рецессивного заболевания
у бедуинов Израиля катехоламин-индуцируемая полиморфная желудочковая тахикардия.
Слайд 67Кальмитин
Кальмитин – митохондриальный кальций-связывающий белок, специфичный для быстрых белых мышц.
Отсутствует
у пациентов с миодистрофиями Дюшенна и Беккера.
Слайд 68Остальные белки мышц
Основные белки мышц:
Миозин и актин – 65%
Тропомиозин
и тропонины – 5%.
Остальные белки -25% (выполняют важные функции
в поддержании мышечной структуры и регуляции мышечного сокращения).Регуляторные белки разделяются на:
Связанные с миозином;
Связанные с актином.
Слайд 69Белки, связанные с миозином
3 основных белка, находящихся в области М-дисков.
Белок
M (165 kD),
Миомезин (185 kD),
Креатин киназа (димер, субъединица
42-kD). Поддерживают структурную целостность миозиновых филаментов.
Слайд 70Остальные белки, связанные с миозином
Белок C (135 kD),
Ингибирует активность
мышечной АТФазы при низкой ионной силе, и активирует при физиологических
значениях.Белок F (121 kD),
Белок H (74 kD),
Белок I (50 kD).
Роль белков F, H и I пока неясна.
Слайд 71Белки, связанные с актином
Кроме тропомиозина и тропонинов с актином также
связаны
α–актинин (гомодимер, субъединица 95-kD),
Обнаружен в области Z линий,
активирует сокращение актомиозина. Предположительно, участвует в прикреплении актина к Z линиям. β-актинин (гетеродимер, субъединицы по 37-kD и 34-kD),
γ-актинин (мономер, 35-kD),
паратропомиозин (гомодимер, 34-kD).
Слайд 72Строение актининов
α-Актинин – гомодимер из антипараллельных субъединиц.
N-конец – актин-связывающий
домен,
C-конец – содержит EF-hand домены.
Разделены центральным доменом, состоящим
из 4 повторов по 122 аминокислотных остатка.Слайд 73Роль актининов и паратропомиозина
Повторы в α–актинине гомологичны 106-аминокислотным повторам в
спектрине – главном структурном белке цитоскелета эритроцитов.
β-Актинин специфически связывается
с концами актиновых нитей. γ-Актинин ингибирует полимеризацию актина.
Паратромомиозин похож на тропомиозин, расположен на стыке зон A и I.
Слайд 75Динамика тайтина
Большие филаменты тайтина и небулина остаются связанными с толстыми
и тонкими филаментами при мышечном сокращении.
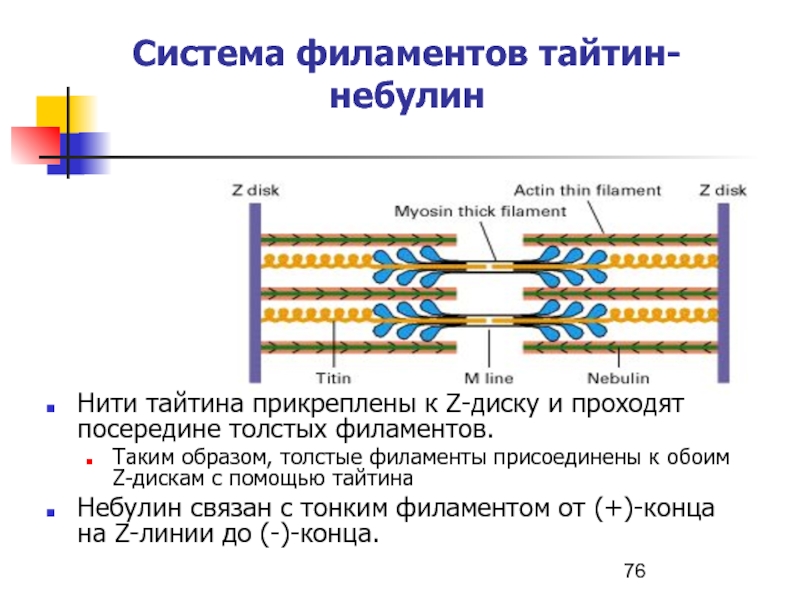
Слайд 76Система филаментов тайтин-небулин
Нити тайтина прикреплены к Z-диску и проходят посередине
толстых филаментов.
Таким образом, толстые филаменты присоединены к обоим Z-дискам
с помощью тайтинаНебулин связан с тонким филаментом от (+)-конца на Z-линии до (-)-конца.
Слайд 77Gelsolin-treated Sarcomere
To visualize the titin filaments in a sarcomere, muscle
is treated with the actin-severing protein gelsolin, which removes the
thin filaments.Without a supporting thin filament, nebulin condenses at the Z disk, leaving titin still attached to the Z disk and thick filament.
Слайд 78Особенности сокращения гладкой мускулатуры
Гладкомышечные клетки расположены менее упорядоченно.
Рыхлые пучки актиновых
и миозиновых филаментов заполняют цитоплазму клетки.
Эти пучки связаны с
плотными тельцами в цитозоле и прикрепительными бляшками на мембране.Слайд 79Сокращение гладких мышц
Пусковой механизм в сокращении гладких мышц – повышение
[Ca2+] в клетке.
Ca2+ связывается с кальмодулином, активирует киназу легких
цепей миозина.Фосфорилирование легких цепей миозина вызывает сокращение.
Процесс сокращения в гладких мышцах происходит значительно медленнее.
Слайд 80Биохимические основы развития сердечной недостаточности (СН)
Нарушение энергетического метаболизма.
Дефицит O2
(ишемия, гипоксия, аноксия)
Несоответствие нагрузки функциональной воможности миокарда
Дефицит субстратов (Гл, ЖК,
КТ, лактат, ПВК и др.)В саркоплазме накапливается Ca2+
Митохондрии аккумулируют значительную часть Ca2+
Разобщение дыхания и фосфорилирования.
Слайд 81Разобщение дыхания и фосфорилирования
Поступление Ca2+ в МХ снижает мембранный потенциал
(Δψ) ⇒ энергодефицит.
Гидроксиаппатит плохо растворим ⇒ уменьшается резерв фосфата.
Ca2+
Ca2+
Фн
гидроксиаппатит
Слайд 82Формирование кислородного долга в миокарде
↑ Ca2+(in)
МХ
↑ ДГ-реакции ЦТК
ΔμH+↓
↑ДЦ
↑О2
Кислородный голод
Слайд 83Роль Ca2+ в снижении функциональной активности миокарда
Ca2+(in)
Кальпаины
(Ca2+-зависимые протеиназы и пептидазы)
Ca2+-зависимые
протеинкиназы
↑ Гликолиз,
↑ Липолиз
Уменьшение мышечной массы
↓ Эндогенный запас субстратов
Слайд 84Последовательность развития СН
При сердечной недостаточности (СН):
Слабая мышечная стенка растягивается (дилатация).
Повышается
синтез коллагена ⇒ рубцевание миокарда ⇒ препятствует дилатации ⇒ снижается
эластичность.Ca2+ ⇒ ↑ анаэробный гликолиз ⇒ ↑образование волокон белого типа ⇒ гипертрофия миокарда ⇒ усиление биосинтеза мышечных белков.
Ca2+ активирует процессы перекисного окисления (↑ NADH).
Слайд 85Биохимические основы коррекции СН (1)
Аэрация миокарда
Нормализация кровообращения
Нормализация ионного и энергетического
баланса
Препараты K+ (печеный картофель, изюм, урюк и т.п.)
Инъекции препаратов
глюкозы, инсулина и K+Сердечные гликозиды (СГ) (наперстянки, ландыша, строфанта Комбе) – дигитоксин, дигоксин, дигонин, конваллятоксин, строфантин K, коргликон (смесь разных СГ).
Высокоспецифичные ингибиторы Na+/K+-АТФазы.
Применение ингибиторов кальциевых каналов и антагонистов Ca2+.
Слайд 86Биохимические основы коррекции СН (2)
Препараты, увеличивающие уровень АТФ в миокарде
Рибоксин
(инозин)
Аспаркам, панангин (глу, асп, K+, Mg2+)
Инозин → ИМФ (+асп)
→ Аденилосукцинат → АМФ → АДФ → АТФL-Карнитин (Элькар®)
Осуществляет транспорт ЖК в МХ.
Антиоксиданты (компл. вит. C, A, E)
Бетаин – аналог SAM
Синтез холина в печени – нормализация липопротеидного обмена.
Синтез креатина – оптимизация энергообеспечения.
Слайд 87Воздействие 137Cs на энергетический метаболизм мышечной ткани (1)
Инкорпорированный 137Cs реализует
свой эффект через неспецифическую систему защиты от гипоксии.
При гипоксии ↑
NADHКлетка продуцирует активные формы кислорода (АФК) и азота (АФА) – сигналы о гипоксии.
Миоциты сосудов при этом расслабляются, сосуды расширяются ⇒ проблема оксигенации решается.
Продолжительно высокий уровень выработки АФК и АФА – угроза окружающим клеткам. Апоптоз – элиминация несостоятельных клеток – скудение и старение популяции клеток.
Слайд 88
Воздействие 137Cs на энергетический метаболизм мышечной ткани (2)
Инкорпорация 137Cs (β-излучатель)
⇒ ↑АФК.
↑ Продукция АФК и АОА ведет к истощению АОЗ.
Клетки
с инкорпорированным радионуклидом воспринимаются как несостоятельные и погибают путем апоптоза.Создаются предпосылки для развития мышечных патологий.
Слайд 89↑ Образование АФК
Активация ПОЛ
Образование лизоформ СЖК и др.
Разобщение ОФ
Деэнергизация
Набухание МХ
Повреждение клетки
Апоптоз
Стимуляция дыхания
Усиление
Влияние 137Cs на митохондрии
Ослабление
137Cs+
H+
[H+]
Снижение ΔμH
и образования
АТФ+
-
O2
137Cs+
1
2
3
4
↓ АТФ
1 – Электрофорез K+/ 137Cs+ в МХ;
2 – KATP-канал;
3 – K+/H+-антипортер;
4 – электронтранспортная цепь.
+
-
+
-








![Биохимия мышечной ткани Механизмы стабилизации [АТФ]В процессе мышечного сокращения АТФ4– → АДФ3– + Фн2- Механизмы стабилизации [АТФ]В процессе мышечного сокращения АТФ4– → АДФ3– + Фн2- + Н+АДФ3– имеет ~ которую можно](/img/thumbs/a4f967b3fd1ce3f577c5188fc85f4cc0-800x.jpg)















































![Биохимия мышечной ткани Сокращение гладких мышцПусковой механизм в сокращении гладких мышц – повышение [Ca2+] Сокращение гладких мышцПусковой механизм в сокращении гладких мышц – повышение [Ca2+] в клетке. Ca2+ связывается с кальмодулином,](/img/thumbs/b3c2194f92bd17e1886a736a12844181-800x.jpg)







![Биохимия мышечной ткани ↑ Образование АФКАктивация ПОЛОбразование лизоформ СЖК и др. Разобщение ОФДеэнергизация Набухание ↑ Образование АФКАктивация ПОЛОбразование лизоформ СЖК и др. Разобщение ОФДеэнергизация Набухание МХПовреждение клеткиАпоптозСтимуляция дыханияУсилениеВлияние 137Cs на митохондрииОслабление137Cs+H+[H+]Снижение](/img/thumbs/022798113e038b7f12ea950f0c472823-800x.jpg)




















