Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
БУФЕРНЫЕ РАСТВОРЫ
Содержание
- 1. БУФЕРНЫЕ РАСТВОРЫ
- 2. Водородный показатель рНрН = –lg[H+] лакмусфенолфталеинметилоранжнейтральная среда:
- 3. рН растворов Значения рН некоторых систем организма
- 4. В поддержании постоянства активной реакции среды организма
- 5. Классификация буферных системгидрофосфат и дигидрофосфат Na (или К)
- 6. Уравнение Гендерсона - ГассельбахаДля кислотных буферных системДля
- 7. Механизм буферного действия ацетатного буфераСН3СООNa→СН3СОО− + Na+СН3СООH
- 8. Механизм буферного действия аммиачного буфераВ растворе существует
- 9. Буферная емкость – количественная оценка буферного действия Величину,
- 10. Зависимость БЕ ацетатного буфера от рНРабочий участок
- 11. Буферные системы организма Организм человека владеет специальным механизмом
- 12. Буферные системы организма
- 13. Вклад различных буферных систем в буферную емкость крови
- 14. Механизм действия фосфатной буферной системыИзбыток гидроксид-ионов связывается
- 15. Фосфатная буферная системаФосфатная буферная система эффективно нейтрализует
- 16. Бикарбонатная буферная система Бикарбонатная кислотно-основная буферная система обладает
- 17. Механизм действия бикарбонатной буферной системыПри добавлении к
- 18. Гемоглобиновая и оксигемоглобиновая буферные системыСамая мощная буферная
- 19. Механизм действия гемоглобинового буфераО2КНВО2 КНВ +
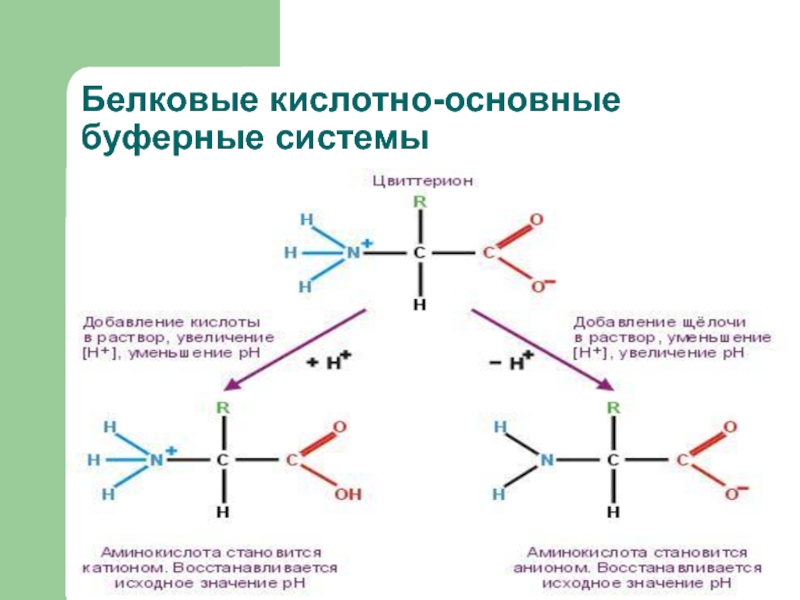
- 20. Белковые кислотно-основные буферные системы
- 21. Взаимосвязь буферных систем организмаВ эритроцитах: HHb +
- 22. Взаимосвязь буферных систем организмакарбоангидраза
- 23. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Водородный показатель рН
рН = –lg[H+]
лакмус
фенолфталеин
метилоранж
нейтральная среда: рН = 7
кислая
среда: рН < 7
Слайд 4
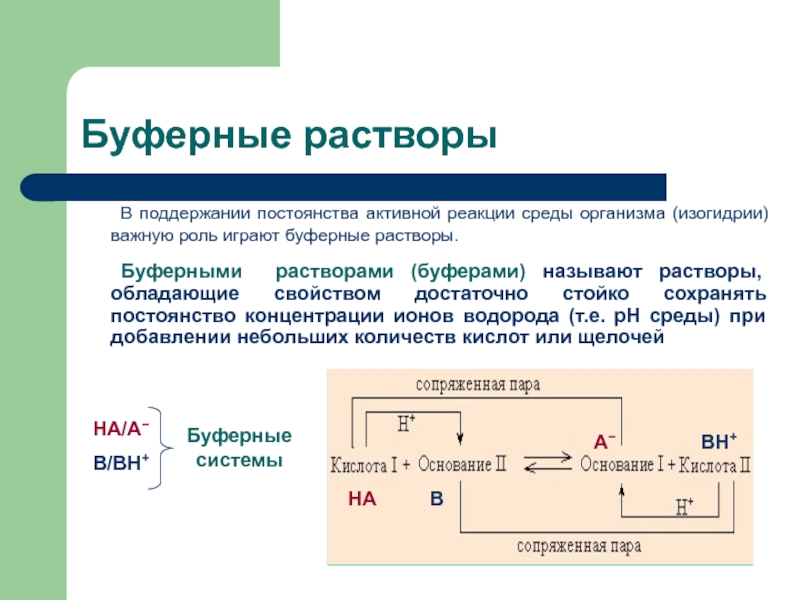
В поддержании постоянства активной реакции среды организма (изогидрии) важную роль
играют буферные растворы.
Буферными растворами (буферами) называют растворы, обладающие свойством
достаточно стойко сохранять постоянство концентрации ионов водорода (т.е. рН среды) при добавлении небольших количеств кислот или щелочейБуферные растворы
Слайд 6Уравнение Гендерсона - Гассельбаха
Для кислотных буферных систем
Для основных буферных систем
СН3СООNa→СН3СОО−
+ Na+
СН3СООH ↔ СН3СОО− + H+
NH3 + Н2О ↔ NH4+
+ OH−NH4Cl → NH4+ + Cl−
Из уравнений видно, что кислотность буферных систем зависит:
от природы слабого электролита, т.е. его константы диссоциации
(а следовательно и от Т, т.к. Кд= f (Т))
от соотношения компонентов буферной системы
рН буферной системы не зависит от разбавления!
Слайд 7Механизм буферного действия ацетатного буфера
СН3СООNa→СН3СОО− + Na+
СН3СООH ↔ СН3СОО− +
H+
диапазон рН 3,7-5,6
Если прибавить сильную кислоту:
СН3СОО- + H+ ↔ СН3СООH
(сильная кислота меняется на слабую)
Если прибавить щелочь:
СН3СООH +ОН-→ СН3СОО- + Н2О
(образуется малодиссоциированая молекула воды)
Слайд 8Механизм буферного действия аммиачного буфера
В растворе существует NH3 и NH4+
NH3+
НОН ↔ NH4+ + ОН−
При добавлении кислоты:
NH3 + HCl ↔
NH4Cl При добавлении щелочи:
NH4+ + ОН− ↔ NH3•Н2О
NH3 + Н2О ↔ NH3•Н2О = NH4+ + OH−
NH4Cl → NH4+ + Cl−
диапазон рН 8,4-10,3
Практически
не диссоциирует
Слайд 9Буферная емкость – количественная оценка буферного действия
Величину, характеризующую способность буферного
раствора противодействовать смещению реакции среды при добавлении сильных кислот или
сильных оснований, называют буферной емкостью раствора (БЕ)БЕ измеряется количеством кислоты или щелочи (моль или ммоль эквивалентов), добавление которого к 1 л буферного раствора изменяет рН на единицу
max БЕ соответствует рН = рКа, т.е. при С(соль)/С(кислоты) = 1
В растворе имеется одинаковое количество соли и кислоты. При таком соотношении концентраций рН раствора изменится в меньшей степени
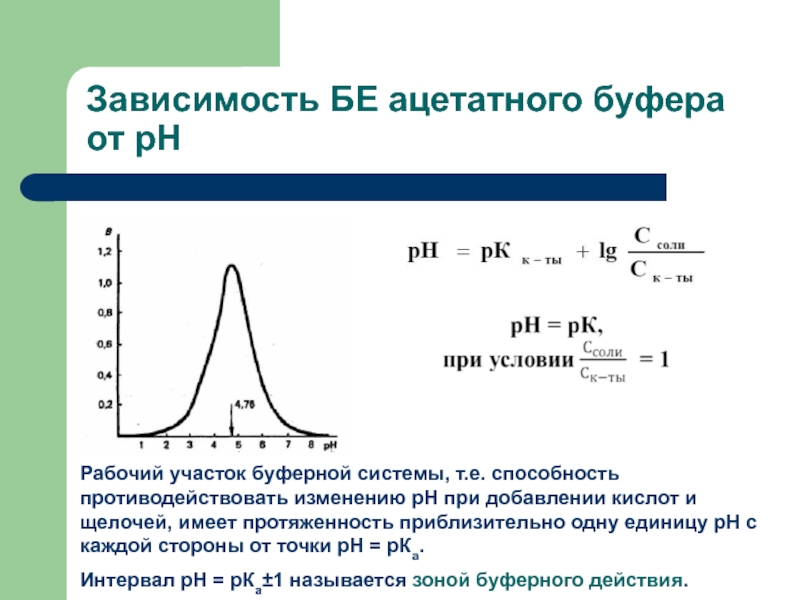
Слайд 10Зависимость БЕ ацетатного буфера от рН
Рабочий участок буферной системы, т.е.
способность противодействовать изменению рН при добавлении кислот и щелочей, имеет
протяженность приблизительно одну единицу рН с каждой стороны от точки рН = рКа.Интервал рН = рКа±1 называется зоной буферного действия.
Слайд 11Буферные системы организма
Организм человека владеет специальным механизмом координации физиологических и
биохимических процессов и может поддерживать на определенном уровне содержание разных
веществ, а именно: газов, воды, электролитов, ионов металлов и водорода, биолигандов. Эта координация по предложению К. Кеннона была названная гомеостазомБуферные системы организма – это, прежде всего, гидрокарбонатная, гемоглобиновая, фосфатная и белковая. Все эти системы имеются в крови, где с их помощью особенно строго поддерживается рН=7,4±0,05
Слайд 14Механизм действия фосфатной буферной системы
Избыток гидроксид-ионов связывается в малодиссоциированную воду
При
добавлении к этому буферу сильной кислоты образуется дигидрофосфат-ион:
Сильная кислота
заменяется эквивалентным количеством H2PO4− При добавлении щелочи к системе буфером окажется другая соль – дигидрофосфат Na:
рН = 7,4
действует в интервале рН 6,2-8,2
Слайд 15Фосфатная буферная система
Фосфатная буферная система эффективно нейтрализует кислые метаболиты, например
молочную кислоту (HLac)
Основное значение фосфатный буфер имеет для регуляции pH
интерстициальной жидкости и мочиNa2HPO4 + H2CO3 ↔ NaH2PO4 + NaHCO3
Слайд 16Бикарбонатная буферная система
Бикарбонатная кислотно-основная буферная система обладает наибольшей буферной ёмкостью.
Это связано с тем, что количество компонентов бикарбонатной буферной системы
поддерживается на должном уровне и с необходимой точностью управления посредством эффективной функции системы дыхания. Н2СО3
NaHCO3
рН = 7,4
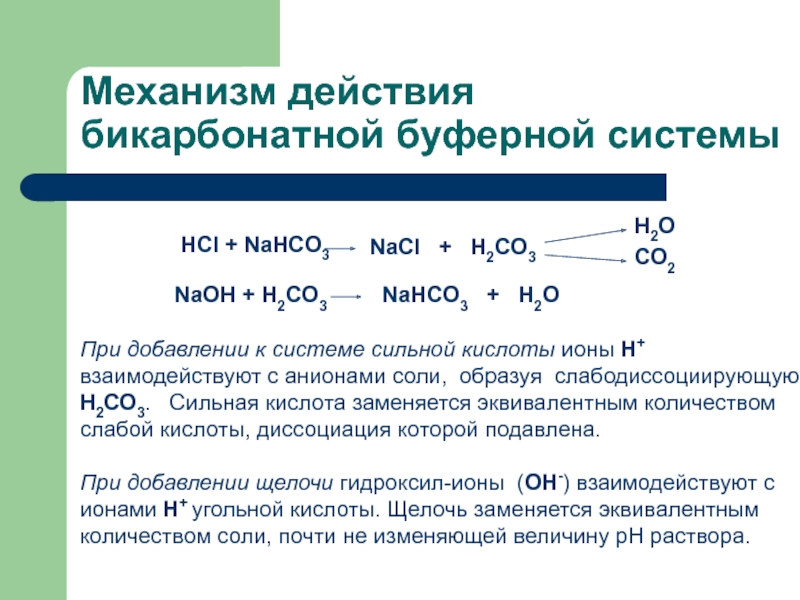
Слайд 17Механизм действия бикарбонатной буферной системы
При добавлении к системе сильной кислоты
ионы Н+ взаимодействуют с анионами соли, образуя слабодиссоциирующую Н2СО3.
Сильная кислота заменяется эквивалентным количеством слабой кислоты, диссоциация которой подавлена.При добавлении щелочи гидроксил-ионы (ОН-) взаимодействуют с ионами Н+ угольной кислоты. Щелочь заменяется эквивалентным количеством соли, почти не изменяющей величину рН раствора.
Слайд 18Гемоглобиновая и оксигемоглобиновая буферные системы
Самая мощная буферная система крови: в
9 раз мощнее бикарбонатного буфера; на ее долю приходится 75%
от всей буферной емкости кровиГемоглобиновая буферная система состоит из:
неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов)
калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов)
Оксигемоглобиновая буферная система состоит из:
оксигенированного гемоглобина ННbО2
его аниона НbО2−
Гемоглобинат-ион
Оксигемоглобинат-ион
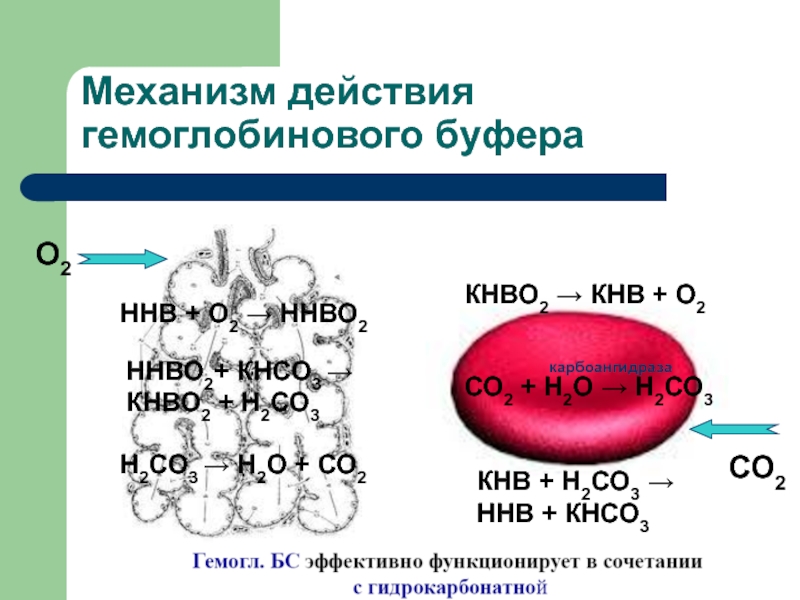
Слайд 19Механизм действия гемоглобинового буфера
О2
КНВО2 КНВ + О2
СО2 + Н2О
Н2СО3
КНВ + Н2СО3
ННВ + КНСО3
карбоангидраза
СО2
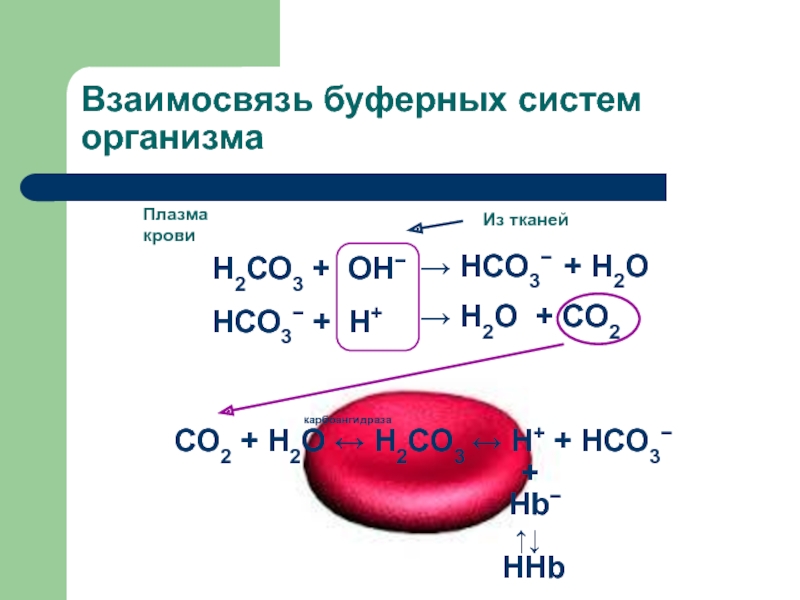
Слайд 21Взаимосвязь буферных систем организма
В эритроцитах: HHb + O2 ↔ HHbO2
↔ H+ + HbO2−
Кровь становиться артериальной
В периферических отделах кровеносной системы:
HbO2− ↔ Hb− + O2Кровь становится венозной
Отдаваемый в тканях О2 расходуется на окисление различных веществ, в результате чего образуется СО2:
1) меньшая часть СО2 остается в плазме: взаимодействие с белковой буферной системой
СO2 + R-NH2 ↔ R-NHCOOH ↔ H+ + R-NHCOO−
Образующийся избыток Н+ нейтрализуется фосфатным буфером:
H+ + HPO4−↔ H2PO4−
2) большая часть СО2 поступает в эритроциты: взаимодействие с гемоглобиновой буферной системой

![БУФЕРНЫЕ РАСТВОРЫ Водородный показатель рНрН = –lg[H+] лакмусфенолфталеинметилоранжнейтральная среда: рН = 7кислая среда: Водородный показатель рНрН = –lg[H+] лакмусфенолфталеинметилоранжнейтральная среда: рН = 7кислая среда: рН < 7щелочная среда: рН >](/img/thumbs/320def28b21cc0a6cc4ed679dcf9a75d-800x.jpg)