Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
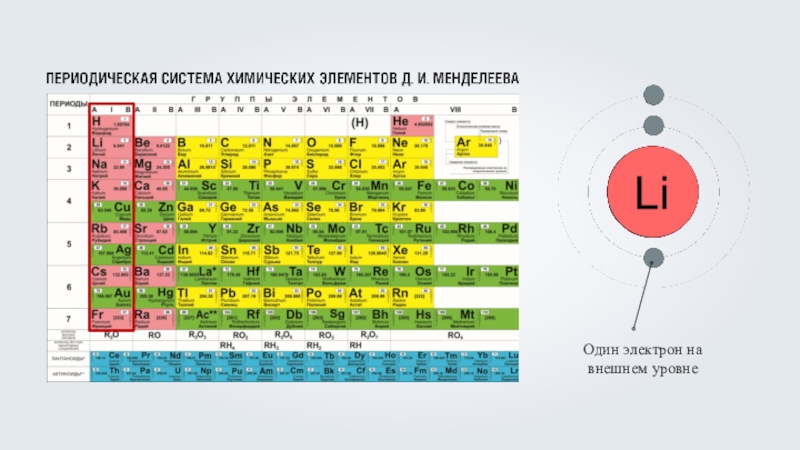
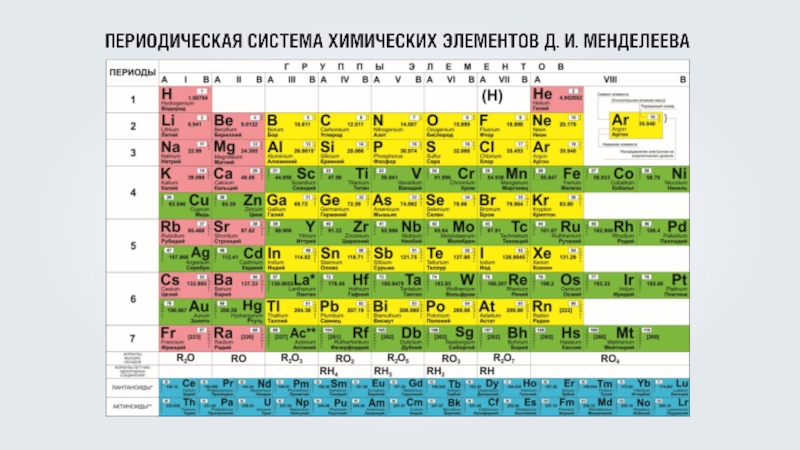
C троение электронных оболочек атомов §46 и 47
Содержание
- 1. C троение электронных оболочек атомов §46 и 47
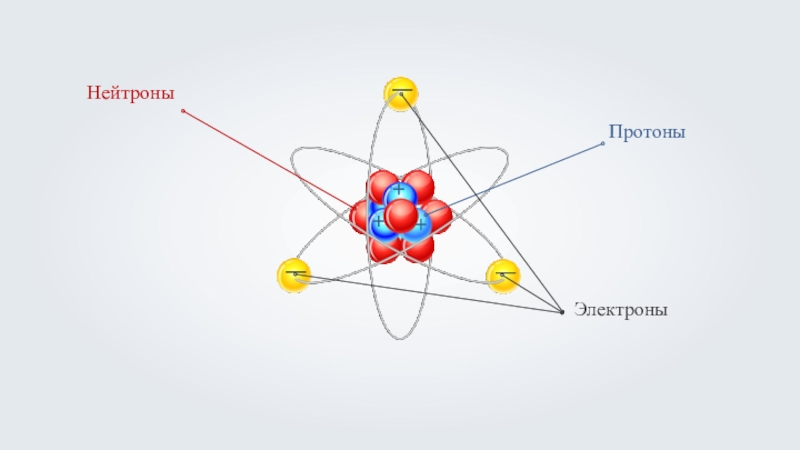
- 2. +++———
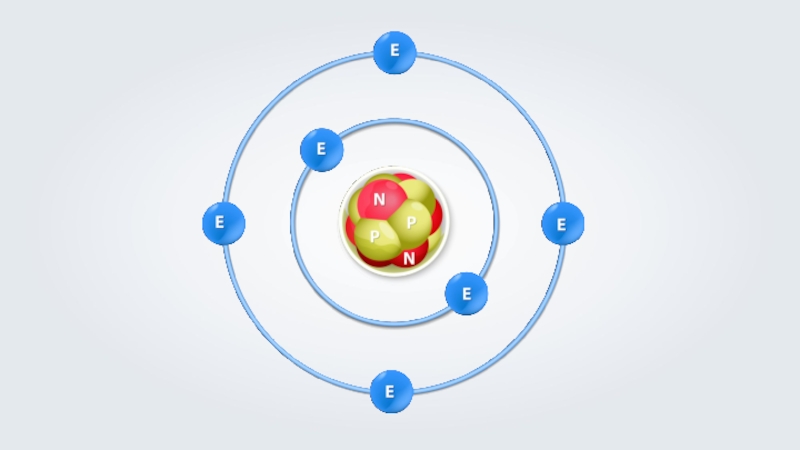
- 3. Слайд 3
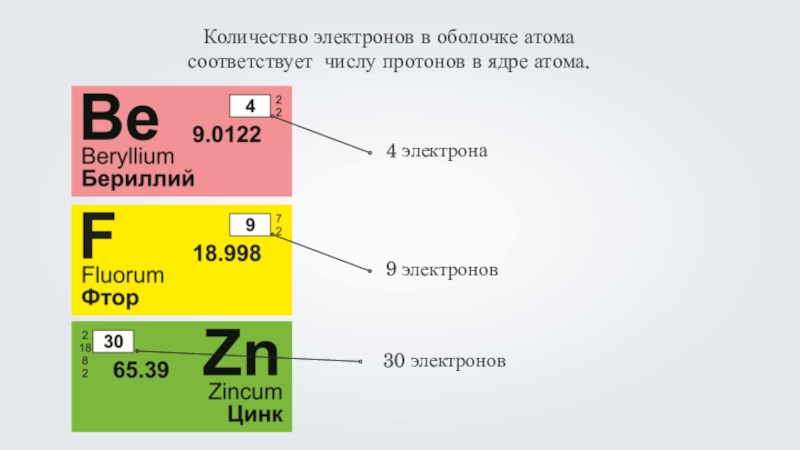
- 4. Количество электронов в оболочке атома соответствует числу протонов в ядре атома.
- 5. Слайд 5
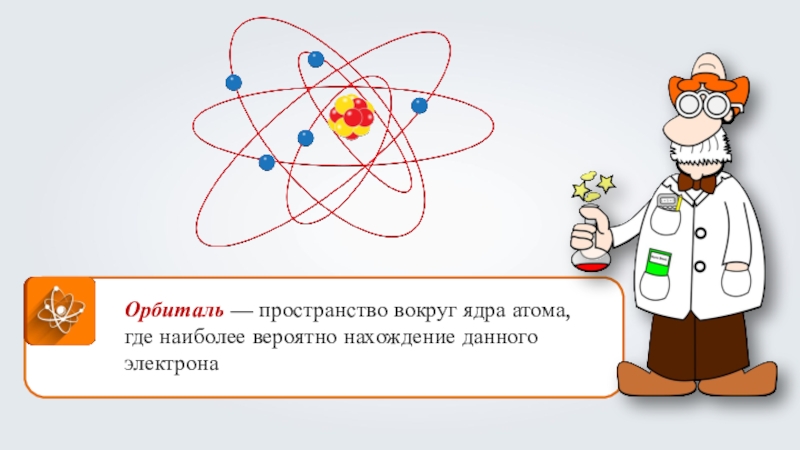
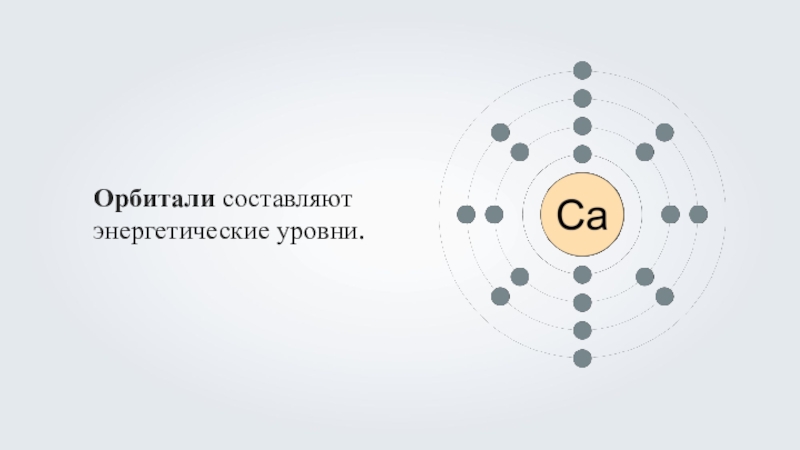
- 6. Орбиталь — пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона
- 7. Орбитали составляют энергетические уровни.
- 8. Слайд 8
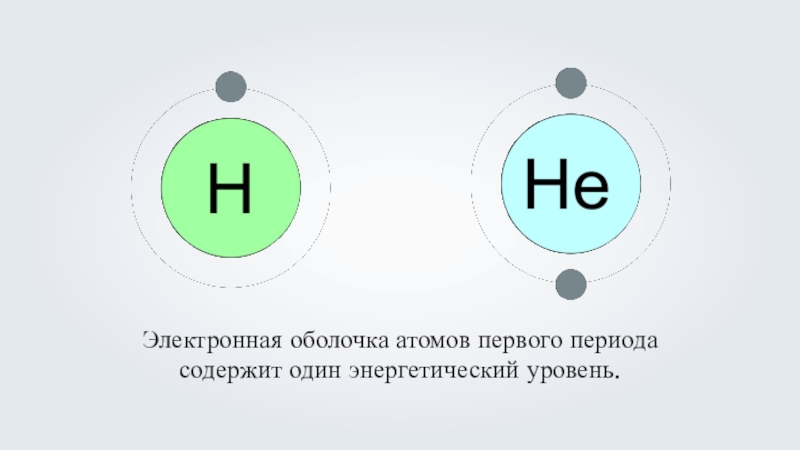
- 9. Электронная оболочка атомов первого периода содержит один энергетический уровень.
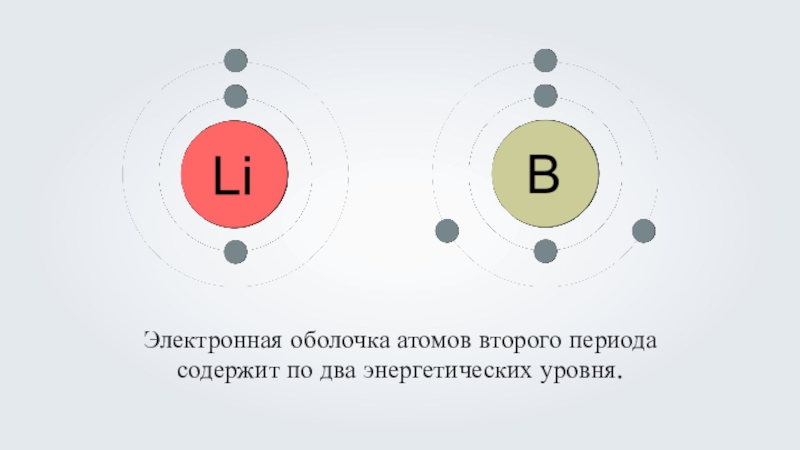
- 10. Электронная оболочка атомов второго периода содержит по два энергетических уровня.
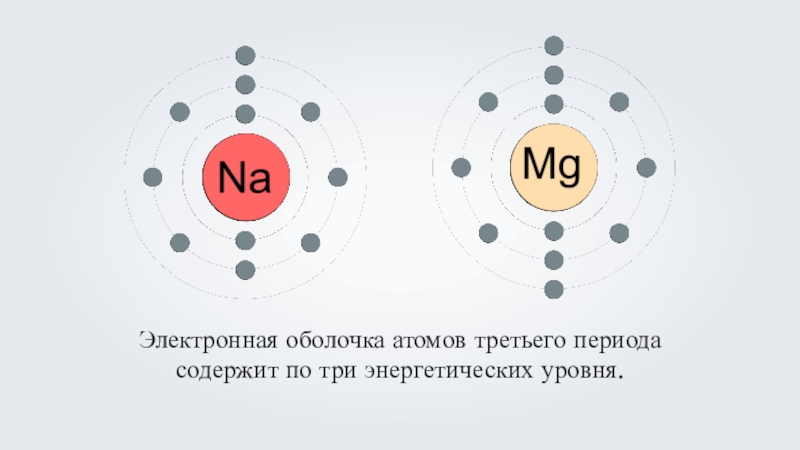
- 11. Электронная оболочка атомов третьего периода содержит по три энергетических уровня.
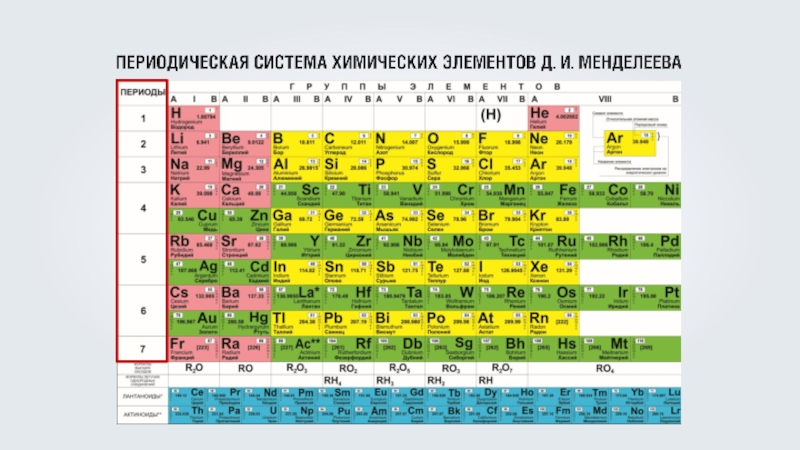
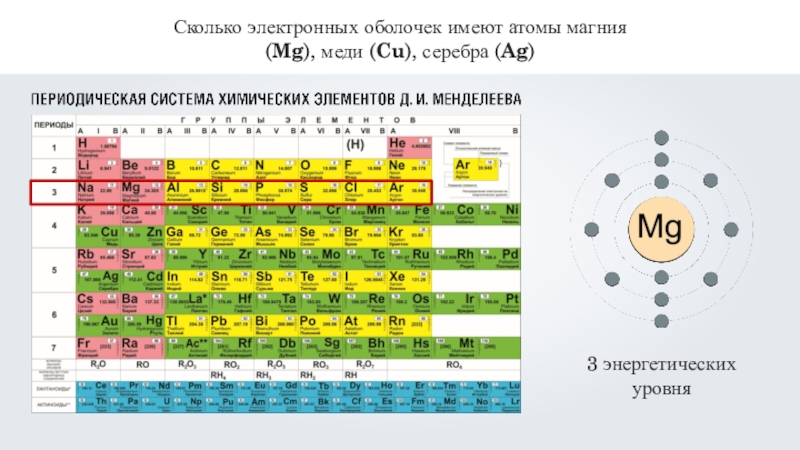
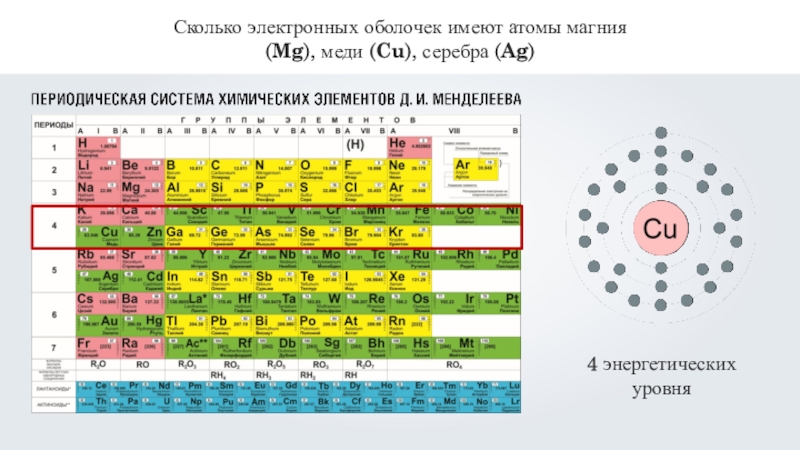
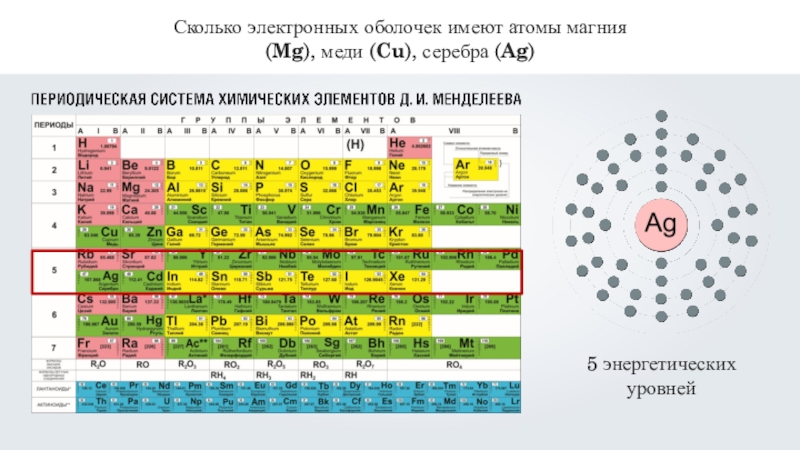
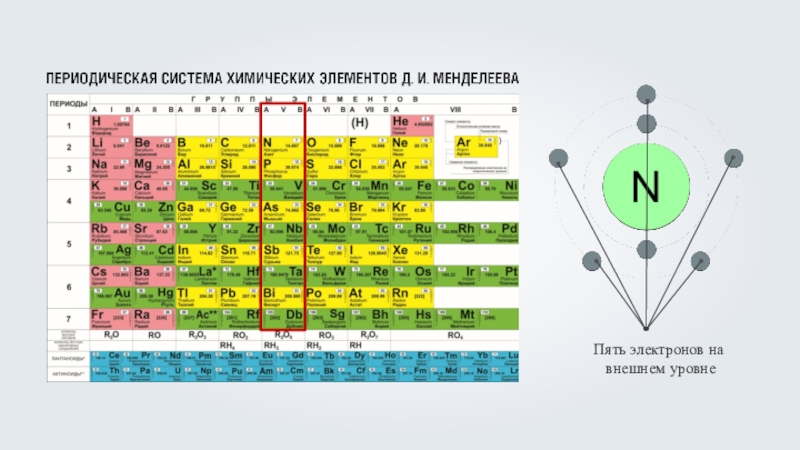
- 12. Сколько электронных оболочек имеют атомы магния (Mg), меди (Cu), серебра (Ag)
- 13. Сколько электронных оболочек имеют атомы магния (Mg), меди (Cu), серебра (Ag)
- 14. Сколько электронных оболочек имеют атомы магния (Mg), меди (Cu), серебра (Ag)5 энергетических уровней
- 15. Максимальное число электронов, находящихся на энергетическом уровне можно определить по следующей формуле:2n2
- 16. Максимальное количество электронов на первом уровне:2⋅12= 2Максимальное
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Построение схемы строения электронных оболочекна примере гелия
- 24. Построение схемы строения электронных оболочекна примере гелия
- 25. Построение схемы строения электронных оболочекна примере гелия
- 26. Построение схемы строения электронных оболочекна примере гелия
- 27. Построение схемы строения электронных оболочекна примере гелия
- 28. Построение схемы строения электронных оболочекна примере гелия
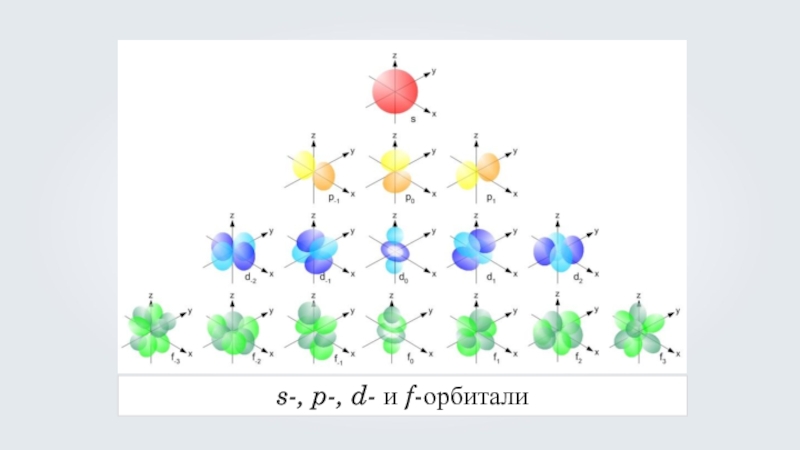
- 29. s-, p-, d- и f-орбитали
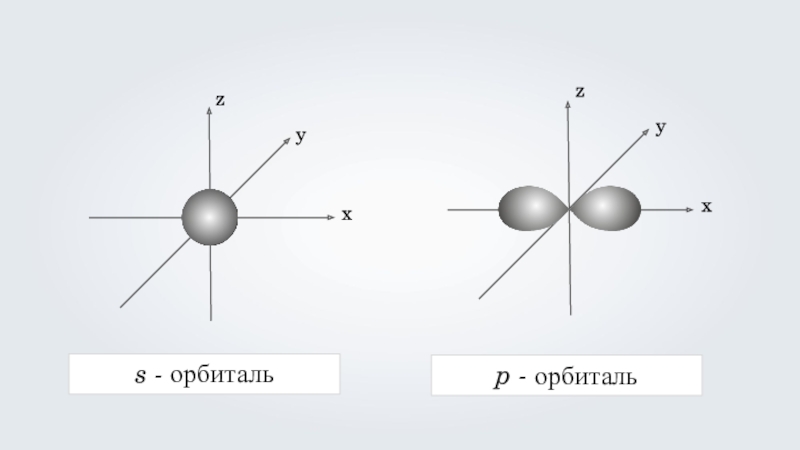
- 30. s - орбитальp - орбитальzyxzyx
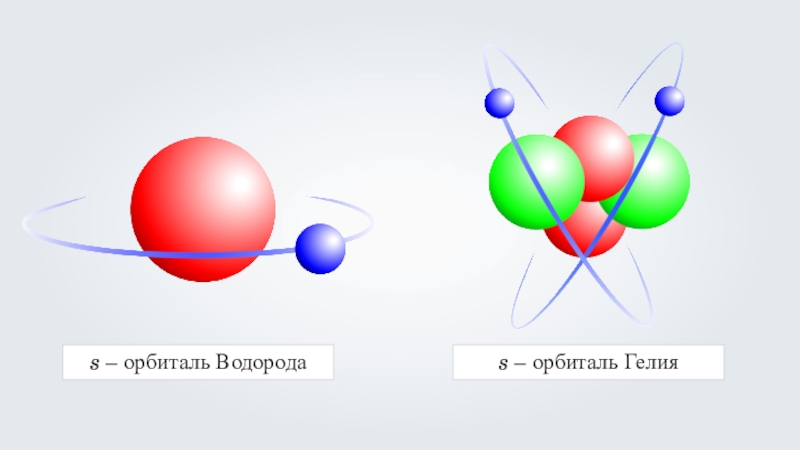
- 31. s – орбиталь Водородаs – орбиталь Гелия
- 32. Н – 1S1He – 1S2Li – 1S22S1Mg – 1S22S22p63S2B – 1S22S22p1Электронные формулы атомов химических элементов
- 33. Электронные формулы химических элементов первых трёх периодовН
- 34. Слайд 34
- 35. Скачать презентанцию
+++———
Слайды и текст этой презентации
Слайд 6Орбиталь — пространство вокруг ядра атома, где наиболее вероятно нахождение
данного электрона
Слайд 14Сколько электронных оболочек имеют атомы магния (Mg), меди (Cu), серебра
(Ag)
5 энергетических
уровней
Слайд 15Максимальное число электронов, находящихся на энергетическом уровне можно определить по
следующей формуле:
2n2
Слайд 16Максимальное количество электронов на первом уровне:
2⋅12= 2
Максимальное количество электронов на
втором уровне:
2⋅22= 8
Максимальное количество электронов на третьем уровне:
2⋅32= 18
Максимальное количество
электронов на четвёртом уровне:2⋅42= 32
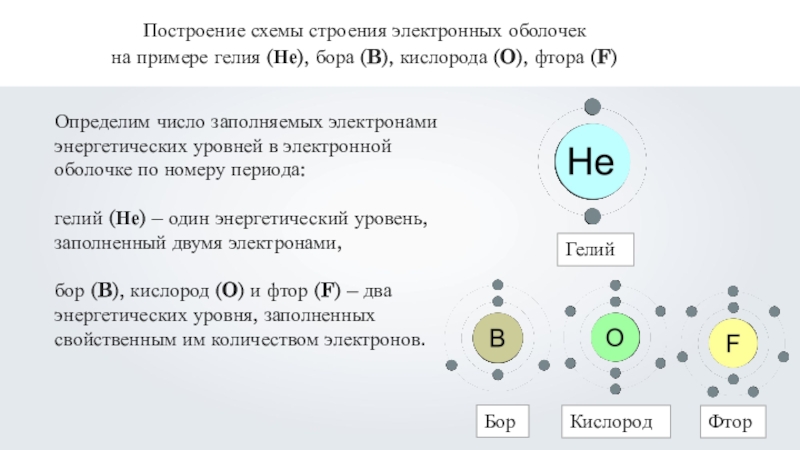
Слайд 23Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B),
кислорода (O), фтора (F)
1. Определим общее число электронов в электронной
оболочке по порядковому номеру элемента в Периодической таблице:гелий (Не) – имеет два электрона,
бор (B) – имеет пять электронов,
кислород (O) – имеет восемь электронов,
фтор (F) – имеет девять электронов.
Слайд 24Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B),
кислорода (O), фтора (F)
Определим число заполняемых электронами энергетических уровней в
электронной оболочке по номеру периода:гелий (Не) – один энергетический уровень, заполненный двумя электронами,
бор (B), кислород (O) и фтор (F) – два энергетических уровня, заполненных свойственным им количеством электронов.
Слайд 25Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B),
кислорода (O), фтора (F)
А теперь определим число электронов на каждом
энергетическом уровне на наших примерах:Гелий (Не) – два электрона на единственном энергетическом уровне.
Слайд 26Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B),
кислорода (O), фтора (F)
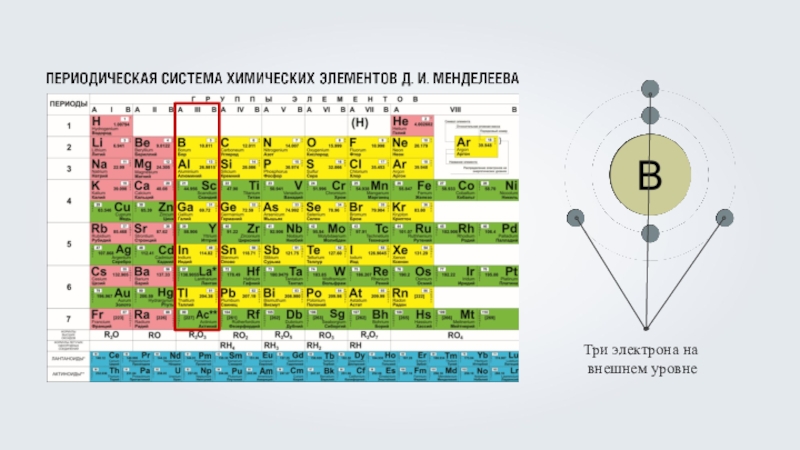
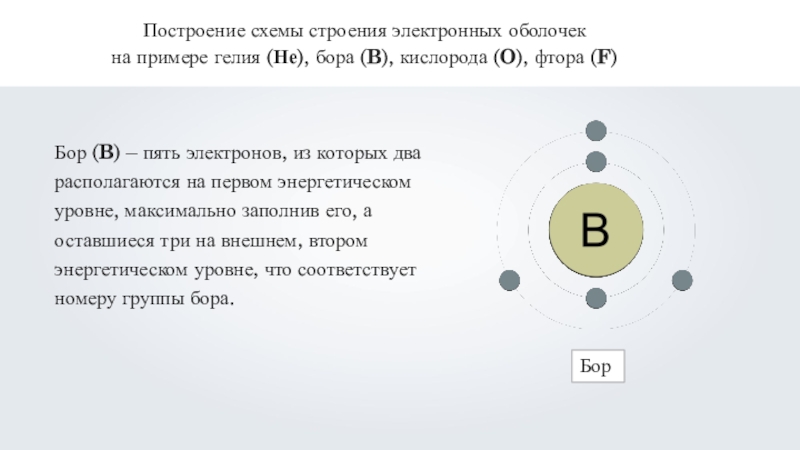
Бор (B) – пять электронов, из которых
два располагаются на первом энергетическом уровне, максимально заполнив его, а оставшиеся три на внешнем, втором энергетическом уровне, что соответствует номеру группы бора.Бор
Слайд 27Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B),
кислорода (O), фтора (F)
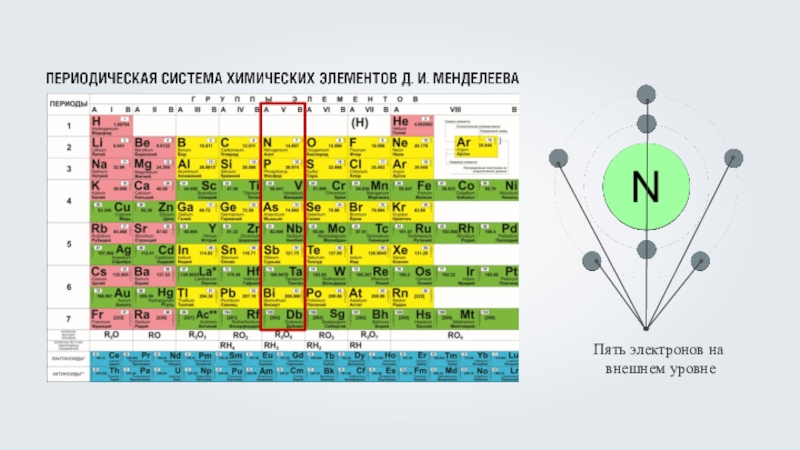
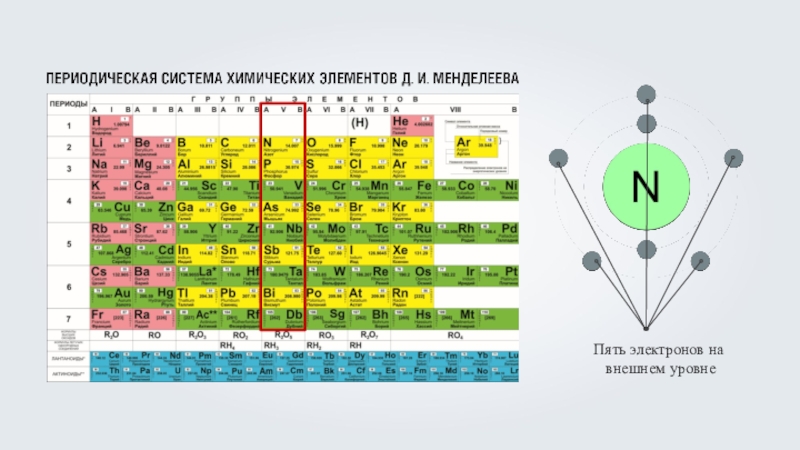
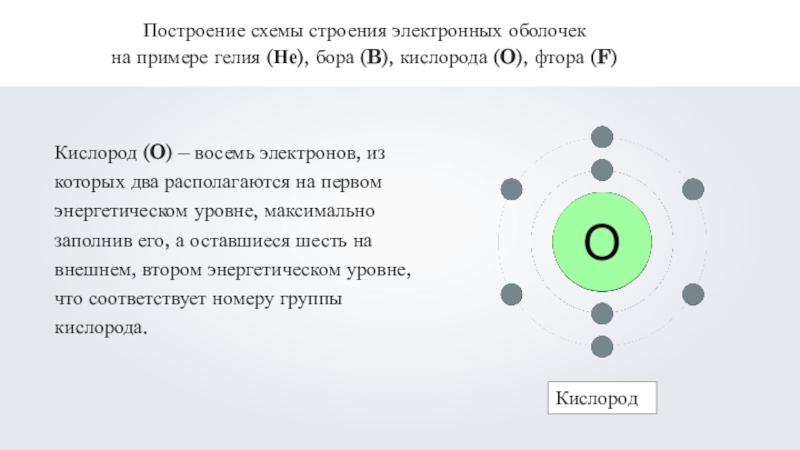
Кислород (O) – восемь электронов, из которых
два располагаются на первом энергетическом уровне, максимально заполнив его, а оставшиеся шесть на внешнем, втором энергетическом уровне, что соответствует номеру группы кислорода.Кислород
Слайд 28Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B),
кислорода (O), фтора (F)
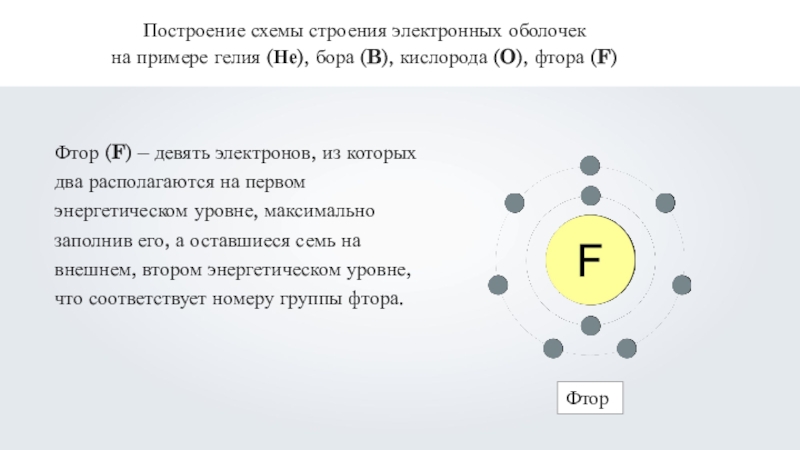
Фтор (F) – девять электронов, из которых
два располагаются на первом энергетическом уровне, максимально заполнив его, а оставшиеся семь на внешнем, втором энергетическом уровне, что соответствует номеру группы фтора.Фтор
Слайд 32Н – 1S1
He – 1S2
Li – 1S22S1
Mg – 1S22S22p63S2
B –
1S22S22p1
Электронные формулы атомов химических элементов
Слайд 33Электронные формулы химических элементов первых трёх периодов
Н – 1S1
He – 1S2
Li – 1S22S1 Ne – 1S22S22p6
Be – 1S22S2 Ar – 1S22S22p63S23p6
B – 1S22S22p1 AI – 1S22S22p63S23p1
C – 1S22S22p2 Si – 1S22S22p63S23p2
N – 1S22S22p3 P – 1S22S22p63S23p3
O – 1S22S22p4 S – 1S22S22p63S23p4
F – 1S22S22p5 CI – 1S22S22p63S23p5