Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Cерная кислота как электролит
Содержание
- 1. Cерная кислота как электролит
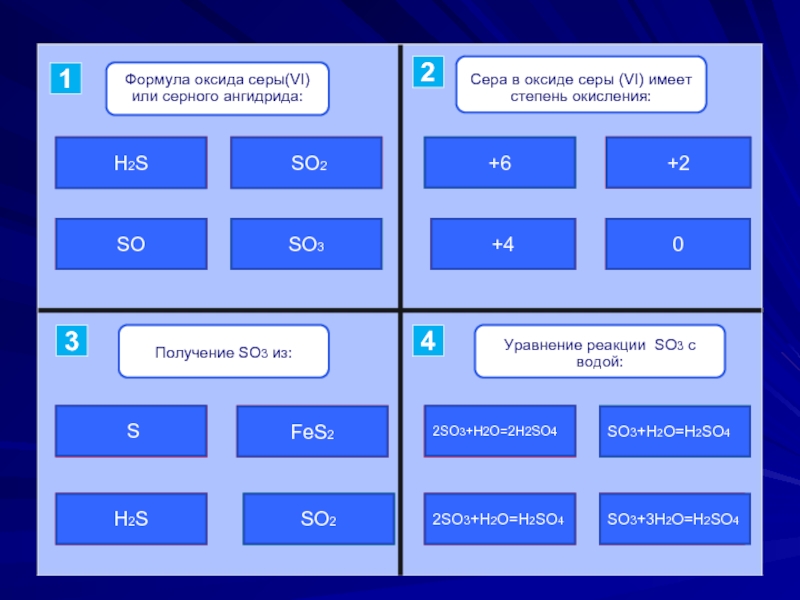
- 2. ошибкаошибкаподумайверно SO2SOH2SSO3верноподумайошибкаошибка+6+4+20ошибкаошибкаподумай верноH2SFeS2 SSO2подумайошибкаошибкаверно2SO3+H2O=2H2SO4SO3+H2O=H2SO42SO3+H2O=H2SO4SO3+3H2O=H2SO41243
- 3. Разбавление серной кислоты водой.034.wmv
- 4. Физические свойства серной кислотыОбразование гидратов, при взаимодействии
- 5. Химические свойства серной кислоты.1. Индикатор: (5 группа)а)
- 6. Химические свойства серной кислоты. H2+SO4 +Zn0 =Zn+2SO4 +H2↑ H+ – окислитель Zn0 –
- 7. Химические свойства концентрированной серной кислоты.mmlab.chemistry.404i.oms
- 8. Химические свойства серной кислоты.H2SO4 + 2NaOH = Na2SO4 +
- 9. Химические свойства концентрированной серной кислоты.mmlab.chemistry.404i.oms
- 10. Химические свойства концентрированной серной кислоты.032.wmv
- 11. ВЫВОД:H2SO4 - сильный окислитель. Свойства разбавленной
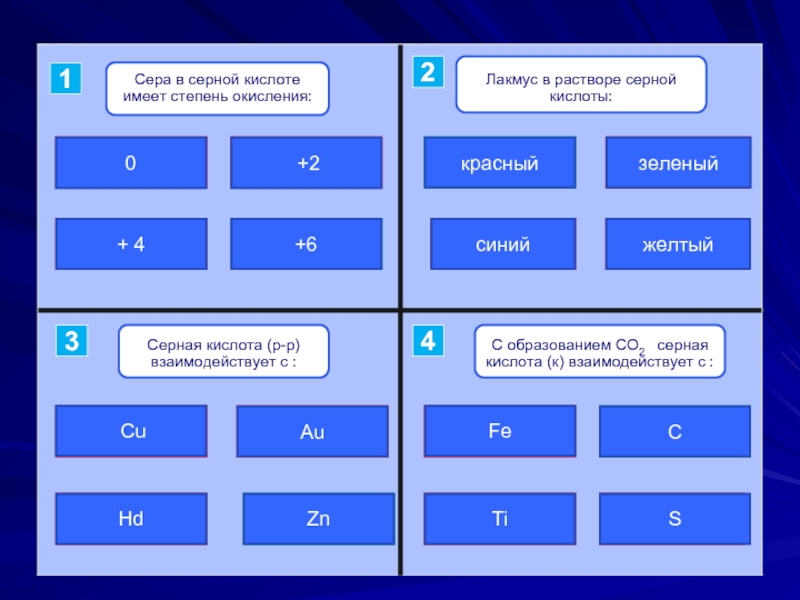
- 12. ошибкаошибкаподумайверно +2+ 40+6верноподумайошибкаошибкакрасныйсинийзеленыйжелтыйошибкаошибкаподумай верноHdAu CuZnподумайошибкаошибкаверноFeСTiS1243
- 13. Домашнее задание.§20, стр. 98-104.Упражнение № 1-2, стр.
- 14. ПРОВЕРЬ СЕБЯ:В двух одинаковых сосудах без этикеток
- 15. СПАСИБО ЗА ВНИМАНИЕ!
- 16. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Тема урока: «Серная кислота как электролит».
Цель урока: изучить свойства серной
кислоты разной концентрации.
Слайд 2ошибка
ошибка
подумай
верно
SO2
SO
H2S
SO3
верно
подумай
ошибка
ошибка
+6
+4
+2
0
ошибка
ошибка
подумай
верно
H2S
FeS2
S
SO2
подумай
ошибка
ошибка
верно
2SO3+H2O=2H2SO4
SO3+H2O=H2SO4
2SO3+H2O=H2SO4
SO3+3H2O=H2SO4
1
2
4
3
Слайд 4Физические свойства серной кислоты
Образование гидратов, при взаимодействии серной кислоты с
водой:
H2SO4 + nH2O = H2SO4 * nH2O +Q
Серная кислота
— бесцветная маслянистая жидкость, почти вдвое (ρ=1,83 г/см3) тяжелее воды, не имеет запаха. Гигроскопична. Поглощает влагу с выделением большого количества теплоты.Слайд 5Химические свойства серной кислоты.
1. Индикатор: (5 группа)
а) лакмус
б) метиловый оранжевый
2. С металлами, стоящими в
электрохимическом ряду напряжений до и
после Н2 (1 группа)3. С основными оксидами (2 группа)
4. С основаниями (3 группа)
5. С солями. Качественная реакция на SO42-
(4 группа)
6. С неметаллами (5 группа)
красный
розовый
не изменяет окраску индикатора.
Слайд 6Химические свойства серной кислоты.
H2+SO4 +Zn0 =Zn+2SO4 +H2↑
H+ – окислитель
Zn0 – восстановитель
НЕ РЕАГИРУЕТ с металлами после
водорода.
4H2S+6O4+3Zn0 =3Zn+2SO4+S0↓+4H2O
S+6 – окислитель
Zn0 – восстановитель
5H2SO4 + 4Ca=4CaSO4 + H2S↑+ 4H2O
На холоде пассивирует Fe,Cr,Ni,Al.
2H2S+6O4+Cu0 =Cu+2SO4 + S+4O2 +2H2O
S+6 – окислитель
Cu0 – восстановитель
Не
реагирует с Au и Pt H2SO4 + MgO = MgSO4 + H2O
MgO + 2H+ + SO42– → Mg2+ + SO42– + H2O
MgO + 2H+ → Mg2+ + H2O
Слайд 8Химические свойства серной кислоты.
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2H+ + SO42– + 2Na+ +
2OH– = 2Na+ + SO42– + 2H2O
H+ + OH– = H2O
H2SO4 + Cu(OH)2↓ = CuSO4 + 2H2O
2H+ +
SO42– + Cu(OH)2↓ = Cu2+ + SO42– + 2H2O
2H+ + Cu(OH)2↓ = Cu2+ + 2H2OH2SO4 + BaCl2 = BaSO4↓ + 2HCl
2H+ + SO42– + Ba2+ + 2Cl– = BaSO4↓ + 2H++ 2Cl-
SO42– + Ba2+ = BaSO4↓
НЕ РЕАГИРУЕТ
2H2S+6O4 + S0 = 3S+4O2 + 2H2O
S+6 – окислитель
S0 – восстановитель
НЕ РЕАГИРУЕТ
обугливание древесины, сахарозы
C12H22O11 + H2SO4 => 12C + H2 SO4*11 H2O +Q
Слайд 11ВЫВОД:
H2SO4 - сильный окислитель.
Свойства разбавленной и концентрированной
серной кислоты отличаются, так как разные окислители:
в разбавленной окислителем
является ион H+ в концентрированной S+6 .
Слайд 12ошибка
ошибка
подумай
верно
+2
+ 4
0
+6
верно
подумай
ошибка
ошибка
красный
синий
зеленый
желтый
ошибка
ошибка
подумай
верно
Hd
Au
Cu
Zn
подумай
ошибка
ошибка
верно
Fe
С
Ti
S
1
2
4
3
Слайд 13Домашнее задание.
§20, стр. 98-104.
Упражнение № 1-2, стр. 105 – на
«3». Упражнение № 4, стр. 105 – на «4». Упражнение № 5,
стр. 105 – на «5».Творческое задание №7, стр. 108 (по желанию).
Желаю успеха!
Слайд 14ПРОВЕРЬ СЕБЯ:
В двух одинаковых сосудах без этикеток налиты равные объемы
разбавленной и концентрированной серной кислоты. Предложите простейший способ идентификации (определения)
жидкостей.2. В не очень далекие времена иногда между стеклами в двойных оконных рамах на зиму ставили стаканчик с концентрированной серной кислотой, чтобы стекла не потели. Какова роль серной кислоты?
3. С какими из перечисленных металлов при температуре 200С не реагирует концентрированная серная кислота:
1) Cu, 2) Zn, 3) Mg, 4) Au.
4.С образованием СО2 концентрированная серная кислота взаимодействует с:
1) Fe 2) Ti 3) C 4) S

























![[ Название проекта ]](/img/thumbs/9d86344f8808de77b15f0f8bac91713f-800x.jpg)




