Слайд 1d-элементы
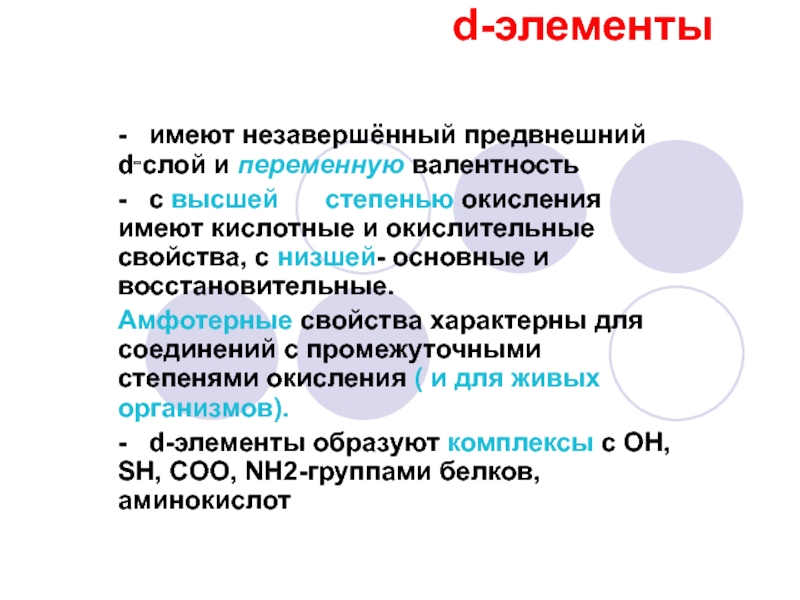
- имеют незавершённый предвнешний d‑слой и переменную валентность
-
с высшей степенью окисления имеют кислотные и окислительные свойства, с
низшей- основные и восстановительные.
Амфотерные свойства характерны для соединений с промежуточными степенями окисления ( и для живых организмов).
- d-элементы образуют комплексы с ОН, SH, COO, NH2-группами белков, аминокислот
Слайд 2Fe
валентность железа не меняется (оксигенация HHb)
Сильные окислители [HNO3, NO2 и др.]
HHb(Fe 2+) метHHb(Fe 3+)
.
HHb состоит из 4
субъединиц, каждая из которых - из глобина и небелковой части — гема.
Гем — комплекс протопорфирина с Fе2+.
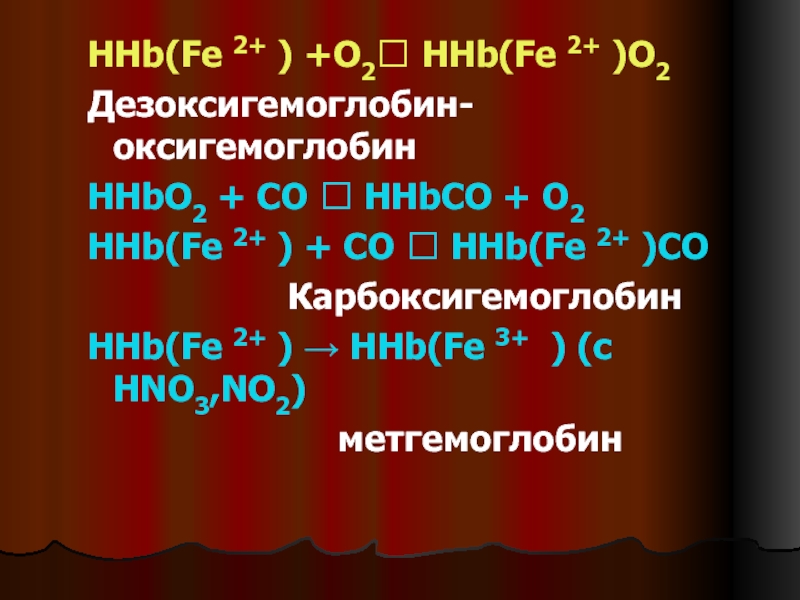
Слайд 3HHb(Fe 2+ ) +O2 HHb(Fe 2+ )O2
Дезоксигемоглобин- оксигемоглобин
HHbO2
+ CO HHbCO + O2
HHb(Fe 2+ ) + CO
HHb(Fe 2+ )CO
Карбоксигемоглобин
HHb(Fe 2+ ) HHb(Fe 3+ ) (с НNO3,NO2)
метгемоглобин
Слайд 4Железо организма
внутриклеточное внеклеточное
1. Гемопротеиды трансферрин(транспорт Fe)
[гемоглобин,
миоглобин,ферменты (
цитохромы,
каталаза,
пероксидаза).
2.
Ферменты негеминовой группы
[сукцинатдегидрогеназа].
3. Ферритин
[запасные белки].
4. Fe, рыхло связанное с белками
и другими органическими соединениями
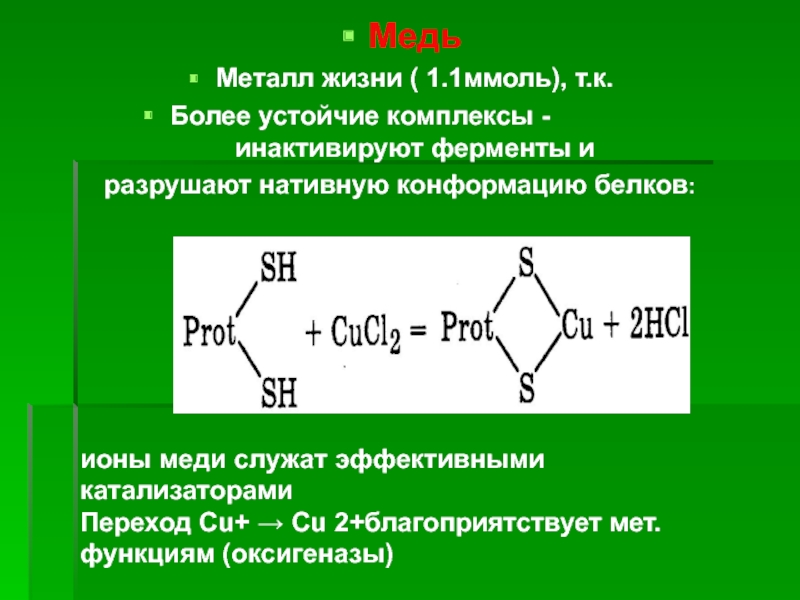
Слайд 5Медь
Металл жизни ( 1.1ммоль), т.к.
Более устойчие комплексы - инактивируют ферменты и
разрушают
нативную конформацию белков:
ионы меди служат эффективными катализаторами
Переход Cu+ Cu
2+благоприятствует мет.функциям (оксигеназы)
Слайд 6Белок церулоплазмин [ЦПСи2+]
-резервуар для Cu,
-транспортную функцию Cu регулируя
баланс меди и обеспечивая выведение избытка меди из организма
-катализирует окисление
Fe2+ в Fe3+, участвуя в кроветворении
Слайд 7Ag
c. o. +1
-10-8 ммоль/л Аg в Н2О
- протаргол (белковый комплекс
Аg)
- колларгол (коллоидное Аg)
- ляпис AgNO3
Антидот - NaCl
AgCl.
Zn
находится в полости комплекса и является компонентом активного центра фермента.
- влияет на процесс дыхания:
-влияет на углеводный обмен.
- Цинк активирует биосинтез витаминов С и В.
- стимулирует фагоцитарную активность лейкоцитов.
Слайд 8Hg
блокирует 100 S-H- содержащих ферментов
HgO, Hg2O
СH3Hg+
HgCl2 — сулема,
очень ядовита. В виде раствора 1:1000 применяется для дезинфекции.
Hg2Cl2 —
каломель (в виде мази) Детоксиканты Hg:
- белковые растворы,
- Na2S2O35H2O — тиосульфат натрия,
- комплексоны.
Слайд 9Р-элементы
. C, N, P, O, S — органогены а [F,
Cl, I] -микроэлементы.
Бор
Ортоборная кислота Н3ВО3- и бура —антисептики:
Na2B4O7 + 7H2O
4H3BO3 + 2NaOH
NaBO2 + Al(OH)3
Избыток бора вреден, т.к. угнетает амилазы, протеиназы, уменьшает активность адреналина
Алюминий + влияет
на развитие эпителиальной и соединительной тканей,
на регенерацию костных тканей,
на обмен фосфора.
тормозит синтез гемоглобина и катализирует реакцию трансаминирования.
Избыток Al тормозит синтез гемоглобина, т.к. блокирует активные центры ферментов, участвующих в кроветворении.
Al катализирует реакцию трансаминирования.
Слайд 101V группа - С, Si, Ge, Sn, Pb.
С -21,15%, органоген
№1
Антидот при отравлениях СО - восстановл. Fe
Si
кремний влияет на формирование
соединительной и эпителиальной ткани в организме,
Si попадает в организм через пищеварительный тракт и через лёгкие.
При вдыхании пыли, содержащей SiO2, возникает силикоз( образуется гель поликремниевой кислоты, что ведёт к гибели клеток)
Слайд 11].
Pb
с.о. +2 и +4, образует К.С. ( с SH-группами белков)
Очень
токсичен, особенно его органические соединения.
Pb влияет:
-на синтез белка,
-
кроветворение,
- энергетический баланс клетки и её генетический аппарат [является слабым мутагеном].
- денатурацию белка,
- на развитие кариеса,
инактивирует ферменты,
нарушает синтез гемоглобина [Pb+4 окисляет Fe2+ в Fe3+ ].
Детоксиканты : молоко, белковые растворы, тиосульфат натрия, комплексоны.
Слайд 12VA группа ПСЭ -N, P, As
N- 3,1%
связывает неорганическую и органическую
части молекулы.
Растения усваивают нитраты ион аммонияглутаминовая к-та
19 альфа аминокислот
Слайд 13Аммиак —токсичный газ
при алкалозе в качестве мочегонного средства применяют хлорид
аммония NH4C1.
NH4OH применяют при обмороках для возбуждения дыхания.
образует прочные
аммиачные комплексы( токсичность аммиака).
NH4Cl — отхаркивающее и мочегонное средство.
NaNO2 — сосудорасширяющее средство при стенокардии и мигрени.
Слайд 14NO2 и N205 — кислотные оксиды , токсичность нитратов связана
с восстановлением их до нитритов
Слайд 15Р- Макроэлемент [0,95%], органоген.
=== Входит в состав:
АТФ и креатинфосфата,
белков, нуклеиновых кислот, нуклеотидов ,
костей [кальция ортофосфат, гидроксилапатит], зубов
[гидроксилапатит, фторапатит].
=== Важную роль выполняет фосфатная буферная система.
===Сахара и жирные кислоты используются организмом только после их фосфорилирования.
=== Энергия АТФ необходима для сокращения мышц, в том числе сердечной мышцы, проведения нервного импульса, биохимических реакций.
Слайд 16P
Белый фосфор очень токсичен
Уменьшение содержания неорганического фосфора ведёт к
увеличению содержания Са в крови [антагонизм].
Фосфорорганические соединения — нервно-паралитические яды [ОВ].
очень
токсичный гидрид фосфора РН3
Слайд 17Макроэлемент [62%]. - O
- окисление питательных веществ в организме,
окислительно--
восстановительные реакции.
Уменьшение содержания О2 в организме понижает его защитные свойства
[в фагоцитах О2 превращается в О2– — супероксид-ион, который инициирует радикальноцепные процессы окисления инородных органических веществ].
СОД
2О2·¯ +2Н+ → Н2О2+О2
каталаза
2Н2О2 2Н2О+О2.
Слайд 18 S -Макроэлемент [0,16%],.
Суточная потребность 4-5 г.
Входит в состав
+++белков, гормонов, витаминов.
+++тиоловых соединений, участвующих
в окислительно-восстановительных реакциях.
+++ Известны три
серусодержащих аминокислоты: цистин, цистеин и метионин.
+++ : инсулина, глутатиона, витамина В1, липоевой кислоты
2Н
+++Обратимый переход R1—S—S—R2 R1SH + R2SH защищает организм от радиационных поражений.
+++Образование дисульфидных мостиков стабилизирует и определяет третичную структуру белка.
+++Образующаяся в организме Н2SО4 участвует в обезвреживании ядовитых соединений: фенола вырабатываемых в кишечнике из аминокислот микробами.
++++ В соединении с серной кислотой [в виде конъюгатов] выводятся чужеродные вещества.
Слайд 19++++. Приём серы внутрь способствует рассасыванию нарывов,
+++++ сера используется как слабительное
средство.
+++++В виде мазей и присыпок применяется как антимикробное средство при лечении
кожных заболеваний.
Na2S2O35H2O — тиосульфат натрия — антитоксическое, противовоспалительноесредство.
Na2S2O8 — персульфат натрия — антигипоксическое средство.
Na2SO410H2O — сульфат натрия — слабительное.
MgSO47H2O — сульфат магния — понижает артериальное давление.
CaSO42H2O — гипс — используется в хирургической практике.
CuSO45H2O — сульфат меди — при анемии.
FeSO47H2O — сульфат железа — при анемии.
Слайд 20Хлор, фтор, бром, йод
Cl — макроэлемент [0,15%], остальные — микроэлементы
[10–5%]. Фтор
В организме фтора 7 мг. Больше всего фтора в
эмали — около 0,01% [труднорастворимый фторапатит Са5[РО4]3F]:
Са5[РО4]3ОН + F– Са5[РО4]3F + OH–
ускоряя процесс реминерализации [образования кристаллов]:
10Са 2+ + 6РО4 3– + 2F– = 3Са3[РО4]2СаF2
Для питьевой воды добавляют NaF до нормы [1 мг/л]. Недостаток F приводит к кариесу.
Если содержание F будет выше 1,2 мг/л,, кости деформируются [развивается флюороз].
Механизм токсического действия фтора — образование комплексных соединений с кальцием, магнием и другими элементами — активаторами ферментов, вследствие чего фтор угнетает активность ряда ферментов.
Избыток фтора угнетает функцию щитовидной железы, т.к. фтор — конкурент йода в синтезе гормонов щитовидной железы.
Слайд 21Хлор
В организме человека 100 г хлора ионы хлора:
- активируют
ферменты [амилаза слюны],
- создают благоприятную среду для действия ферментов желудочного сока,
- обеспечивают ионные потоки через клеточные мембраны,
= участвуют в поддержании осмотического равновесия.
Суточная потребность в NaCl составляет 5–10 г.
NaCl необходим для выработки НСl в желудке.
НСl, помимо участия в пищеварении, уничтожает бактерии холеры, брюшного тифа.
Элементарный хлор — высокотоксичный газ.
Слайд 22Йод
. В организме 25 мг I [410–5%],— в щитовидной железе в
виде гормонов
Щитовидная железа секретирует гормоны, которые влияют на обмен веществ,
теплообразование, поглощение кислорода.
Гипотиреоз может быть связан: а/ с уменьшением способности связывать и накапливать йодид-ионы; б/ с недостатком в пище йода [эндемический зоб].
KI применяют и при гипо-, и при гипертиреозе.
При эндемическом зобе йодид-ионы используются для синтеза гормонов, при гипертиреозе йодид-ионы тормозят йодирование тирозина йодом.
![d- элементы Feвалентность железа не меняется (оксигенация HHb)Сильные окислители [HNO3, NO2 и др.] HHb(Fe Feвалентность железа не меняется (оксигенация HHb)Сильные окислители [HNO3, NO2 и др.] HHb(Fe 2+) метHHb(Fe 3+) . HHb](/img/thumbs/c361d07b6e4f0ed8d02d2f5ecd583f97-800x.jpg)

![d- элементы Белок церулоплазмин [ЦПСи2+] -резервуар для Cu, -транспортную функцию Cu регулируя баланс Белок церулоплазмин [ЦПСи2+] -резервуар для Cu, -транспортную функцию Cu регулируя баланс меди и обеспечивая выведение избытка меди](/img/thumbs/10092a5f1bfc0b050ce7f2252f6c657a-800x.jpg)


![d- элементы Р-элементы. C, N, P, O, S — органогены а [F, Cl, Р-элементы. C, N, P, O, S — органогены а [F, Cl, I] -микроэлементы.БорОртоборная кислота Н3ВО3- и бура](/img/thumbs/a18d25a10ff1dd2d6d54a68653169c30-800x.jpg)

![d- элементы ].Pbс.о. +2 и +4, образует К.С. ( с SH-группами белков)Очень токсичен, ].Pbс.о. +2 и +4, образует К.С. ( с SH-группами белков)Очень токсичен, особенно его органические соединения.Pb влияет: -на](/img/thumbs/0c8ff4a5ee12f70895e108da68a06a98-800x.jpg)



![d- элементы Р- Макроэлемент [0,95%], органоген. === Входит в состав:АТФ и креатинфосфата, белков, Р- Макроэлемент [0,95%], органоген. === Входит в состав:АТФ и креатинфосфата, белков, нуклеиновых кислот, нуклеотидов , костей [кальция](/img/thumbs/92a3a20cb588808ff9ace5ee703434aa-800x.jpg)
![d- элементы PБелый фосфор очень токсичен Уменьшение содержания неорганического фосфора ведёт к увеличению PБелый фосфор очень токсичен Уменьшение содержания неорганического фосфора ведёт к увеличению содержания Са в крови [антагонизм].Фосфорорганические соединения —](/img/thumbs/3505a21651a62446d775387e510444ea-800x.jpg)
![d- элементы Макроэлемент [62%]. - O- окисление питательных веществ в организме, окислительно-- восстановительные Макроэлемент [62%]. - O- окисление питательных веществ в организме, окислительно-- восстановительные реакции.Уменьшение содержания О2 в организме понижает](/img/thumbs/615d691f474789b22211f93eaecf3e58-800x.jpg)
![d- элементы S -Макроэлемент [0,16%],.Суточная потребность 4-5 г. Входит в состав +++белков, гормонов, S -Макроэлемент [0,16%],.Суточная потребность 4-5 г. Входит в состав +++белков, гормонов, витаминов. +++тиоловых соединений, участвующих в окислительно-восстановительных реакциях.+++](/img/thumbs/b2e37047b0c852824eb858c6b516b517-800x.jpg)

![d- элементы Хлор, фтор, бром, йодCl — макроэлемент [0,15%], остальные — микроэлементы [10–5%]. Хлор, фтор, бром, йодCl — макроэлемент [0,15%], остальные — микроэлементы [10–5%]. ФторВ организме фтора 7 мг. Больше](/img/thumbs/b5f42a81d6f9a08e2dcd71d33563d6de-800x.jpg)
![d- элементы ХлорВ организме человека 100 г хлора ионы хлора: - активируют ферменты ХлорВ организме человека 100 г хлора ионы хлора: - активируют ферменты [амилаза слюны],- создают благоприятную среду для действия](/img/tmb/4/321129/12571111d3bab7205e0ffab9da97fa21-800x.jpg)
![d- элементы Йод. В организме 25 мг I [410–5%],— в щитовидной железе в виде Йод. В организме 25 мг I [410–5%],— в щитовидной железе в виде гормонов Щитовидная железа секретирует гормоны, которые](/img/thumbs/669c93f0558817aee9e0bbd3c8b8922e-800x.jpg)



















