Слайд 1Департамент ветеринарной медицины
Лабораторное занятие №1
«Патогистотехника.
Техника приготовления гистопрепаратов»
Слайд 2Организм человека и животных представляет собой целостную систему, в которой
можно выделить ряд иерархических уровней организации живой материи:
клетки →
ткани → морфофункциональные единицы органов → органы → системы органов
Каждый уровень структурной организации имеет морфофункциональные особенности, отличающие его от других уровней.
Гистология — наука о строении, развитии и жизнедеятельности тканей животных организмов.
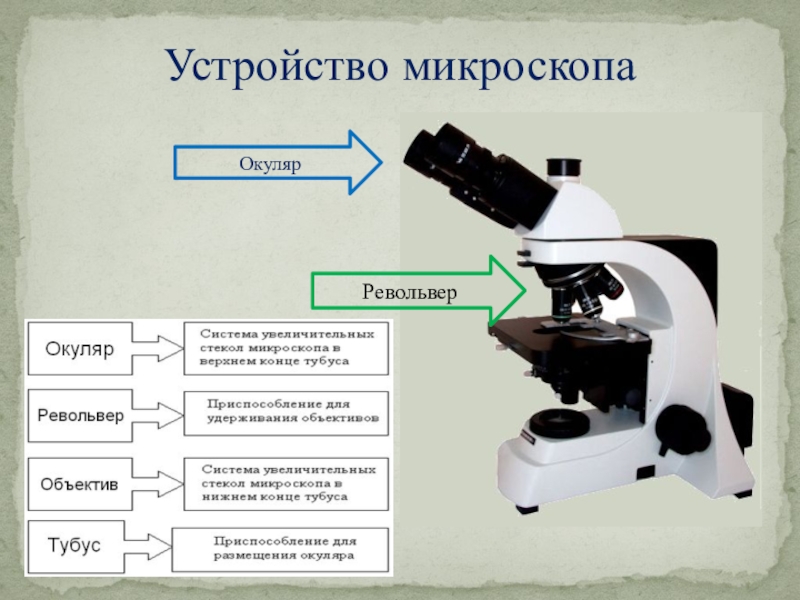
Слайд 3Устройство микроскопа
Окуляр
Револьвер
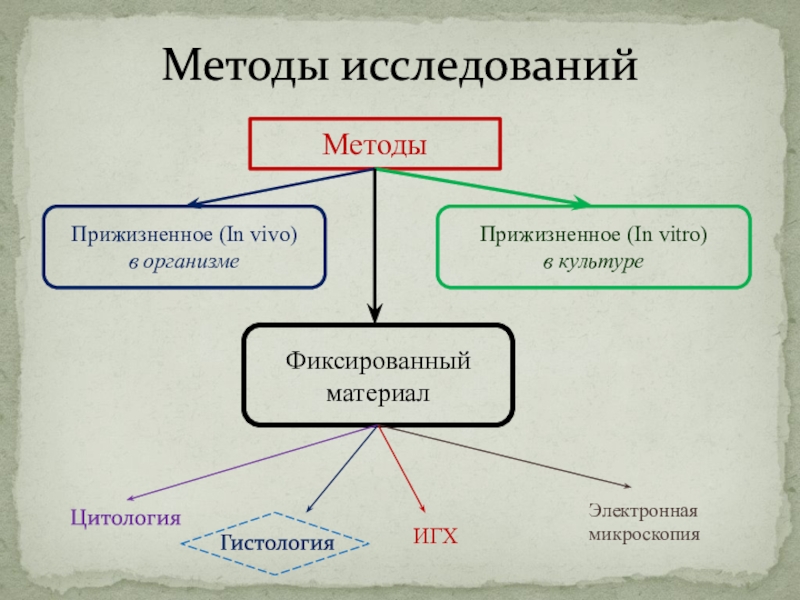
Слайд 4Методы исследований
Методы
Прижизненное (In vivo)
в организме
Прижизненное (In vitro)
в культуре
Фиксированный материал
Цитология
Гистология
ИГХ
Электронная
микроскопия
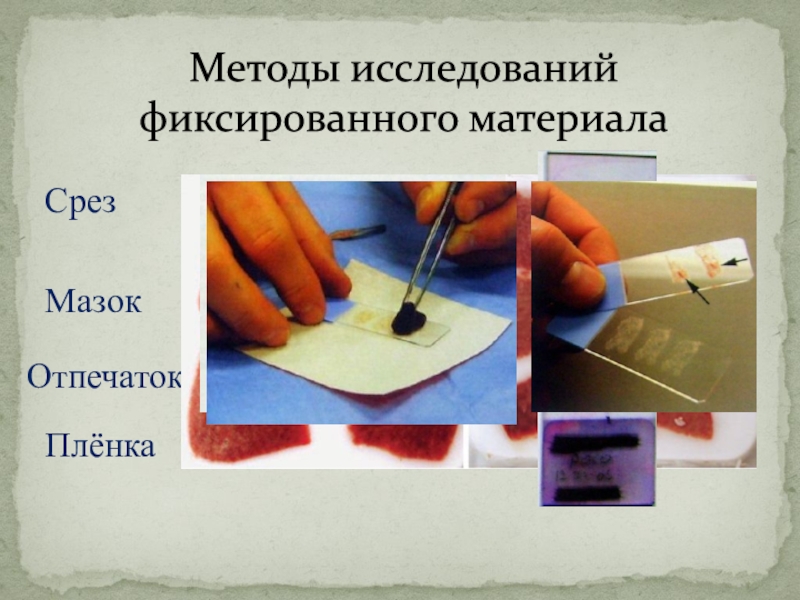
Слайд 5Методы исследований
фиксированного материала
Срез
Мазок
Отпечаток
Плёнка
Слайд 6Гистологический препарат – это срез (толщиной 0,1-15 мкм) органов, тканей
или клеток, окрашенный специальными гистологическими красителями.
Процесс изготовления гистологического препарата включает
следующие этапы:
1. Забор материала
2. Фиксация материала
3. Нарезка материала
4. Проводка материала
5. Заливка материала
6. Резка материала
7. Окраска материала
8. Заключение материала
Слайд 7ТЕХНИКА ВЫРЕЗКИ МАТЕРИАЛА
Оптимальная площадь кусочков ткани 2 — 3 см2,
толщина 5 — 7 мм. Если возможна повторная вырезка материала
(например, при секционных исследованиях), то кусочки могут быть большего размера.
1
2
3
Слайд 9ОБЩИЕ ПРИНЦИПЫ ФИКСАЦИИ
Фиксация обеспечивает стабилизацию тканевых структур и их уплотнение.
Механизм действия фиксаторов основан на коагуляции белков и стабилизации липидов.
Не
используйте тару с узким горлышком!!!
Слайд 10Из области фантастики
(или как надо, но никто не делает)
Полноценная фиксация материала обеспечивается при соблюдении ряда требований:
После вырезки кусочка ткани его немедленно погружают в фиксатор.
Объем фиксатора должен превышать объем фиксируемого материала в 10 — 20 раз, так как тканевая жидкость может существенно изменить концентрацию фиксатора.
В том случае, если цвет фиксатора изменяется после погружения в него кусочков ткани, фиксатор необходимо немедленно сменить.
Недопустимо повторное использование фиксаторов!!!
Для каждого фиксатора следует соблюдать установленное время фиксации. Длительное пребывание материала возможно лишь в некоторых фиксаторах, например 10 % нейтральном формалине, жидкости Буэна.
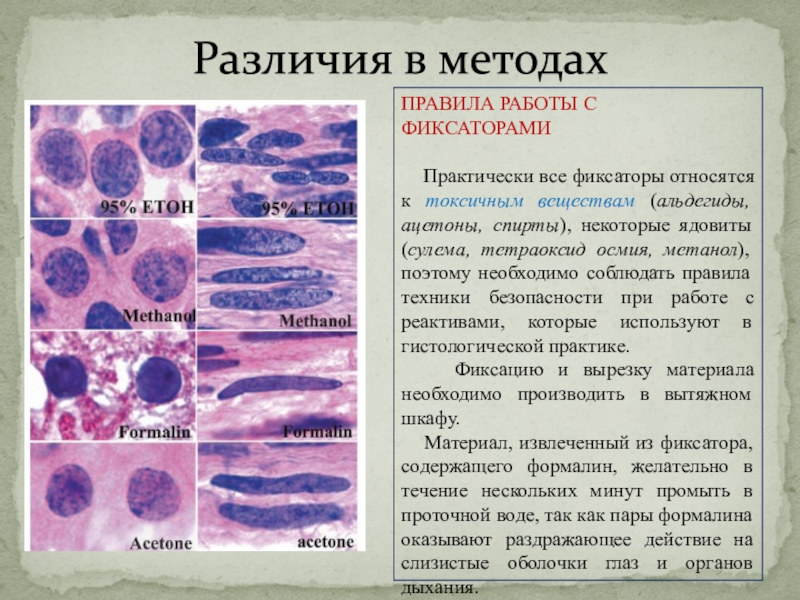
Слайд 11Различия в методах
ПРАВИЛА РАБОТЫ С ФИКСАТОРАМИ
Практически все фиксаторы
относятся к токсичным веществам (альдегиды, ацетоны, спирты), некоторые ядовиты (сулема,
тетраоксид осмия, метанол), поэтому необходимо соблюдать правила техники безопасности при работе с реактивами, которые используют в гистологической практике.
Фиксацию и вырезку материала необходимо производить в вытяжном шкафу.
Материал, извлеченный из фиксатора, содержащего формалин, желательно в течение нескольких минут промыть в проточной воде, так как пары формалина оказывают раздражающее действие на слизистые оболочки глаз и органов дыхания.
Слайд 12Обезвоживание (проводка)
Самым распространенным является обезвоживание в спиртах восходящей
концентрации, начиная с 70 %. Обычно применяют батарею спиртов, состоящую
из двух порций 96 % и двух — 100 % спирта.
Продолжительность процесса обезвоживания в спиртах в среднем 48 ч в зависимости от качества материала (содержания жира в ткани) и размера кусочков, а также от их количества.
Слайд 13Заливка материала
Парафин — смесь высокомолекулярных предельных углеводородов, продукт перегонки
нефти; растворяется в анилине, бензоле, бергамотном масле, целлозольве, хлороформе, декалине,
диоксане, бутаноле, пропаноле, толуоле, трихлорэтилене, ксилоле.
Каждый из этих растворителей можно использовать в качестве промежуточной среды между спиртом и парафином. Температура плавления различных парафинов от 27 до 62 °С.
В гистологической технике применяют парафин с температурой плавления 56 °С.
Слайд 15Микротомы
Микротомы — это приборы, с помощью которых получают срезы тканей,
залитых в различные среды, а также замороженных и нефиксированных. Микротомы
позволяют получать гистологические срезы различной толщины. По принципу действия различают санные, ротационные, замораживающие микротомы, а также криостаты и вибратомы.
Слайд 16Микротомы
Специальные ножи микротомов позволяют получить срезы толщиной:
3-8 мкм из материала,
залитого в парафин,
10-25 мкм из материала, замороженного в камере микротома-криостата
0,08-0,1 мкм из материала, подготовленного для электронной микроскопии
Слайд 17Окраска
Целью окрашивания является более отчетливое выявление различных компонентов клеток и
тканей.
Некоторые красители обеспечивают этот эффект, растворяясь в выявляемых компонентах,
например нейтральных жирах.
Другие красители вызывают химическую реакцию, например выявление железа с образованием берлинской лазури в кислой среде.
Во многих случаях процесс окрашивания возможен только при наличии протравы, например гематоксилин окрашивает ткань в присутствии солей металлов.
В гистологической практике применяют основные, кислотные и нейтральные красители.
Слайд 18Методы окрашивания
1 . Общие (тривиальные)
2. Специальные (комплексные)
3. ИГХ
4. Импрегнация
ИМПРЕГНАЦИЯ
(фр. impregnation, от лат. impraegno, impraegnatum - наполнять) в гистологии
— метод выявления некоторых тканевых структур путем пропитывания объектов гистологического исследования растворами солей металлов; участки ткани, в которых происходит восстановление металла из раствора его соли, приобретают черный или бурый цвет.
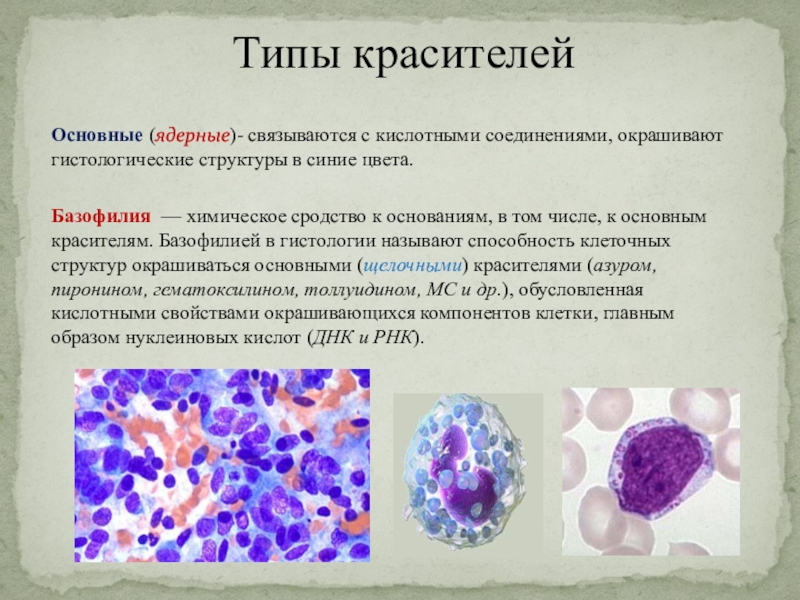
Слайд 19Типы красителей
Базофилия — химическое сродство к основаниям, в том числе,
к основным красителям. Базофилией в гистологии называют способность клеточных структур
окрашиваться основными (щелочными) красителями (азуром, пиронином, гематоксилином, толлуидином, МС и др.), обусловленная кислотными свойствами окрашивающихся компонентов клетки, главным образом нуклеиновых кислот (ДНК и РНК).
Основные (ядерные)- связываются с кислотными соединениями, окрашивают гистологические структуры в синие цвета.
Слайд 20Типы красителей
Нейтральные (окрашивают жиры) – содержат как основные, так и
кислые компоненты (судан III, судан IV, метиленовый синий).
Нейтрофилия (в гистологии!)
– способность гистологических структур окрашиваться как кислыми, так и основными красителями.
Слайд 21Типы красителей
Кислые (или цитоплазматические) красители – окрашивают преимущественно цитоплазму, реже
клеточные стенки и т. п. Соединяясь с щелочными соединениями клеточных
структур, окрашивают их в цвета красителя.
Кислые красители связываются со структурами, имеющими положительный заряд - например, белки. К таким красителям относятся эозин, эритрозин, фуксин и др.
Способность окрашиваться кислыми красителями называется оксифилией, или ацидофилией .
Оксифилия свойственна цитоплазме клеток, эритроцитам (благодаря высокой концентрации в них гемоглобина).
Оксифильно окрашивается цитоплазма кардиомиоцитов, мышечных волокон скелетной мускулатуры, некоторые компоненты межклеточного вещества (например, коллагеновые волокна).
Слайд 22Метахромазия
Метахромазия — изменение цвета водных растворов ряда основных красок (толуидиновый
синий, азур А, метиленовый синий, тионин и т. д.) в
присутствии хромотропных веществ.
Хромотропы, вызывающие метахромазию, могут быть разной химической природы, однако в биологических объектах это чаще мукополисахариды (гиалуроновая и хондроитинсерная кислоты, гепарин, кератосульфат и др.) и нуклеиновые кислоты.
В гистохимии метахромазия широко применяется для выявления кислых мукополисахаридов и нуклеиновых кислот, исследования фибриноида, амилоидной субстанции и т. д.
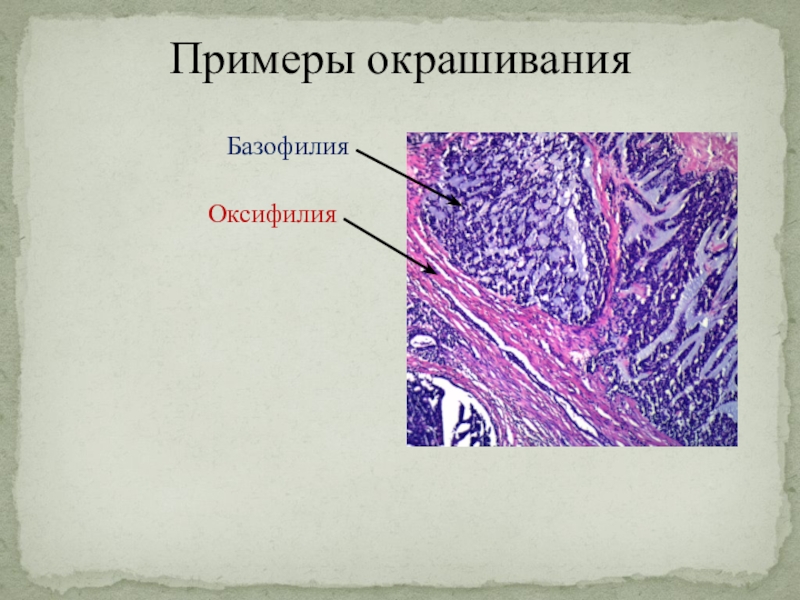
Слайд 23Примеры окрашивания
Оксифилия
Базофилия
Слайд 24Иммуногистохимические методы (ИГХ)
В основе лежит применение химических
реакций для выявления распределения химических веществ в структурах клеток, тканей
и органов. Современные гистохимические методы позволяют обнаруживать аминокислоты, белки, нуклеиновые кислоты, различные виды углеводов, липидов и т.д..
Для выявления специфических белков используют иммуноцитохимические реакции. Для этого получают специфические сыворотки, содержащие антитела (например, против белка микротрубочек — тубулина). Далее химическим путем соединяют эти антитела с флуорохромом (или другим маркером). При нанесении меченых антител на гистологический срез они вступают в соединение с соответствующими белками клетки и возникает специфическое свечение, видимое в люминесцентном микроскопе.
Современные иммуноцитохимические методы, помимо флуорохромов, используют другие самые разнообразные специфические маркеры, позволяющие качественно и количественно оценивать содержание в клетке исследуемых соединений.
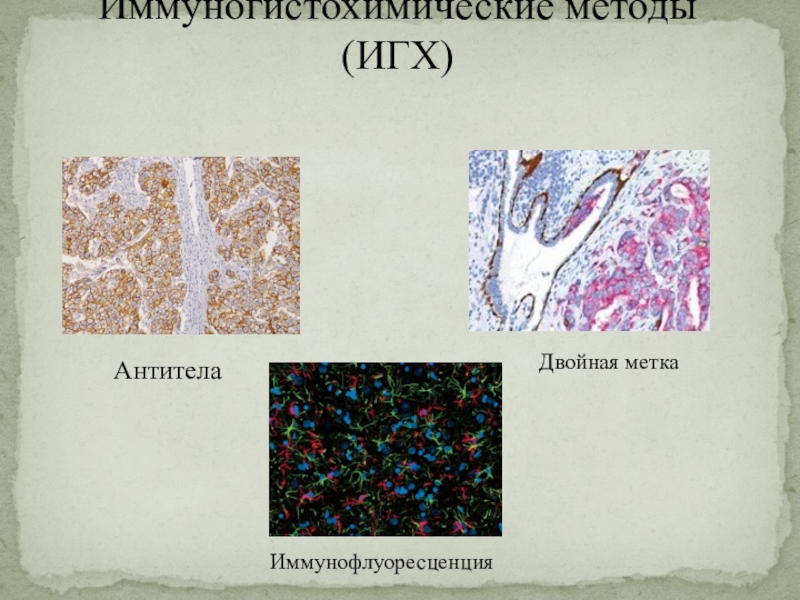
Слайд 25Иммуногистохимические методы (ИГХ)
Антитела
Двойная метка
Иммунофлуоресценция
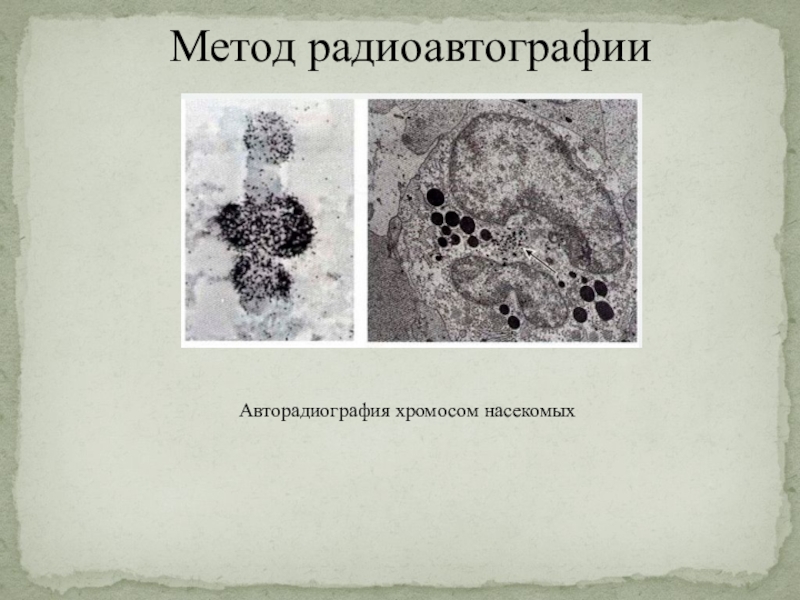
Слайд 26Метод радиоавтографии
Радиоавтография - метод изучения распределения радиоактивных
веществ в исследуемом объекте при наложении на объект чувствительной к
радиоактивным излучениям фотоэмульсии.
Введение в организм соединений, меченных радиоактивными изотопами, и дальнейшее исследование тканей и клеток позволяет получить точные данные о том, в каких именно клетках или клеточных структурах происходят те или иные процессы, локализуются те или иные вещества, установить временные параметры ряда процессов.
Так, например, применение радиоактивного фосфора дало возможность обнаружить присутствие интенсивного обмена веществ в растущей кости; применение радиоактивных изотопов йода позволили уточнить закономерности деятельности щитовидной железы; введение меченых тритием предшественников нуклеиновых кислот помогли уяснить роль в обмене этих жизненно важных соединений определённых клеточных структур.
Метод радиоавтографии позволяет определить не только локализацию радиоизотопа в биологическом объекте, но и его количество.
Слайд 27Метод радиоавтографии
Авторадиография хромосом насекомых
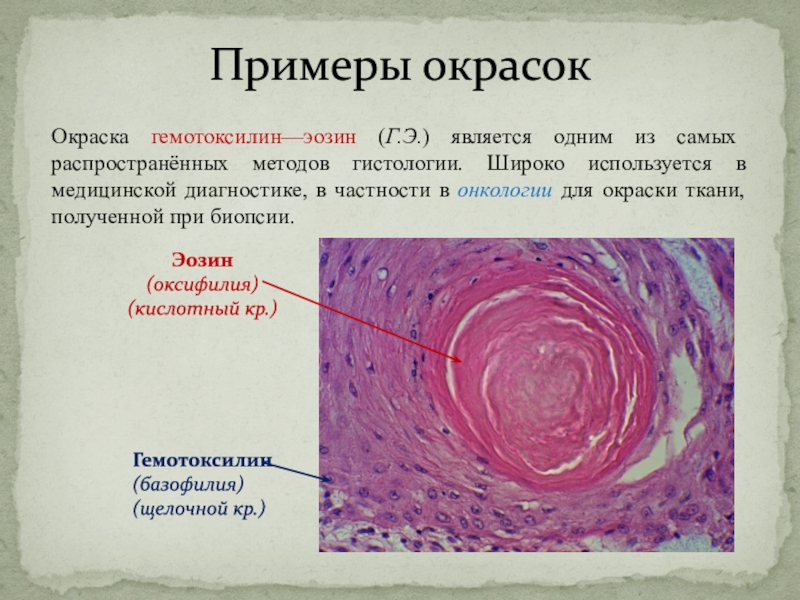
Слайд 28Примеры окрасок
Окраска гемотоксилин—эозин (Г.Э.) является одним из самых распространённых методов
гистологии. Широко используется в медицинской диагностике, в частности в онкологии
для окраски ткани, полученной при биопсии.
Гемотоксилин
(базофилия)
(щелочной кр.)
Эозин
(оксифилия)
(кислотный кр.)
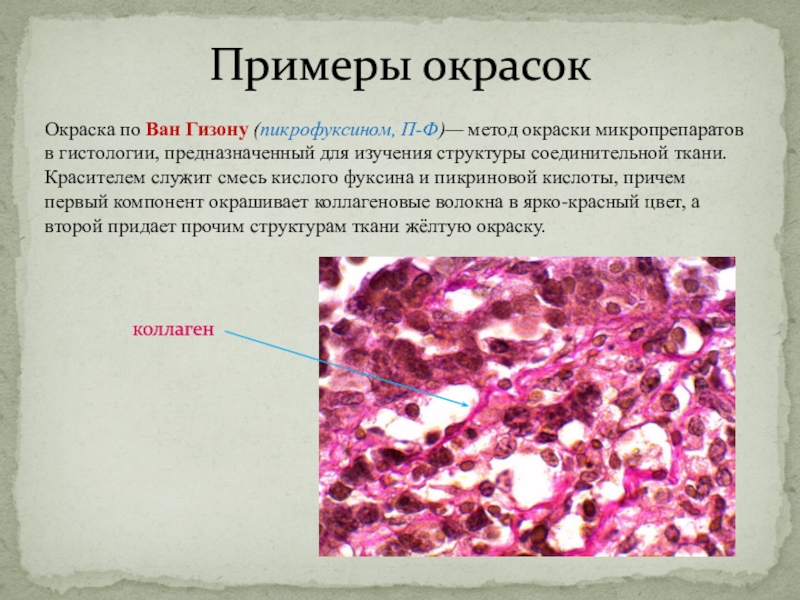
Слайд 29Примеры окрасок
Окраска по Ван Гизону (пикрофуксином, П-Ф)— метод окраски микропрепаратов
в гистологии, предназначенный для изучения структуры соединительной ткани. Красителем служит
смесь кислого фуксина и пикриновой кислоты, причем первый компонент окрашивает коллагеновые волокна в ярко-красный цвет, а второй придает прочим структурам ткани жёлтую окраску.
коллаген
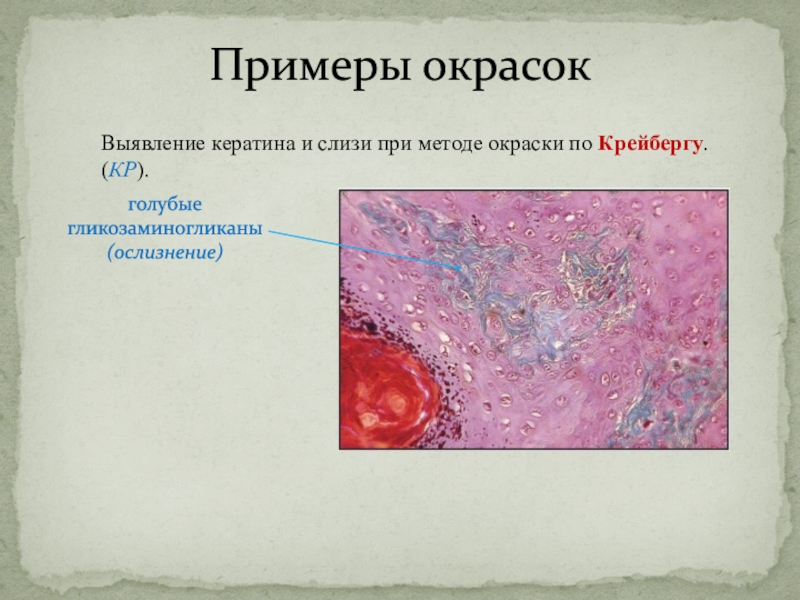
Слайд 30Примеры окрасок
Выявление кератина и слизи при методе окраски по Крейбергу.
(КР).
голубые
гликозаминогликаны
(ослизнение)
Слайд 31Примеры окрасок
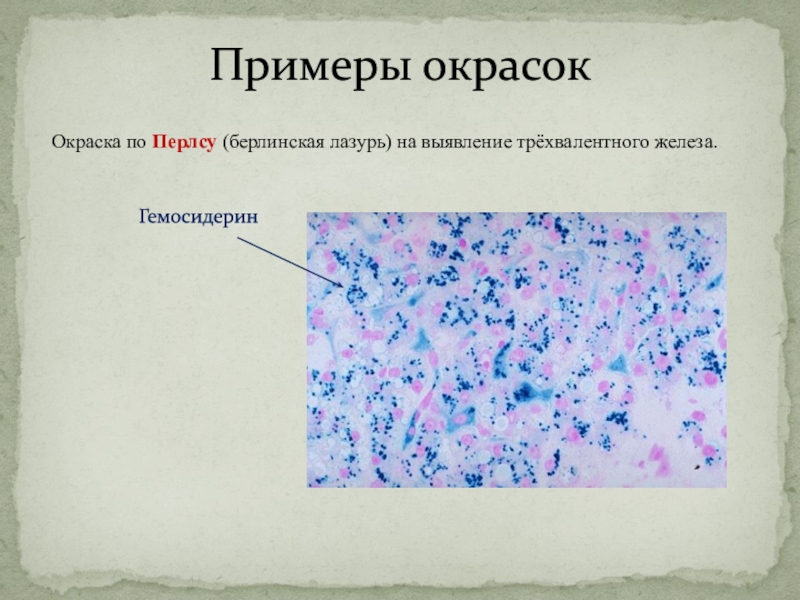
Окраска по Перлсу (берлинская лазурь) на выявление трёхвалентного железа.
Гемосидерин
Слайд 32Примеры окрасок
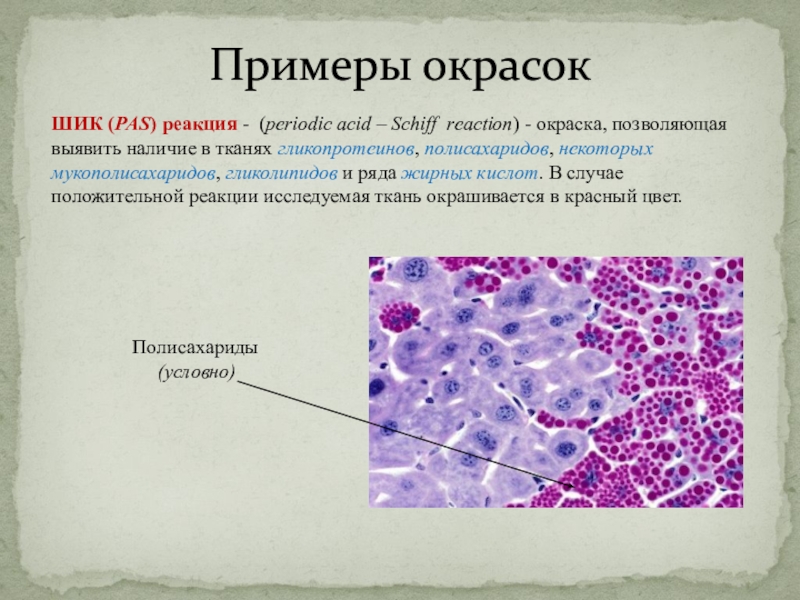
ШИК (PAS) реакция - (periodic acid – Schiff reaction)
- окраска, позволяющая выявить наличие в тканях гликопротеинов, полисахаридов, некоторых
мукополисахаридов, гликолипидов и ряда жирных кислот. В случае положительной реакции исследуемая ткань окрашивается в красный цвет.
Полисахариды
(условно)
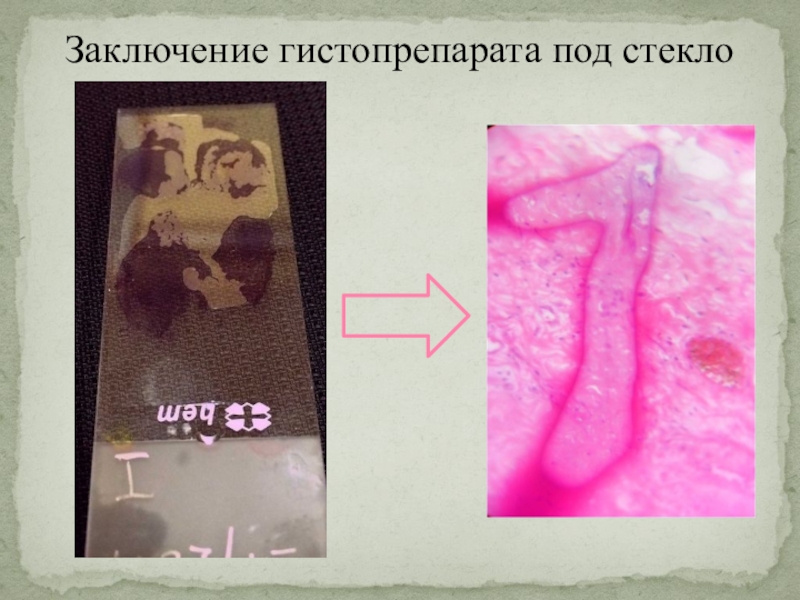
Слайд 33Заключение гистопрепарата под стекло
Окрашенные гистологические препараты обезвоживаются в
спиртах восходящей концентрации (70, 80, 90, 96, абсолютный - 100%)
и просветвляются в ксилоле, бензоле, толуоле или некоторых маслах.
Для длительного хранения обезвоженный гистологический срез заключают (монтируют) в прозрачную консервирующую среду (смолу хвойных деревьев - канадский, пихтовый бальзам, а также в синтетические среды).
На постоянном гистологическом препарате срез ткани располагается на предметном стекле, сверху закрыт покровным стеклом. Между стеклами (предметным и покровным) находится заливочная среда, обладающая коэффициентом преломления световых лучей, близким к таковому у стекла.
Слайд 34Заключение гистопрепарата под стекло
Аппарат для заключения под покровные стёкла HCM
6000
Слайд 35Заключение гистопрепарата под стекло