Слайд 1Дисциплина «Материаловедение и ТКМ», лекция 1.1
Физические и химические структуры.
Слайд 2УЧЕБНЫЕ ВОПРОСЫ:
1. Химические структуры. Виды химических связей: металлическая, ионная, ковалентная.
2. Физические структуры. Межмолекулярные связи.
3. Кристаллические структуры. Кристаллические решетки. Полиморфизм.
Анизотропия. Аморфная структура
4.Дефектность материалов. Виды дефектов. Влияние дефектов на свойства материалов.
Слайд 3Литература
Арзамасцев В.Б., А.Н. Волчков, В.А. Головин и др. Материаловедение и
технология конструкционных материалов: учебник для студентов высших учебных заведений –
М., Издательский центр «Академия», 2009 г., 448 с. С.7-20.
Валуев Н.П., Муров В.А., Пушкин И.А. Материаловедение и безопасность материалов. Структура и свойства материалов. Металлические материалы. – Учебник. - Химки: АГЗ МЧС России, 2012 г., 181 с. С. 15-48.
https://biblioclub.ru/index.php?page=book_red&id=445841 Конструкционные электротехнические материалы: учебное пособие. Москва, Под редакцией: Горелов В.П. Берлин: Директ-Медиа, 2016, 341 с. С. 20-37.
Слайд 4Химические структуры. Виды химических связей: металлическая, ионная, ковалентная
Химическая структура вещества
представляет собой взаимное расположение атомов и атомов в молекулах, удерживаемых
химическими связями различного вида.
Для большинства материалов энергия химических связей приблизительно на порядок больше, чем энергия механических связей
Виды химической связи
Ковалентная (полярная и неполярная)
Ионная
Металлическая
Координационная
Водородная
Межмолекулярное взаимодействие электрической природы
В чистом виде перечисленные типы связей проявляются редко. В большинстве соединений имеет место наложение разных типов связей. При этом любая химическая связь образуется только тогда, когда сближение атомов приводит к уменьшению полной энергии системы.
Слайд 5Ковалентная и ионная связь
ковалентная связь, которая осуществляется парой электронов,
общих для двух атомов, образующих связь. Атомы в молекуле могут
быть соединены неполной ковалентной связью: одинарной (Н2, Н3С−СН3), двойной (Н2С=СН2), тройной (N2, HC≡CH) или полярной (НС1, Н3С—СГ) в зависимости от электроотрицательности;
ионная связь, в основе которой лежит электростатическое взаимодействие между противоположно заряженными ионами - электрически заряженными частицами, которые образуются из атома (молекулы) в результате потери или присоединения одного или нескольких электронов. Положительно заряженные ионы называются катионами, отрицательно заряженные — анионами. Примеры ионной связи - молекулы NaCl и KF;
Слайд 6Металлическая и координационная связь
металлическая связь, которая проявляется при взаимодействии атомов
элементов, имеющих избыток свободных валентных орбиталей по отношению к числу
валентных электронов; эту связь можно представить так: ионный кристаллический остов погружен в электронный газ - свободные электроны, которые непрерывно перемещаются между положительными ионами и компенсируют электростатическое отталкивание ионов, связывая их в твердое тело;
координационная (донорно-акцепторная) связь характерна для комплексных соединений (гемоглобин, хлорофилл и др.), в молекулах которых выделяют центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды, обычно 4 или 6). Координационная связь обусловлена передачей электронной пары с заполненной орбитали донора на вакантную орбиталь центрального атома (акцептора) с образованием общей связывающей молекулярные орбитали. При этом центральный атом и лиганды образуют внутреннюю сферу. Внешнюю сферу составляют ионы, заряд которых компенсирует заряд внутренней сферы. Например, в [Со(МН3)6]С13 совокупность атомов в квадратных скобках - внутренняя сфера, Со - центральный атом, NH3 - лиганды, ионы С1 - внешняя сфера.

Слайд 7Водородная связь и молекулярное взаимодействие электрической природы
(взаимодействие Ван-лер-Ваальса)
Водородная связь образуется
в результате взаимодействия атома водорода, связанного ковалентной связью, с электроотрицательным
атомом и неподеленной парой электронов другого атома. Атомы могут принадлежать как одной, так и разным молекулам. Водородная связь приводит к ассоциации одинаковых или различных молекул в комплексы; она во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства белков, нуклеиновых кислот и др.
Межмолекулярные взаимодействия электрической природы происходят между молекулами с насыщенными химическими связями. Впервые существование такого взаимодействия принял во внимание Я.Д. Ван-дер-Ваальс (1873) для объяснения свойств реальных газов и жидкостей.
Эти виды связи относят Межмолекулярным связям, а образованные ими структуры к физическим.
Слайд 8Кристаллические структуры. Кристаллические решетки. Полиморфизм. Анизотропия. Аморфная структура
Кристаллическая решетка —
это воображаемый геометрический образ для анализа строения кристаллов, который представляет
собой объемно-пространственную сетчатую структуру, в узлах которой располагаются атомы, ионы или молекулы вещества.
Основой кристаллической решетки является элементарная ячейка, которая повторяется в кристалле бесконечное количество раз. Элементарная ячейка — это наименьшая структурная единица кристаллической решетки, которая обнаруживает все свойства ее симметрии.
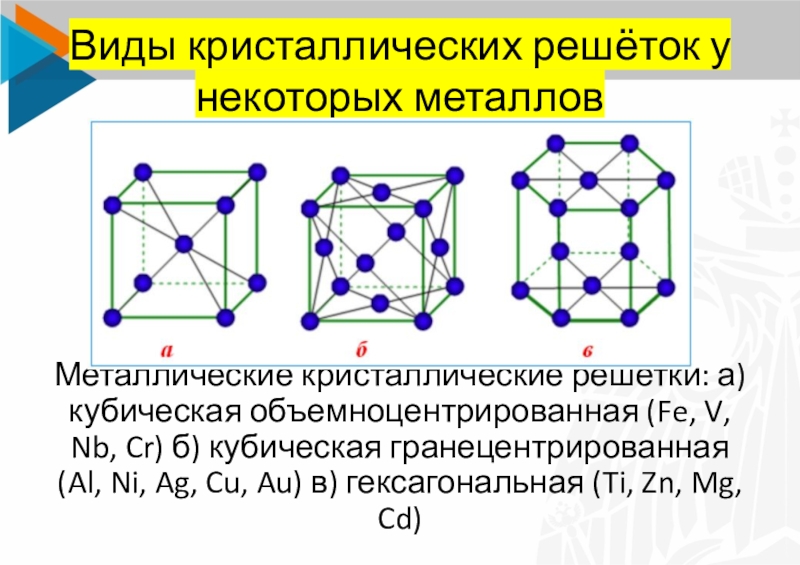
Слайд 9Виды кристаллических решёток у некоторых металлов
Металлические кристаллические решетки: а) кубическая
объемноцентрированная (Fe, V, Nb, Cr) б) кубическая гранецентрированная (Al, Ni,
Ag, Cu, Au) в) гексагональная (Ti, Zn, Mg, Cd)
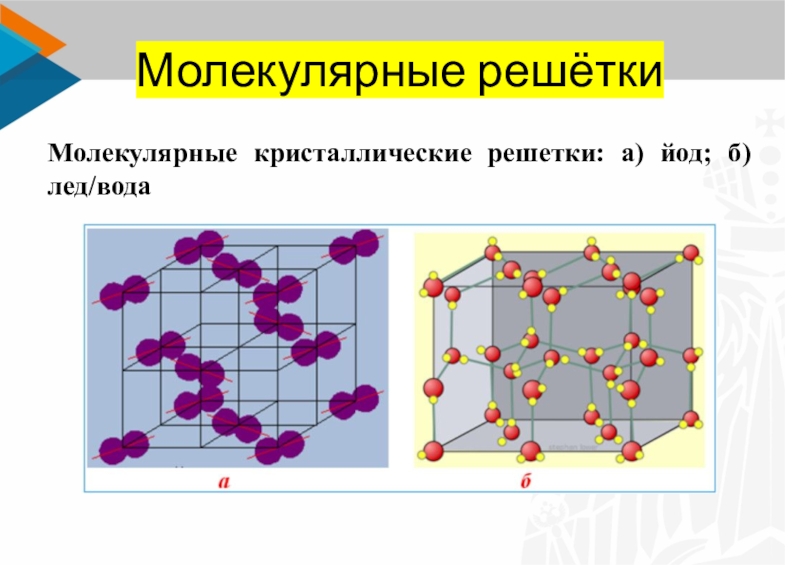
Слайд 10Молекулярные решётки
Молекулярные кристаллические решетки: а) йод; б) лед/вода
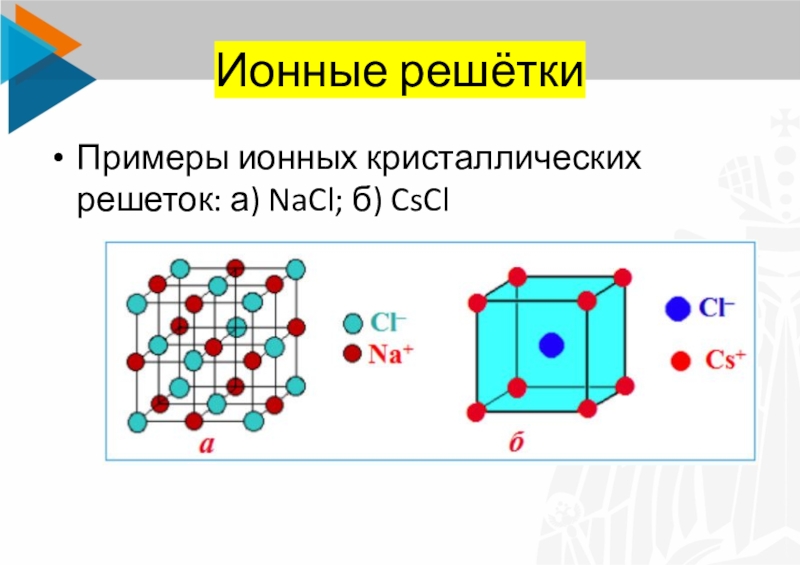
Слайд 11Ионные решётки
Примеры ионных кристаллических решеток: а) NaCl; б) CsCl
Слайд 12Полиморфизм. Анизотропия.
Полиморфи́зм криста́ллов (от др.-греч. πολύμορφος «многообразный») - способность
вещества существовать в различных кристаллических структурах, называемых полиморфными модификациями (их
принято обозначать греческими буквами α, β, γ и т. д.) Характерен для различных классов веществ. Полиморфизм для простых веществ называют аллотропией, но понятие полиморфизма не относят к некристаллическим аллотропным формам (таким, как газообразные O2 и O3).
Частный случай полиморфизма, характерный для соединений со слоистой структурой - политипи́зм (политипи́я). Такие модификации, политипы, отличаются между собой лишь порядком чередования атомных слоёв.
Анизотропи́я (от др.-греч. ἄνισος — неравный и τρόπος — направление) — различие свойств среды (например, физических: упругости, электропроводности, теплопроводности, показателя преломления, скорости звука или света и др.) в различных направлениях внутри этой среды; в противоположность изотропии.
В отношении одних свойств среда может быть изотропна, а в отношении других — анизотропна; степень анизотропии также может различаться.
Слайд 13Аморфная структура
Аморфная структура является одним из физических состояний твердых тел,
Аморфные вещества характеризуются двумя особенностями. Во-первых, свойства таких веществ при
обычных условиях не зависят от выбранного направления, т.е. они - изотропны. Во-вторых, при повышении температуры происходит размягчение аморфного вещества и постепенный переход его в жидкое состояние. Точное значение температуры плавления отсутствует.
Общим для кристаллического и аморфного состояний веществ является отсутствие поступательного перемещения частиц и сохранение только их колебательного движения около положения равновесия. Различие между ними состоит в наличии геометрически правильной решетки у кристаллов и отсутствии дальнего порядка в расположении атомов у аморфных веществ.
Аморфное состояние вещества, по сравнению с кристаллическим, всегда менее устойчиво и обладает избыточным запасом внутренней энергии. В связи с этим, при определенных условиях, самопроизвольно осуществляется переход из аморфного состояние в кристаллическое.
Слайд 14Дефектность материалов. Виды дефектов. Влияние дефектов на свойства материалов.
Вакансии
Дефекты замещения
Дефекты
внедрения
Дислокации и дисклинации
Дефекты снижают прочностные характеристики материалов, что связано с
изменением внутренней энергии материала, за счёт изменений, происходящих в его структуре.
Слайд 15Деффекты в кристалличеких материалах (2)
Вака́нсия (от лат. vacans — пустующий,
свободный) — дефект кристалла, представляющий собой узел, в котором отсутствует
атом (ион). Иначе говоря, вакансия — место, где в случае идеального кристалла должен располагаться атом (ион), но в действительности его в этом положении
Дислока́ция — линейный дефект или нарушение кристаллической решётки твёрдого тела. Наличие дислокаций существенно влияет на механические и другие физические свойства твердого тела.. Выделяют два основных типа дислокаций: краевые и винтовые. Дислокации смешанного типа являются комбинацией указанных двух типов
Слайд 16Благодарю за внимание!
tvernick@ mail.ru