Слайд 1
Для оцінки параметрів клітинного циклу, які є визначальними
при дослідженнях культивованих клітин використовують різні підходи.
1.Найбільш широко використовуваний метод
– це підрахунок клітин з застосуванням вітального барвника трипанового синього, який включається в мертві клітини.
2.На сьогодні широко вживаними є також методи колориметричної візуалізації клітин за включенням прижиттєвих барвників мітохондріальними дегідрогеназами.
3.Також важливим етапом є цитофлуориметричний аналіз, що дозволяє за включенням інтерколюючих барвників в ДНК визначати як рівень апоптотичних клітин, так і розподіл клітин за фазами клітинного циклу.
4.Метод радіоізотопний, який базується на включенні Н3-тимідину в ДНК під час її реплікації.
Слайд 2Визначення параметрів синтезу ДНК часто розглядають як репрезентативний метод кількісної
оцінки процесів проліферації.
В подібних дослідженнях використовують[3H]-тимідин або [3Н]-дезоксицитидин.
Експозиція
з одним із цих агентів може бути короткостроковою (1,5-2 години) у випадку оцінки синтезу ДНК, або довготривалою до 24 годин та більше для визначення накопичення синтезованої ДНК. В останньому випадку це стосується культур високої щільності (майже 100% моношар), або ж в повільно ростучих культурах (більше мова йде про первинні та нетрансформовані культури).
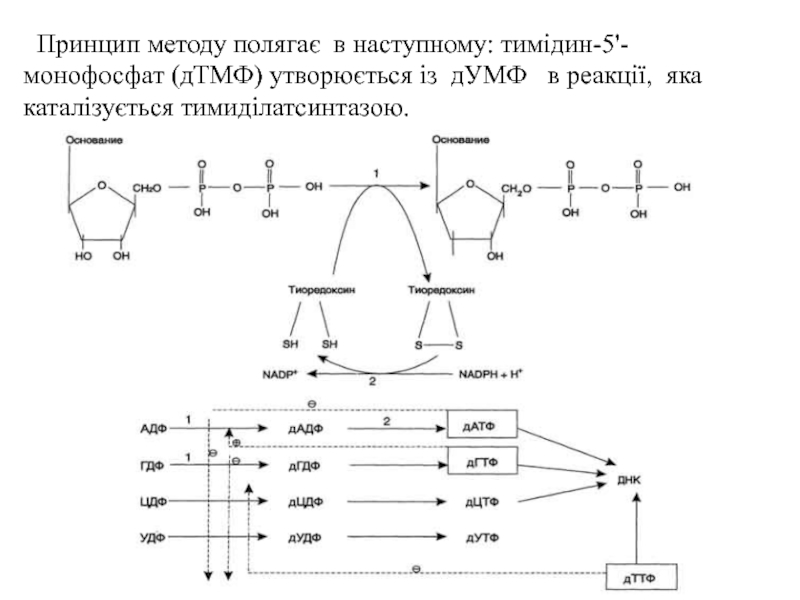
Слайд 3 Принцип методу полягає в наступному: тимідин-5'-монофосфат (дТМФ) утворюється із
дУМФ в реакції, яка каталізується тимиділатсинтазою.
Слайд 4
Однак при роботі з ізотопними методами дуже великі вимоги
до безпеки досліджень.
[3Н]-тимідин є біологічно небезпечною речовиною, так як
радіаційно ушкоджує ДНК. Тому при роботі з ізотопними мітками слід працювати в боксі з великим ступенем біологічної безпеки з дотриманням всіх необхідних правил щодо роботи з речовинами, які відносяться до особливо небезпечних речовин (1 список). При цьому не можна використовувати ламінарний бокс з горизонтальним потоком повітря, оскільки аерозоль буде видуватись безпосередньо в дихальні шляхи працюючого. Іншим побічним ефектом подібних досліджень є дуже велика залежність від терміну та умов інкубації з ізотопами. Інкубація після короткочасового впливу [3Н]-тимідину та промивка в холодному фосфатно-сольовому буфері дозволяє визначити включення мітки та при дотриманні тривалості експерименту в декілька хвилин дає пряме визначення однонаправленого потоку міченого [3Н]-тимідину.
Слайд 5 Із сучасних методів, які використовуються для дослідження популяційного розподілу
клітин використовується проточна цитометрія Проточна цитометрія клітинної сузпензії [Vaughan &Miller,1989],
в зразку з концентрацією до 1x107 клітин дозволяє визначити різні клітинні компоненти та їх активності [Kurtz & Wells, 1979; Klingel et al., 1994].
Цей метод дає можливість вивчати кореляційні взаємозв’язки цих параметрів з іншими такими як розмір клітин, лінія диференціювання, вміст ДНК та життєздатність клітин [Al-Rubeai et al., 1997].
Слайд 6 Переваги цитофлуориметричного методу:
-Можливість високого ступеню автоматизації методу
-Висока швидкість аналізу
-Аналіз
великої кількості клітин (до 108)
-Використання статистичних та математичних моделей, які
суттєво збільшують можливості аналізу результатів
-Об’єктивне визначення інтенсивності флуоресценції
-Визначення параметрів малих субпопуляцій та частин, що рідко зустрічаються (завдяки великій вибірці об’єктів аналізу)
-Технічні можливості та програмне забезпечення сучасних цитофлуориметрів дозволяють на одному зразку проаналізувати декілька субпопуляцій клітин, використовуючи морфологічні характеристики та флуоресценцію декількох видів моноклональних антитіл, які селективно зв’язуються з певними поверхневими антигенами
-Можливість проводити сортинг клітин по певним параметрам
Слайд 7Проточна цитометрія являє собою техніку швидкого оптичного аналізу окремо взятих
клітин.
Методика полягає в визначенні розсіяння світла лазерного променя при
проходженні через нього клітини в рідині, причому ступінь світлової дисперсії дозволяє отримати уявлення про розміри та структуру клітини.
Слайд 8
Фотометричні канали використовують для оцінки розмірів клітин та внутрішньоклітинних
структур. Флуоресцентні канали застосовують з метою вивчення клітинних маркерів та
з цією метою застосовують моноклональні антитіла (МАТ або МКА) до мембранних та внутрішньоклітинних компонентів клітин (білків, ДНК, РНК), мічених різними флуорохромними барвниками.
Для флуоресцентного мічення використовують ряд флуорохромів, таких як:
флюоресцеїнізотіоціанат (FITC),
тетраметилродамін (TRITC),
фікоеритрин (PE),
білок хлорофіла -перидинхлорофіл протеїн (PerCp),
алко-фікоціанін (APC),
тандем-ціанін-5/фікоеритринCy5/PE),
ефiр 5(6)- карбофлуоресцеїн дiацетат N-сукцинiмiдилу (CFSE) та інші.
Слайд 9
В сучасних цитофлуориметрах використовуються 2-, 3- та
4-кольорні мітки при наявності другого джерела світла. При дії на
них лазерним променем флуоресцентні барвники, які входять в склад таких реагентів, генерують різні кольори, що дозволяє визначати 2 або 3 антигени одночасно.
З цією метою сучасні моделі цитометрів обладнані 4 фотопомножувачами з високою роздільною здатністю на наступних довжинах хвиль: 530 нм (FITC), 585 нм (фікоеритрин-пропідіум йодит), 661 нм (АРС), більше 650 нм (PerCp), при наявності другого лазеру — вище 670 нм (PerCP,CY5/PE).
Розпізнавання порогу антигенної експресії є різним для кожного флуорохрома. Для виявлення антигенів з низькою експресією використовують, як правило, МАТ з яскравим флуорохромом РЕ або менш яскравим Су5/РЕ.
Слайд 10
Аналіз флуориметрії проводять по п’яти основним параметрам:
по
двом характеристикам світлорозсіювання клітин— показники прямого та бокового світлорозсіювання;
по трьом каналам детекції специфічного флуоресцентного сигналу барвників на різних довжинах хвиль.
Перетворення світлового сигналу в електричний сигнал супроводжується спеціальною програмою перерахунку кількісної величини кожного вимірюваного параметра. Всі величини дискредитуються та передаються на дисплей, а потім з використанням спеціальних програм аналізуються. При використанні багатокольорних реагентів можна одночасно отримувати інформацію про декілька антигенів, та структурних і функціональних характеристик клітини.
Слайд 11
Визначення швидкості клітинної проліферації часто використовується для визначення реакції
клітин на окремі стимули або токсини.
Кількісний аналіз кривої росту
також важливий при звичайній підтримці культури, оскільки він є вирішальним елементом для моніторингу сталості культури та дозволяє визначати найкращий час для субкультивування, оптимальне розведення, та оцінити ефективність посіву при різній клітинній щільності на одиницю субстрату.
Тестування середовища, сироватки, нового культурального посуду або субстратів також потребують кількісної та якісної оцінки культури.
Слайд 12
Дані щодо стадії росту культури, параметрів її кінетики є
критичними для планування експериментів на культурах клітин. Культури (в першу
чергу це стосується первинних) суттєво відрізняються одна від одної за багатьма властивостями в lag-фазі, періоді експоненційного росту (log-фазі) та періоді стаціонарного росту («проліферативного спокою», плато).
Таким чином, важливо брати до уваги не тільки стан культури, а й стадію початку експерименту, час відбору зразків, для того, щоб визначити наявність та інтенсивність проліферації, а також час подвоєння популяції (PDT) та тривалість клітинного циклу
Слайд 13
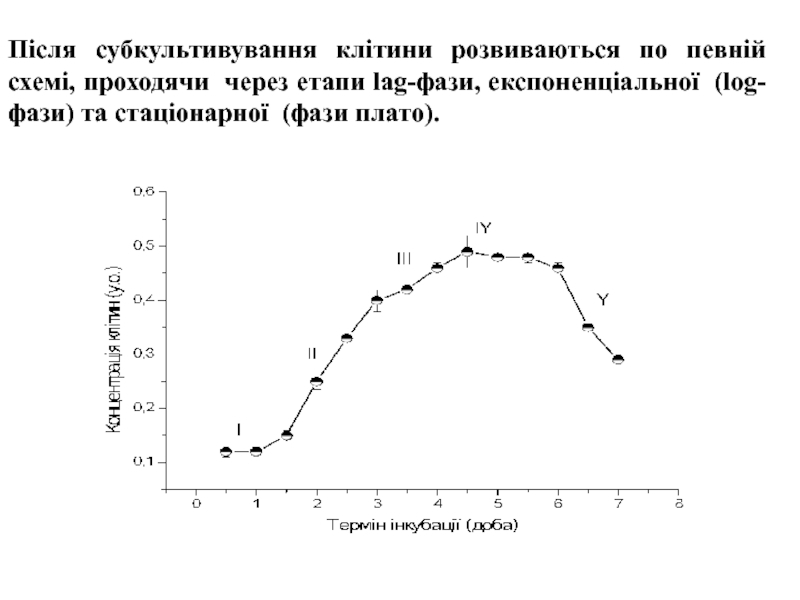
Після субкультивування клітини розвиваються по певній схемі, проходячи через
етапи lag-фази, експоненціальної (log-фази) та стаціонарної (фази плато).
Слайд 14
Експоненційна фаза росту та стаціонарна дають надзвичайно важливу інформацію
про клітинну лінію, в тому числі час подвоєння клітинної популяції
(PDT) в ході експоненційного росту та максимум клітинної щільності, що досягається в фазі плато ( тобто щільності насичення). Визначення PDT використовується для кількісної оцінки відповіді клітинної популяції на різні інгібітори, або стимулятори культур, такі як концентрація поживних речовин, дія гормонів або токсичності препаратів
Слайд 15
Окремі часові точки недостатні для моніторингу культури, якщо невідомі
параметри та форми кривої росту клітинної популяції.
Зниження кількості клітин,
після, наприклад 5 днів може бути викликана зниженням темпів росту деяких, або всіх клітин; подовженням lag-періоду, як за рахунок адаптації клітин, так і їх втратою (не завжди просто визначити відмінності між останніми двома процесами); або зниження щільності насичення.
Якщо при моніторингу культури відповідь на вплив виявляється повністю охарактеризованим, та тип відповіді є прогнозованим (наприклад, зміна PDT), то окремі точки спостереження можуть бути визначені як відомі в середині log-фази. Криві росту, зокрема, є дуже необхідними для визначення щільності насичення.
Слайд 16
За даними визначення параметрів росту клітинної субпопуляції готують
сертифікат клітинної лінії, де вказують:
Походження – (наприклад –людина, або вид
тварин, орган, або біологічна рідина)
Морфологія - (лімфоїдна, фібробластоподібна і т.д)
Спосіб культивування (суспензійний, моношаровий)
Умови культивування (а)середовище культивування - RPMI 1640, F12, MEM, DMEM і т.д.; б)сироватка ембріонів великої рогатої худоби (0-25%) або безсивороткове культивування; в)процедура пересіву з вказанням оптимальної щільності клітин на субстраті, або в суспензії; г) кріоконсервація з вказанням кріопротекторів (ДМСО, гліцерин і т.д.), програми кріоконсервації та концентрації заморожуваних клітин )
Період подвоєння клітинної популяції
Життєздатність після кріоконсервації (наприклад 70%, після зафарбовування трипановим синім на нульовому пасажі)
Слайд 17
Контроль контамінації (бактерії, гриби, мікоплазма не виявлені)
Контроль видової приналежності:
(каріологічний аналіз)
Каріологія (наприклад для людини 2n=46, межі мінливості по числу
хромосом, модальне число хромосом, кількість поліплоїдів, анеуплоїдія, певні мутації при генетичних захворюваннях і т.д.)
Ефективність клонування
Інші характеристики (туморогенність, чутливість до певних вірусів, гормонів, реалізація програми диференціювання і т.д.)
Галузь застосування (наприклад, імунологія, вірусологія, токсикологічний скринінг, біотехнологія, медицини і т.д.)
Слайд 18
Запитання:
Методи визначення кривої росту клітинної популяції
Принцип ізотопних методів визначення
синтезу ДНК
Цитофлуориметричний метод-фізичний принцип
Найпоширеніші флуорохроми, які застосовуються в цитометрії
Переваги цитометричного
методу.
Основні фази росту клітинної популяції
Основні характеристики клітинної лінії, що вносяться в сертифікат

![Для оцінки параметрів клітинного циклу, які є визначальними при дослідженнях Визначення параметрів синтезу ДНК часто розглядають як репрезентативний метод кількісної оцінки Визначення параметрів синтезу ДНК часто розглядають як репрезентативний метод кількісної оцінки процесів проліферації. В подібних дослідженнях використовують[3H]-тимідин](/img/tmb/4/347899/d143313037207365d47ba308b3cd3e15-800x.jpg)
![Для оцінки параметрів клітинного циклу, які є визначальними при дослідженнях Однак при роботі з ізотопними методами дуже великі вимоги до Однак при роботі з ізотопними методами дуже великі вимоги до безпеки досліджень. [3Н]-тимідин є біологічно небезпечною](/img/tmb/4/347899/571b4ba6d44e12c65bd911cc178b9c02-800x.jpg)