Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дәріс №4 Сабақтың тақырыбы : Гиббс теңдеуі бойынша сұйықтық газ шекарасындағы
Содержание
- 1. Дәріс №4 Сабақтың тақырыбы : Гиббс теңдеуі бойынша сұйықтық газ шекарасындағы
- 2. Слайд 2
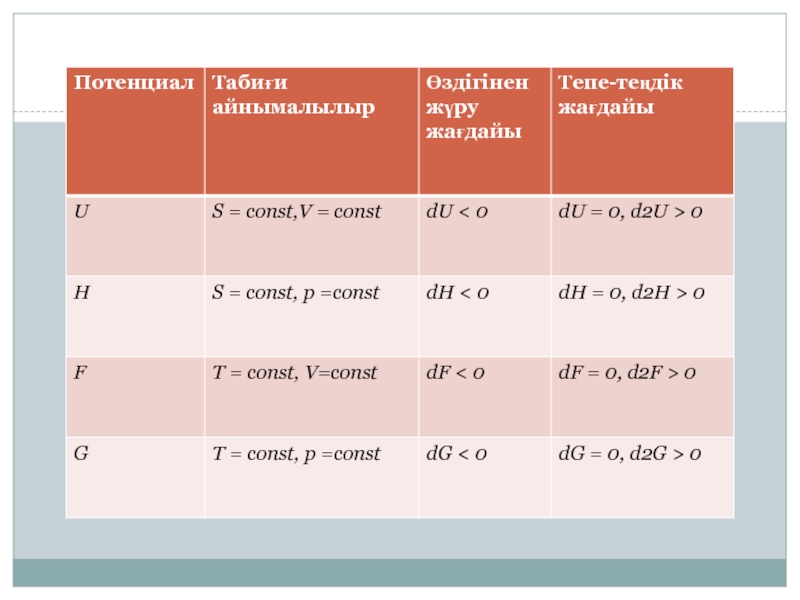
- 3. Гиббс энергиялары G = Н – ТS шамасы
- 4. Гельмгольц энергиялары Гельмгольц энергиясы Ғ немесе изохорлы изотермиялық
- 5. Температура өзгергенде Гиббс және Гельмгольц энергияларының өзгеруі
- 6. F және G функциялары күй функциялары болып
- 7. Изотермиялық ұлғаю немесе сығылу жағдайындағы Гиббс және
- 8. Слайд 8
- 9. Химиялық реакция кезінде Гиббс және Гельмгольц энергияларының
- 10. ІІ. Реакцияның жылу эффектісіне ұқсас, Гиббс энергиясының
- 11. Химиялық (а) және фазалық (б) тепе-теңдікті есептеу
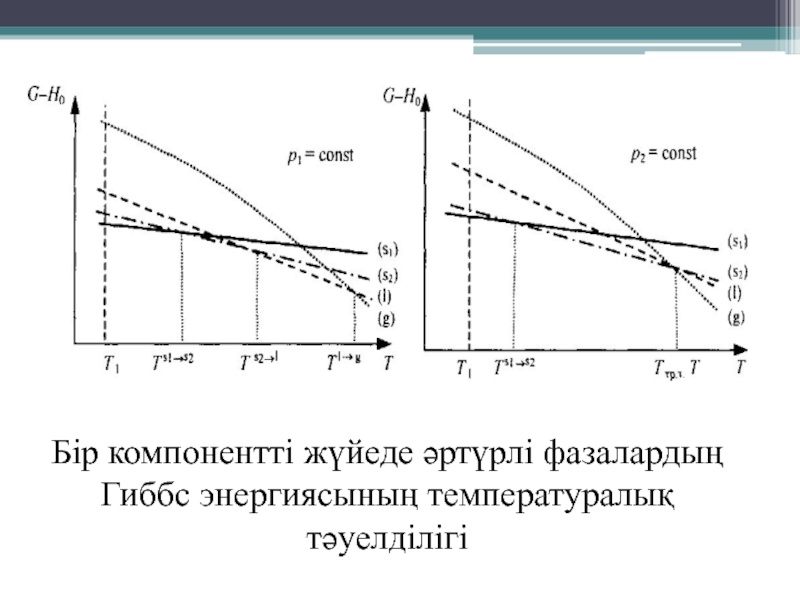
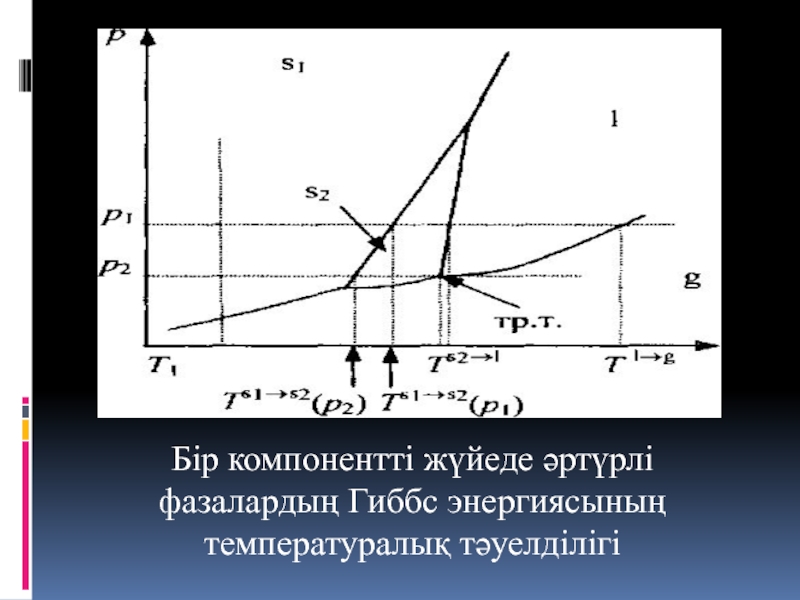
- 12. Бір компонентті жүйеде әртүрлі фазалардың Гиббс энергиясының температуралық тәуелділігі
- 13. Бір компонентті жүйеде әртүрлі фазалардың Гиббс энергиясының температуралық тәуелділігі
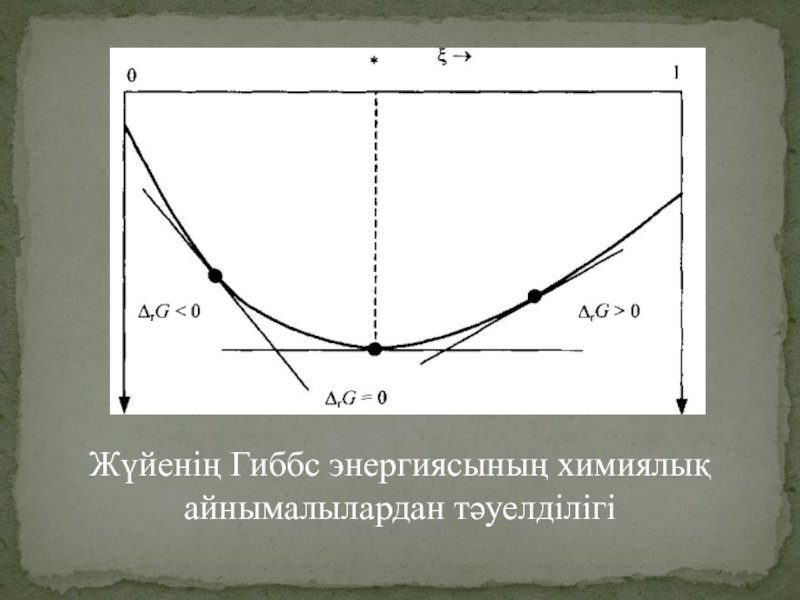
- 14. Жүйенің Гиббс энергиясының химиялық айнымалылардан тәуелділігі
- 15. Гиббс және Гельмгольц энергиялары төмендесе, экзэргоникалық, ал
- 16. Термодинамикалық потенциалдың басқа да маңызды мағынасы, оның
- 17. Слайд 17
- 18. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Дәріс №4 Сабақтың тақырыбы: Гиббс теңдеуі бойынша сұйықтық газ шекарасындағы адсорбциондық
тепе-теңдік. Гельмгольц және Гибсс энергиялары
Слайд 2
Гельмгольц теориясы
Қос электр қабатының шамасын өлшейтін
бірінші теорияны 1849 жылы Гельмгольц
зерттеп
ұсынды. Ол қос электр қабатын сұйық
ерітінді ішінде беткі қабаты қарама-қарсы
зарядталып,
бірінен-бірі молекулалық өлшемде(қашықтықта) орналасқан параллель жазық
конденсатор ретінде қарастырды.
Слайд 3Гиббс энергиялары
G = Н – ТS шамасы Гиббс энергиясы деп
аталады, бұрын изобарлы изотермиялық потенциал деп аталған, ал медицинада еркін
энергия деп аталады, негізінде тұрақты қысымдағы еркін энергия деп атау керек. Себебі химиялық термодинамикада еркін энергия болып,Слайд 4Гельмгольц энергиялары
Гельмгольц энергиясы Ғ немесе изохорлы изотермиялық потенциал есептеледі :
Ғ = U ТS. Бұл энергия тұрақты көлемде жүретін
процестерді сипаттайды, оның Гиббс энергиясынан рV мөлшеріне айырмашылығы бар :G = Ғ + рV
G тұрақты қысымдағы еркін энергия.
Ғ тұрақты көлемдегі еркін энергия.
Слайд 5Температура өзгергенде Гиббс және Гельмгольц энергияларының өзгеруі
Жабық жүйелерде Гиббс
және Гельмгольц
энергияларының температураға тәуелділігін
фундаментал теңдеу көмегімен:
dF=-SdT-pdV; dG=-SdT+Vdp
немесе
Гиббс – Гельмгольц теңдеуінің кӛмегіменанықтауға болады:
Слайд 6F және G функциялары күй функциялары болып есептеледі:
Бұл теңдеулерді
интегралдау үшін жүйенің жылу сыйымдылығымен анықталатын энтропияның температуралық тәуелділігін білу
қажет.Слайд 7Изотермиялық ұлғаю немесе сығылу жағдайындағы Гиббс және Гельмгольц энергияларының өзгеруі
Тұрақты температурада Гиббс және
Гельмгольц энергияларының қысым мен
көлемге тәуелділігін туындыларды интеграл
дау
арқылы анықтауға болады: Бұл тәуелділікті қарастыру үшін фазаның күй
теңдеуін білу қажет. Идеал газ үшін:
Слайд 9Химиялық реакция кезінде Гиббс және Гельмгольц энергияларының өзгеруі
Химиялық реакцияларда
F және G
функцияларының ӛзгеруін есептеуді бірнеше әдістермен
жүргізуге болады.
І. Анықтама
бойынша . Егер реакция ӛнімдері мен бастапқы заттар бірдей температурада болса, химиялық реакцияның Гиббс энергиясының өзгеруі
Стандартты жағдайда
Слайд 10ІІ. Реакцияның жылу эффектісіне ұқсас, Гиббс энергиясының ӛзгеруін реагенттер мен
ӛнімдердің түзілуінің стандартты Гиббс энергиясын қолданып, есептеуге болады:
Идеал газдардың арасындағы химиялық реакциялардың Гельмгольц энергиясының ӛзгеруі Гиббс энергиясымен байланысты:
мұндағы – реакция барысында газтәрізді заттардың мольдерінің мӛлшерінің өзгеруі. Аз қысымда, конденсацияланған фазадағы реакциялар үшін
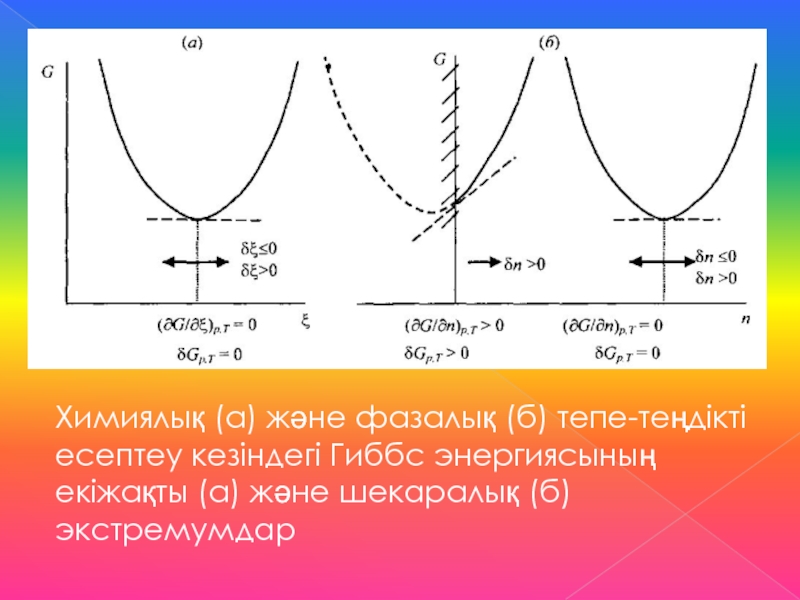
Слайд 11Химиялық (а) және фазалық (б) тепе-теңдікті есептеу кезіндегі Гиббс энергиясының
екіжақты (а) және шекаралық (б) экстремумдар
Слайд 15Гиббс және Гельмгольц энергиялары төмендесе, экзэргоникалық, ал олар жоғарыласа, эндэргоникалық
процестер орындалады.
Тұрақты қысым мен температурада жүретін химиялық процестердің еркін энергиясының
өзгерісі ∆G бастапқы заттар мен түзілген өнімдердің құрамына және күйіне тәуелді болады, бірақ процестің жүру әдісіне байланысты болмайды және мына теңдеу бойынша есептеледі :∆G = ∑ ∆G т.з. ∑ ∆Gб.з.